Politechnika Łódzka Natalia Zioło
Wydział Budownictwa Architektury Piotr Zarzycki
i Inżynierii Środowiska Alicja Woźniak
Kierunek: Inżynieria Środowiska
Oznaczanie chlorków i siarczanów
Poznanie zasady oznaczania chlorków metodą Mohra
Poznanie zasady oznaczania siarczanów metodą wagową
Zinterpretowanie wyników.
Chlorki i siarczany - występowanie w wodach naturalnych.
Chlorki pochodzące z gleby lub z pokładów soli znajdujących się na danym terenie, występują w ilościach stosunkowo stałych i przyjęto je nazywać się normalnymi. Ich obecność nie świadczy o zanieczyszczeniu. Natomiast wzrost ich zawartości może świadczyć o zanieczyszczeniu lub dopływie zasolonych wód z innych warstw wodonośnych. Organizm ludzi wydala ok. 10 g jonów chlorkowych na dobę, przez nerki jak i przez skórę w pocie. Chlorki pochodzące z przemian metabolicznych w organizmach żywych i ze ścieków przemysłowych są ważnym wskaźnikiem zanieczyszczenia wody. Obserwuje się wtedy też wzrost związków azotowych, utlenialności i zwiększoną ilość bakterii. Dlatego oceniając chlorki w wodzie należy zwrócić uwagę na ich pochodzenie. Chlorki nie stanowią zagrożenia dla organizmu, są nawet niezbędne dla jego prawidłowej egzystencji. Jednak przy dużym stężeniu nadają wodzie nieprzyjemny smak. W dużych ilościach mogą jednak działać jednak toksycznie, a ich działanie zależy od rodzaju kationu. Dopuszczalne stężenie Cl
w wodzi do picia wynosi 250 mg/dm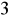
. Chlorki w dużych ilościach powodują korozję metali, dając sole rozpuszczalne w wodzie. Uniemożliwiają w ten sposób tworzenie powłoki ochronnej. Duże zasolenie wody jest szkodliwe dla roślin.
Siarczany, czyli sole kwasu siarkowego występują w wodach naturalnych od kilku do kilku tysięcy miligramów/dm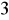
. Są anionem powszechnie występującym w wodach. Dostają się do wód wskutek wymywania skał i gleb, pokładów geologicznych, z opadów atmosferycznych, z biochemicznego utleniania innych form siarki oraz ze ściekami miejskimi i przemysłowymi. Istotnym źródłem siarczanów są również wody kopalniane. Siarczany mogą także dostawać się do wody z produktów utleniania siarki pochodzenia organicznego oraz gazów wulkanicznych. Mogą być pochodzenia mineralnego np. z soli 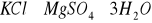
(kainit), 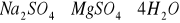
(astrachanit), 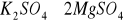
(langbainit), 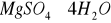
(kizeryt), czy 
(gips), 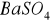
(baryt), 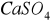
(anhydryt) a także tworzą się podczas utleniania siarczków metali ciężkich:
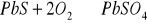
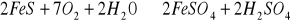
Wody powierzchniowe mogą być zanieczyszczone ściekami przemysłowymi zawierającymi siarczany z produkcji kwasu siarkowego, nawozów fosforowych, farbiarni, fabryk akumulatorów, produkcji materiałów wybuchowych, przemysłu metalowego. W wodach rzek i jezior zawartość siarczanów wynosi 10-60 g/m
, w płytkich wodach podziemnych ≥ 100 g/m
, w wodach wgłębnych do 24 kg/m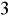
(w wodzie morskiej 2,7 kg/m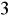
). Wody naturalne pozbawione siarczanów spotyka się rzadko, są to głownie wody charakterystyczne dla złóż ropy naftowej, w których zachodzi biochemiczna redukcja siarczanów do siarkowodoru. Obecność 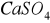
i 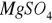
nadaje wodzie twardość nie węglanową. Wody o stężeniu siarczanów > 250 mg/dm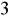
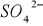
są korozyjne w stosunku do betonu i konstrukcji żelbetowych (korozja siarczanowa). Siarczany w stężeniach przeciętnie występujących w wodach nie maja znaczenia sanitarnego. Przy bardzo wysokich stężeniach mogą jednak zmienić smak wody. Ich zawartość >1000 mg/dm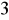
w wodzie do picia może działać przeczyszczająco. Toksyczność siarczanów zależy od rodzaju kationów. Dopuszczalna ilość siarczanów w wodzie do picia ≤ 250 mg/dm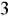
.
Obecność 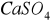
w wodach do celów przemysłowych jest niepożądana, gdyż tworzy twardy kamień kotłowy, w budownictwie powoduje korozję siarczanową betonu (tworzenie się soli Devala 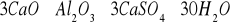
) i konstrukcji żelbetonowych.
Metody oznaczania chlorków i siarczanów.
Do oznaczania zawartości chlorków stosowane są następujące metody:
- metoda Mohra (argentometryczna) do oznaczeń w środowisku obojętnym lub słabo alkaicznym.
- metoda Volharda (argentometryczna) do oznaczeń w środowisku kwaśnym.
- miareczkowanie merkurymetryczne 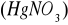
.
- metoda potencjometryczna
Siarczany można oznaczać kilkoma metodami:
- metodą wagową (metoda dokładna, ale czasochłonna)
- metodą turbidymetryczną (nefelometryczna)
- metodą jonitowo - miareczkową
Do oznaczeń siarczanów ponad 2mg 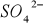
/dm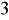
służą metody miareczkowe. Analiza powinna być wykonana w czasie ≤ 48 godzin od chwili pobrania próbki.
Zasada oznaczania chlorków metodą Mohra.
Zasada oznaczania siarczanów metodą wagową.
Zasada oznaczenia polega na straceniu siarczanów w roztworze zakwaszonym kwasem solnym, za pomocą chlorku barowego 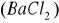
, w postaci trudno rozpuszczalnego siarczanu barowego 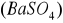
. Zgodnie z reakcją:
Po odsączeniu, wyprażeniu i zważeniu wytrąconego osadu zawartość jonów siarczanowych oblicza się z masy otrzymanego siarczanu barowego.
Do kolby stożkowej odmierzyć 100 ml badanej wody (w przypadku wyższego stężenia badaną próbkę należy rozcieńczyć woda destylowaną). Następnie dodać 1 ml roztworu chromianu potasowego 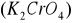
i miareczkować 0,1 M roztworem azotanu srebrowego 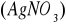
do zmiany zabarwienia na żółtobrunatną.
Następnie miareczkować w podobny sposób próbę kontrolną z wodą destylowaną przy użyciu tej samej ilości wody i chromianu potasowego.
Obliczyć zawartość chlorków w badanej wodzie uwzględniając próbę kontrolną wg wzoru:
c - miano (molowość) roztworu 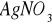
(stężenie molowe)
a - objętość 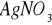
zużyta na miareczkowanie badanej próbki wody, ml
b - objętość 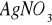
zużyta na miareczkowanie próby kontrolnej, ml
V - objętość próbki wody użytej do oznaczenia, ml
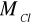
- masa molowa chloru
Miareczkowanie 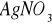
Obliczenie zawartości chlorków w badanej wodzie z uwzględnieniem próbki kontrolnej (wody destylowanej):
Odmierzyć kolbą miarową 100 ml klarownej badanej wody i przelać do kolby stożkowej. Dodać kilka kropel oranżu metylowego i kwasu solnego (HCl) do uzyskania różowego zabarwienia, następnie dodać jeszcze 3 ml kwasu solnego (jako nadmiar) i 5 ml roztworu chlorku amonowego (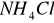
). Otrzymany roztwór doprowadzić do wrzenia na maszynce elektrycznej. Podczas wrzenia dodać kroplami 5 ml roztworu chlorku barowego (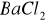
), po czym ogrzewać go na łaźni wodnej przez 30 minut.
Następnie przesączyć próbę na gorąco przez twardy, bezpopiołowy, ilościowy sączek i przemyć małymi porcjami gorącej wody destylowanej (podgrzanej na maszynce) do zaniku reakcji na jony chlorkowe (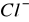
) w przesączu. Przesącz nie powinien dawać zmętnienia z roztworem azotanu srebrowego (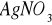
).
Sączek z osadem umieścić w porcelanowym tyglu, uprzednio wyprażonym do stałej temp. 600 - 800
C i zważonym na wadze analitycznej. Sączek wysuszyć, a następnie wyprażyć do stałej temp. 600 - 800
C. Tygiel ochłodzić w eksykatorze, a następnie zważyć na wadze analitycznej i obliczyć zawartość siarczanów w badanej wodzie.
Zawartość siarczanów obliczyć wg wzoru:
a - masa zważonego osadu, [mg]
0,4114 - współczynnik przeliczeniowy 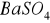
na 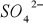
V - objętość próbki wody użytej do oznaczenia, [ml]
Obliczenie zawartości siarczanów:
Tygielek nr 7, masa: 26,65901 g
Badana próbka wody jest zdatna do picia, nie przekracza stężenia dopuszczalnego Cl
w wodzie (250 mg/dm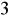
).
Badana próbka wody zawiera stężenie 213 mg/dm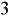
Cl
.
Woda destylowana o wiele szybciej zmieniła swoją barwę na żółtobrunatną niż próbka wody która my badaliśmy.
Masa tygielka po dokładnym zważeniu na wadze analitycznej wyniosła 26,65901 g.
Badana próbkę przemywaliśmy trzy razy porcjami gorącej wody destylowanej by uzyskać przesącz, który nie dawał zmętnienia z roztworem azotanu srebrowego.
Zawartość siarczanów a badanej próbce wody wynosi
Dopuszczalna ilość siarczanów w wodzie do picia ≤ 250 mg/dm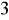
.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()