Wydział GiG Rok II IŚ gr. 3/1 |
Ćwiczenie nr 2 |
Rok akademicki |
Data wykonania ćwiczenia |
Ocena |
Imię i nazwisko Banasińska Patrycja (gr. 1) Łakomski Krzysztof Małochleb Jakub |
Bilans jonowy |
2008/2009 |
04.06.2008 |
|
Cel ćwiczenia.
Celem ćwiczenia było zbadanie próbek wody i oznaczenie zawartości następujących wartości:
chlorki metodą miareczkową Mohra
zasadowość i kwasowość
twardość
wapń
magnez
siarczany
Wstęp teoretyczny.
Zasadowość jest to zdolność wody do zobojętniania mocnych kwasów mineralnych wobec umownych wskaźników. Właściwość tę nadają wodzie obecne w niej węglany, wodorowęglany i wodorotlenki oraz występujące w mniejszych stężeniach krzemiany, borany, fosforany, amoniak, związki organiczne, sole hydrolizujące z odczynem zasadowym.
Rozróżnia się zasadowość mineralną i ogólną:
Zasadowość mineralna jest ilościowym wskaźnikiem zawartości jonów wodorotlenkowych
i węglanowych, oznaczanym przez miareczkowanie próbki mocnym kwasem do pH=8,3 wobec fenoloftaleiny lub potencjometrycznie.Zasadowość ogólna jest ilościowym wskaźnikiem zawartości jonów węglanowych, wodorowęglanowych, wodorotlenkowych i innych anionów pochodzących z dysocjacji soli słabych kwasów i mocnych zasad, oznaczanym przez miareczkowanie próbki mocnym kwasem do pH=4,5, wobec oranżu metylowego lub potencjometrycznie
Kwasowość wody to zdolność wody do zobojętniania dodawanych do niej mocnych zasad wobec umownych wskaźników.
Kwasowość wody może być wywołana obecnością: rozpuszczonego dwutlenku węgla, słabych kwasów organicznych (kwasów humusowych), soli, które ulegają w wodzie hydrolizie niektórych odczynem kwasowym (np. soli żelaza lub glinu), substancji dodawanych w procesie uzdatniania wody, a także zanieczyszczeń ściekowych.
Rozróżnia się kwasowość mineralną i ogólną:
Kwasowość mineralna jest to ilościowy wskaźnik zawartości mocnych kwasów, oznaczany przez miareczkowanie próbki mocną zasadą do pH=4,5 wobec oranżu metylowego lub potencjometrycznie.
Kwasowość ogólna jest ilościowym wskaźnikiem zawartości mocnych kwasów i soli mocnych kwasów i słabych zasad, oznaczanym przez miareczkowanie próbki mocną zasadą do pH=8,3, wobec fenoloftaleiny lub potencjometrycznie.
Opracowanie wyników i wykresy.
Oznaczenie chlorków metodą miareczkową Mohra
Do kolby stożkowej odmierzono 50cm3 wody, następnie dodano do 0,5cm3 roztworu K2CrO4
i miareczkowano roztworem mianowanym AgNO3 do zmiany barwy na ciemnożółtą.
![]()
, gdzie:
a - ilość roztworu AgNO3 zużyta na miareczkowanie[cm3],
V - objętość próbki wody [cm3],
0,15 - ilość AgNO3 zużyta na wytworzenie Ag2CrO4 w objętości 50cm3 wody destylowanej [cm3]
Otrzymane wyniki:
Woda wodociągowa: |
Woda destylowana: |
1 próbka - 0,8cm3 AgNO3
2 próbka - 0,75cm3 AgNO3
Średnio: [Cl- ]= 12,5 mgCl-/cm3 |
1 próbka - 0,55cm3 AgNO3
2 próbka - 0,6cm3 AgNO3
3 próbka - 0,5cm3 AgNO3
Średnio: [Cl-] = 8 mgCl-/dm3 |
Zasadowość i kwasowość
Zasadowość ogólna:
Do kolby odmierzono 50cm3 wody wodociągowej, dodano 4 krople roztworu oranżu metylowego i miareczkowano 0,1 molowym roztworem HCl do zmiany barwy z żółtej na czerwoną.
![]()
, gdzie:
a - ilość roztworu HCl zużyta na miareczkowanie [cm3],
V - objętość próbki wody [cm3],
0,1 - przelicznik na miniwale
Otrzymane wyniki:
1 próbka - 1,5cm3 HCl
![]()
= 3 mval/dm3
2 próbka - 1,7cm3 HCl
![]()
= 3,4 mval/dm3
Średnio: ZM = 3,2 mval/dm3 ZM = [HCO3-] = 3,2 mval/dm3
Kwasowość ogólna:
Do kolby odmierzono 50cm3 badanej wody wodociągowej, dodano 4 krople roztworu fenoloftaleiny i miareczkowano 0,1 molowym roztworem NaOH do pojawienia się lekko żółtego zabarwienia.
![]()
, gdzie:
a - ilość roztworu NaOH zużyta na miareczkowanie [cm3],
V - objętość próbki wody [cm3],
0,1 - przelicznik na miniwale
Otrzymane wyniki:
Dla obu z przeprowadzonych miareczkowań otrzymano wartość 0,3cm3 NaOH
![]()
= 0,6 mval/dm3
Twardość
Do kolby stożkowej odmierzono 50 ml badanej wody, dodano 2 ml buforu amonowego oraz szczyptę czerni eriochromowej i miareczkowano roztworem EDTA do zmiany barwy roztworu z fioletowej na niebieską.
![]()
, gdzie:
C - stężenie molowe EDTA [mol/dm3]
V - objętość EDTA zużyta do miareczkowania 100ml wody [ml]
Otrzymane wyniki:
1 próbka - 3,1ml EDTA
![]()
= 17,36°n
2 próbka - 3,2ml EDTA
![]()
= 17,92°n
Średnio Tw = 17,64°n
Twardość ogólna wynosi 17,64°n, przyjęliśmy przelicznik 1°n = 17,86mg CaCO3 mg/dm3
17,64°n · 17,8mg CaCO3mg/dm3 = 313,99 mg/dm3
Wapń
Do 50cm3 badanej wody wodociągowej dodano 3dm3 1-molowego NaOH, szczyptę mureksydu
i miareczkowano 0,02-molowym roztworem wersenianu sodu do zmiany barwy z różowego na fioletowy.
![]()
, gdzie:
a - ilość wersenianu sodu zużyta do miareczkowania próbki wody [dm3],
V - objętość próbki wody [dm3],
0,8016 - współczynnik przeliczeniowy, określa ilość wapnia odpowiadającą 1dm3 0,02 molowego roztworu wersenianu sodu
Otrzymane wyniki:
1 próbka - 5,2cm3 EDTA
![]()
= 83,37 mgCa2+/dm3
2 próbka - 5,5cm3 EDTA
![]()
= 88,18 mgCa2+/dm3
Średnio: [Ca2+] = 85,775 mgCa2+/dm3
Magnez
Wielkość zawartości magnezu można otrzymać z przekształcenia zależności na twardość ogólną:
Tw(mg CaCO3/dm3) = [Ca2+] (mg/dm3) ⋅ 2,497 + [Mg2+] (mg/dm3) ⋅ 4,116
Z tego wynika, że ![]()
![]()
= 24,25
[Mg2+] = 24,25 mgMg2+/dm3
Siarczany
Do zlewki odmierzono 100cm3 badanej wody, dodano 3 krople oranżu metylowego i zakwaszono
2 molowym roztworem HCl do pojawienia się czerwonego zabarwienia. Próbę ogrzać do wrzenia
i ciągle mieszając dodawano 5cm3 10% roztworu chlorku baru. Roztwór z wytrąconym osadem BaSO4 umieszczono na gorącej łaźni wodnej do czasu całkowitego opadnięcia osadu. Następnie osad przeniesiono na twardy sączek i przemyto na sączku gorącą wodą destylowaną. Tygiel zważono na wadze analitycznej z dokładnością ±0,0001g. Sączek z osadem umieszczono w tyglu. Następnie spalono sączek i wyprażono do stałej masy w piecu w temperaturze ok.800°C. Tygiel umieszczono w eksykatorze, a po ostudzeniu zważono na wadze analitycznej z dokładnością ±0,0001g.
Stężenie siarczanów liczymy z wzoru:
![]()
, gdzie:
a - masa zważonego osadu siarczanu baru [mg],
V - objętość wody [dm3],
0,4114 - współczynnik przeliczeniowy z BaSO4 na SO4
Otrzymane wyniki:
Masa zważonego tygla z osadem - 27,6317g
Masa pustego tygla - 27,6196g
Masa osadu - 0,0121g
![]()
= 49,78 mgSO42-/dm3
Bilans jonowy.
Wnioski.
Składniki |
Granica oznaczalności DL mg/dm3 |
mg/dm3 |
mval/dm3 |
%mval |
Mg2+ Ca2+ |
0,000014 0,0001 |
24,25 85,775 |
1,21 4,28 |
22 78 |
Suma kationów |
165,03 |
5,49 |
100 |
|
Cl- SO42- HCO3- |
0,5 0,5 0,5 |
12,5 49,78 64,13 |
0,62 2,48 3,2 |
10 39 51 |
Suma anionów |
112,1 |
6,3 |
100 |
|
Ocena jakości analizy na podstawie bilansu jonowego:
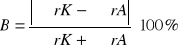
, gdzie:
B - wielkość błędu [%],
![]()
-suma zawartości kationów [mval/ dm3],
![]()
-suma zawartości anionów [mval/ dm3]
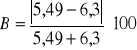
= 6,8%
Celem ćwiczenia było zbadanie próbek wody wodociągowej, oznaczenie zawartości jonów chlorkowych, siarczanowych, magnezowych, wapniowych oraz określenie zasadowości
i kwasowości ogólnej.
Otrzymano następujące wartości:
Składnik |
Stężenie średnie |
Chlorki |
12,5 mgCl-/dm3 |
Zasadowość |
3,2 mval/dm3 |
Kwasowość |
0,6 mval/dm3 |
Twardość |
17,64 °n |
Wapń |
85,775 mgCa2+/dm3 |
Magnez |
24,25 mgMg2+/dm3 |
Siarczany |
49,78 mgSO42-/dm3 |
Po oznaczeniu tych wartości można było dokonać jakości analizy na podstawie bilansu jonowego. Nie miał on jednak pełnej postaci z powodu braku danych na temat zawartości kationów potasu, sodu i żelaza oraz anionów wodorowęglanowych i azotanowych. Z tego powodu otrzymany wynik błędu jest wysoki (6,8%), ponieważ nie dysponowano pełnym zestawem danych, które miałyby wpływ na wielkość błędu.
1
Wyszukiwarka
Podobne podstrony:
Metody Oznaczania Związków Nieorganicznych 3, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓ
Bilans jonowy, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I Ś
1 - Oznaczanie podstawowych parametrów wody i ścieków, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY
Warunki zaliczenia, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Technologie oczyszczania wody i ścieków - Tematy referatów, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA
Wzór sprawozdania, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW
Neutralizacja, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 5
3 - Bilans jonowy wody, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I ŚCIEKÓW, Ćwiczenie 3
5 - Chemiczne oczyszczenie ścieków – neutralizacja, AGH, SEMESTR 3, TECHNOLOGIE OCZYSZCZANIA WODY I
pytania z wejsciówek, Inżynieria środowiska ZUT, Technologia oczyszczania wody i ścieków
Sprawozdanie piotrek, Inżynieria środowiska ZUT, Technologia oczyszczania wody i ścieków
sprawko analiza wody, Inżynieria środowiska ZUT, Technologia oczyszczania wody i ścieków
2006 06 08 Techn frezowania - zadanie, AGH, Semestr 8, Technologia wybranych elementów maszyn, cnc
toś zerowka 2012 (58 pytań), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wyk
Ścieki, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
pytania Technologia oczyszczania wody II DZIENNE -, Studia - IŚ - materiały, Semestr 09 (2) (magiste
toś zerowka 2012 (58 pytań z odp), Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ściekó
TOSegzamin, Inżynieria Środowiska, 5 semestr, Technologie oczyszczania ścieków, wykłady, egzamin
więcej podobnych podstron