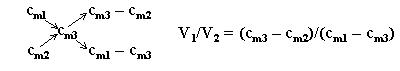
6. STĘŻENIA MOLOWE
stężenie molowe (molowość) - określa liczbę moli danej substancji o masie molowej M znajdującej się w 1 dm3 roztworu, np.: roztwór NaOH o stężeniu 1 mol/dm3 zawiera 40 g NaOH w 1 dm3 roztworu.
. cm = n/Vr = ms/M.Vr = ms. dr/M.mr...
gdzie: n - ilość moli substancji zawartej w roztworze o objętości -Vr i gęstości - dr
stężenie normalne (normalność) określa liczbę gramorównoważników (vali) substancji zawartej w 1 dm3 roztworu, np.: roztwór 1 normalny H2SO4 zawiera 98,08g : 2 = 49,04 g H2SO4 w 1 dm3 roztworu.
.cn = nv /Vr. gdzie: nv - ilość vali substancji zawartej w roztworze o objętości Vr
wartość 1 vala zależy od rodzaju substancji i od reakcji, w której ona uczestniczy
reakcje zobojętniania i wymiany:
kwasy HnA 1 val = 1 mol / n np.: 1 val H3PO4 = 1 mol H3PO4 / 3
zasady Me(OH)m 1 val = 1 mol / m np.: 1 val Ca(OH)2 = 1 mol Ca(OH)2 / 2
kationy Mem+ 1 val = 1 mol / m np.: 1 val Al3+ = 1 mol Al3+ / 3
aniony An- 1 val = 1 mol / n np.: 1 val SO42- = 1 mol SO42- / 2
reakcje redox: 2MnO4- + 5SO32- + 6H+ 2Mn2+ + 5SO42- + 3H2O
+7 +4 +2 +6
utleniacz X X 1 val = 1 mol / (m-n) np.: 1 val MnO4- = 1 mol MnO4- / 5
m n m >n +7
reduktor Y Y 1 val = 1 mol / (n-m) np.: 1 val SO32- = 1 mol SO32- / 2
m n n>m +4
stężenie molarne (molarność) określa liczbę moli substancji rozpuszczonej w 1 kg rozpuszczalnika. .cmolar = n /mr gdzie: mr - masa rozpuszczalnika
ułamek molowy oznacza względną zawartość substancji rozpuszczonej w roztworze zawierającym ns moli tej substancji i nr moli rozpuszczalnika. Ułamki molowe substancji rozpuszczonej i rozpuszczalnika są równe:
.xs = ns /(ns + nr), xr = nr /(ns + nr).
Suma ułamków molowych w roztworze zawsze równa się jedności.
xs + xr = 1
reguła mieszania: V1 . cm1 + V2 . cm2 = (V1 + V2) . cm3.. gdzie:
V1 i V2 to objętości mieszanych roztworów o stężeniach odpowiednio cm1 i cm2,
cm3 to stężenie roztworu uzyskanego ze zmieszania roztworów wyjściowych.
metoda „krzyża”:
Zad.1.
Oblicz stężenie molowe roztworu H2SO4 jeśli wiadomo, że w 500 cm3 tego roztworu znajduje się 4.9 g kwasu siarkowego(VI). Oblicz stężenie normalne tego roztworu.
Zad.2.
Ile gramów NaOH znajduje się w 300 cm3 0,1 molowego roztworu?
Dane: cm = 0.1 mol/dm3, Vr = 0.3 dm3, MNaOH = 40 g/mol, ms = ? . cm = n/Vr = ms/M.Vr .
Rozwiązanie: Obliczamy masę molową MNaOH , wynosi ona 40 g/mol. W celu obliczenia masy ms wzór na cm przekształcamy i otrzymujemy postać, która pozwala nam na obliczenie masy NaOH.
ms = cm . MNaOH . Vr stąd wstawiając do wzoru dane otrzymamy:
ms = 0.1 mol/dm3 . 40 g/mol . 0,3 dm3 = 1.2 g NaOH
Odp.: W 300 dm3 0,1 molowego roztworu NaOH znajduje się 1,2 g NaOH
Zad.3.
Ile gramów siarczanu(VI) żelaza(III) znajduje się w 200g 0.1 molowego roztworu tej soli, zakładając, że gęstość roztworu dr = 1.083 g/ml ?
Zad.4.
Oblicz stężenie procentowe 12,5 molowego roztworu KOH, którego gęstość wynosi dr = 1.48 g/cm3
Dane: cm = 12.5 mol/dm3, dr = 1.48 g/cm3 = 1480 g/dm3, cp = ?
. cp = cm . M . 100% /dr ..
Rozwiązanie: Masa molowa MKOH = 56,11 g/mol. W/w wzór uzyskujemy z przekształcenia wzoru: cm = ms. dr/M.mr.wyznaczając z niego wielkość: ms. 100%/mr równoważną cp. Podstawiamy dane do tak otrzymanego wzoru na cp i obliczamy wynik:
cp = 12.5 mol/dm3 .56.11 g/mol .100% / 1480 g/dm3 = 47.5 %.
Odp.: 12,5 molowy roztwór KOH jest 47,4%
Zad.5.
Oblicz stężenie molowe 20% roztworu HCl, wiedząc, że 1 kg tego roztworu zajmuje objętość 1108 cm3.
Zad.6.
Ile ml 0.5 molowego roztworu NaOH należy zmieszać z 50 ml 2 molowego roztworu NaOH aby otrzymać roztwór 1 molowy?
Rozwiązanie (1): stosujemy regułę mieszania: V1 . cm1 + V2 . cm2 = (V1 + V2) . cm3..
50 ml . 2 mole/dm3 + V2 . 0.5 mol/dm3 = (V2 + 50 ml) . 1 mol/dm3
V2 = 100 ml.
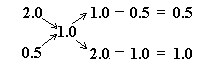
Rozwiązanie (2): stosujemy metodę „krzyża”:
V1/V2 = 50 ml/V2 = 0.5/1.0 = 0.5
V2 = 100 ml
Zad.7.
Jaką objętością wody należy rozcieńczyć 0.4 dm3 roztworu NaCl o stężeniu 0.25 mola/dm3, aby uzyskać 0.1 molowy roztwór tej soli?
Rozwiązanie:
Stosując regułę mieszania przyjmujemy, że woda to „roztwór 2” o stężeniu cm2 = 0 moli/dm3 i objętości V2 .
0.4 dm3 . 0.25 mola/dm3 + V2 . 0 mola/dm3 = (V2 + 0.4 dm3) . 0.1 mola/dm3