Szersze opracowanie: H. Dodziuk, Tetrahedron, 52 (40), 12941, 1996.
Robert B. Grossman „The Art of Writing Reasonable Organic Reaction Mechanism” Springer-Verlag, New York, 1999.
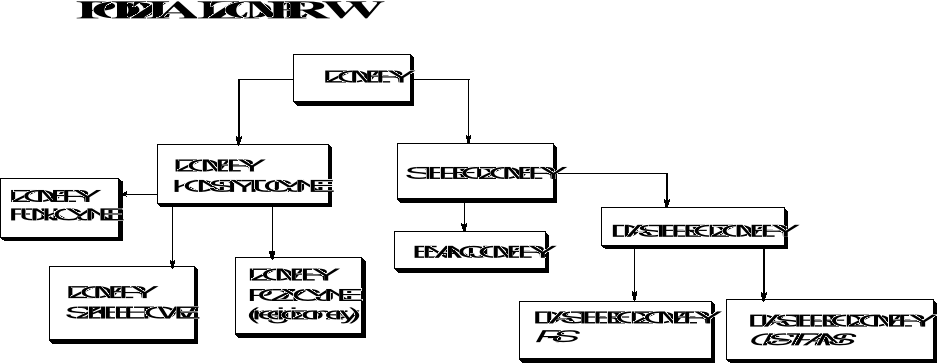
PODSTAWOWE POJĘCIA:
Izomery konstytucyjne - związki chemiczne o takim samym wzorze sumarycznym, lecz różniące się połączeniami między atomami np. alkohol etylowy i eter dimetylowy, butan i izobutan
Stereoizomery - związki chemiczne, w których atomy połączone są w tych samych sekwencjach tylko w innym ułożeniu przestrzennym.
Enancjomery - stereoizomery będące odbiciami lustrzanymi. Nie dają się nałożyć jeden na drugi
Diastereoizomery - stereoizomery nie będące odbiciami lustrzanymi.
Konstytucja - sekwencja, w jakiej połączone są atomy w cząsteczce.
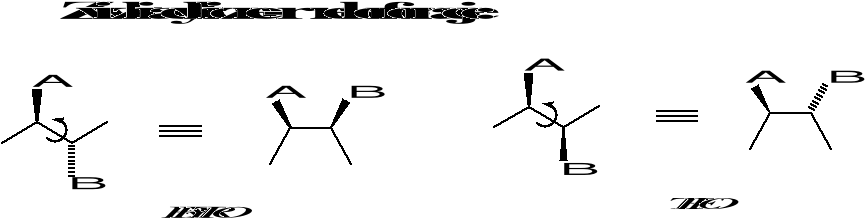
Konformacja - różne rozmieszczenie atomów w przestrzeni wynikające z rotacji wokół wiązania pojedynczego.
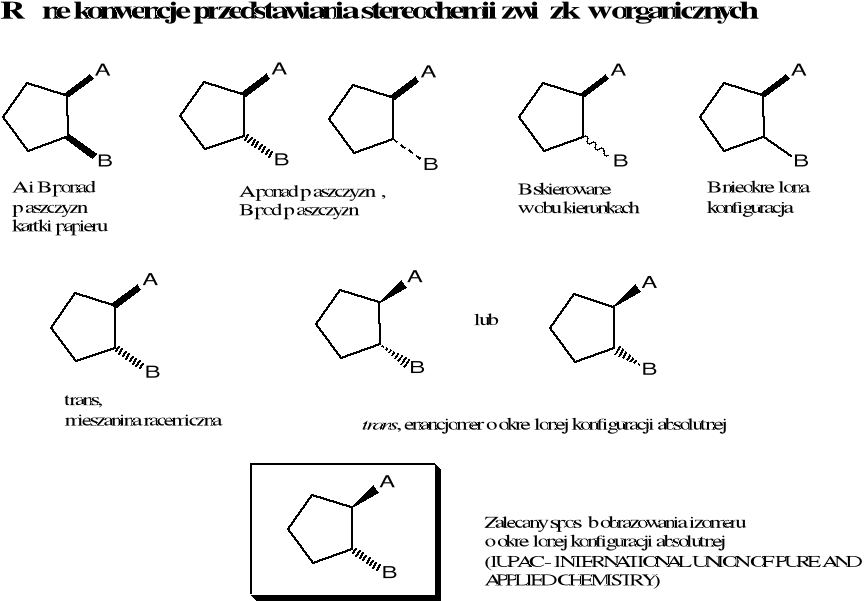
Konfiguracja - różne rozmieszczenie atomów w przestrzeni nie wynikające z rotacji wokół wiązania pojedynczego przy zachowaniu takiej samej sekwencji połączenia atomów
np. E-but-2-en i Z-but-2-en różnią się konfiguracją. R-butan-2-ol i S-butan-2-ol różnią się konfiguracją absolutną.
Chiralność - właściwość przedmiotu polegająca na tym, że jest on nieidentyczny ze swym odbiciem lustrzanym. Cząsteczka o określonej konfiguracji i konformacji jest chiralna, gdy nie pokrywa się ze swoim odbiciem lustrzanym, zaś achiralna, gdy z nim się pokrywa.
Asymetria - oznacza brak elementów symetrii. Obiekt (np. cząsteczka o określonej konfiguracji lub konformacji jest asymetryczny, gdy nie ma elementów symetrii.
Każda cząsteczka asymetryczna jest chiralna a substancja składająca się z takich cząsteczek jest optycznie czynna. Jednak nie wszystkie cząsteczki chiralne są asymetryczne.
Węgiel asymetryczny - węgiel związany z czterema różnymi podstawnikami.
Cząsteczka zawierająca węgiel asymetryczny nie musi być chiralna np.: związki mezo
Cząsteczka może być chiralna nie mając węgli asymetrycznych np.: odpowiednio podstawione alleny.
Nadmiar enancjomeryczny (ang. enantiomeric excess) - ee%:

Czystość optyczna:
Co wpływa na reaktywność związków chemicznych i łatwość wchodzenia ich w dane przemiany chemiczne?
Czynniki wewnętrzne
Energia wiązań
Efekt rezonansu
Efekt indukcyjny
Polarność cząsteczki
Polaryzowalność
Efekty steryczne
Czynniki zewnętrzne
a. Temperatura
b. Światło
c. Ciśnienie
d. Promieniowanie mikrofalowe
e. Kataliza kwasowo-zasadowa
f. Rozpuszczalniki
Energia rozpadu homolitycznego R―R R* + *R
Tabela 1 (Energia wiązań dla prostych układów dwuatomowych)
Energia niektórych wiązań (kcal/mol) |
|||||
H―H |
103 |
C―H |
98 |
C=C |
145 |
C―C |
81 |
N―H |
92 |
C |
198 |
O―O |
34 |
O―H |
109 |
N |
225 |
Cl―Cl |
57 |
Cl―H |
102 |
C=O |
173 |
Br―Br |
45 |
Br―H |
87 |
C―O |
79 |
I―I |
36 |
I―H |
71 |
C―N |
66 |
Talela 2 (Energia rozpadu homolitycznego wyszczególnionych wiązań)
Energia dysocjacji wiązań (kcal/mol) |
|||||
H3C―H |
104 |
CH3―CH3 |
88 |
H3C―F |
108 |
CH3CH2―H |
98 |
C2H5―CH3 |
85 |
H3C―Cl |
84 |
H2C=CH―H |
104 |
(CH3)2CH―CH3 |
83 |
H3C―Br |
70 |
H2C=CHCH2―H |
85 |
PhCH2―CH3 |
70 |
H3C―I |
56 |
PhCH2―H |
85 |
H5C2―C2H5 |
82 |
H3C―OH |
91 |
H2NH―H |
92 |
H2C=CH2 |
163 |
|
|
CH3O―H |
102 |
HC |
230 |
|
|
Tabela 3 (Energia rozpadu heterolitycznego w fazie gazowej)
R |
R―H R+ + H ― |
R―Cl R+ + Cl ― |
|
EC―H (kcal/mol) |
EC―Cl (kcal/mol) |
CH3 |
312.2 |
227.1 |
CH3CH2 |
272.6 |
190.3 |
(CH3)2CH |
249.9 |
171.0 |
CH2=CH |
290.2 |
|
CH2=CHCH2 |
255.3 |
|
Dane zaczerpnięte z książki F. R. Carey, R. J. Sundberg „Advanced Organic Chemistry Part A: Structure and Mechanisms”, 1990, Plenum Press, New York.
Teorie kwasów i zasad
Teoria Arrheniusa - do przypomnienia.
Teoria Bronsteda - do przypomnienia.
Teoria Lewisa - do przypomnienia.
Teoria kwasów (zasad) miękkich i twardych - teoria Pearsona (rok 1963)
Twarde kwasy
- akceptory pary elektronowej o małym promieniu jonowym, dużym ładunku dodatnim. Cząsteczki w których podstawniki indukują na centrum kwasowym duży ładunek dodatni (podstawniki silnie elektroakceptorowe)
Twarde zasady
- donory pary elektronowej. Atom udostępniający parę elektronową charakteryzuje się niewielkim promieniem jonowym i silną elektroujemnością, a więc jego elektrony są silnie z nim związane.
Miękkie kwasy
- akceptory pary elektronowej o małym ładunku dodatnim i dużym promieniu jonowym, posiadające elektrony na orbitalach d i f.
Miękkie zasady
- donory pary elektronowej. Atom będący donorem charakteryzuje się dużym rozmiarem, niewielką elektroujemnością.
Zasady |
||
Twarde |
Pośrednie |
Miękkie |
H2O, OH , F , AcO , |
ArNH2, C5H5N, N3 , |
R2S, RSH, RS , I , |
Kwasy |
||
Twarde |
Pośrednie |
Miękkie |
H , Li , Na , K , |
Fe 2, Co 2, Cu 2, Zn 2, |
Ag , Cu , Pd 2, Pt 2,
Hg 2, BH3, GaCl3, I2, Br2, :CH2 (karben), |
Wyszukiwarka
Podobne podstrony:
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech404b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech406b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech404a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech403a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech409, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech402, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech406, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech401a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech406a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech409b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech408a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech402a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech403, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech404, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd tech408, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron