Wstęp:
Równowaga chemiczna reakcji zachodzącej w roztworze jest wrażliwa na zmianę rozpuszczalnika. Wpływ rozpuszczalnika na równowagę chemiczną pokazano na rysunku.
Jak widać wpływ rozpuszczalnika na stałą równowagi reakcji Ksolv, wynika z różnic solwatacji substratów i produktów reakcji. Dla dowolnego rozpuszczalnika stała równowagi reakcji zależy od różnicy swobodnych entalpii Gibbsa produktu GB i substratu GA:
(Go)solv=(GA)solv - (GA)solv = -RTln(K)solv
stąd stosunek stałych równowagi reakcji w dwóch rozpuszczalnikach dany jest zależnością :
RTln(K2/K1)= -Go2 + -Go1= Gotrans(B,1→2) - Gotrans(A,1→2)
W której Gotrans(B,1→2) oraz Gotrans(A,1→2) są swobodnym entalpiami Gibbsa przeniesienia produktów i substratów z rozpuszczalnika 1 do 2. Wartości Gotrans określają różnicę solwatcji reagenta w obu rozpuszczalnikach.
2. Wykonane ćwiczenia:
Przygotowałem dwa roztwory rozpuszczalników o stosunku objętościowym 1:4 i 1:8.
W kolbkach miarowych o pojemności 25 cm3 przygotowałem dwie serie roztworów kwasu octowego w obu rozpuszczalnikach. Stężenia podane są w tabeli 1.
Po termostatowaniu przez 15 min, wykonałem pomiary przewodnictwa Gc dla każdego z roztworów. Wyniki umieściłem w tabeli 1.
3. Obliczenia:
- Obliczanie przewodnictwa molowego dla każdego ze stężeń, np.:
![]()
[S]
- Obliczenie przewodnictwa granicznego kwasu octowego w rozpuszczalnikach:
= 0,88307+5,8377.Xm - 15,9185.Xm2 + 14,318.Xm3 + 4,573.Xm4
Dla rozpuszczalnika o stosunku objętościowym MeOH:H2O 1:4 ułamek molowy wynosi:
20 cm3 MeOH + 80 cm3 H2O
ρ MeOH = 0,793 g/cm3; MMeOH= 34 g/mol
nMeOH = 20.0,793 / 34 = 0,4956 mol
nH2O = 80.1/18 = 4,4444 mol
XMeOH = 0,4956 / (4,4444+0,4956) = 0,1
Dla rozpuszczalnika o stosunku objętościowym MeOH:H2O 1:8 ułamek molowy wynosi:
XMeOH = 0,0528
Lepkości dla odpowiednich roztworów wynoszą:
1:4 =1,3225 cP
1:8 =1,1490 cP
Korzystając z zależności Waldena, otrzymałem graniczne przewodnictwa dla obydwu roztworów:
1:4 = ()wody . wody / 1:4 = 263,81 [S]
1:8 = ()wody . wody / 1:8 = 303,64 [S]
- Obliczam stopień dysocjacji kwasu octowego dla każdego ze stężeń:
sol = (c)sol / ()sol = 24,303/263,81 = 0,0921
- Obliczam stałą dysocjacji Ksol dla każdego stężenia:
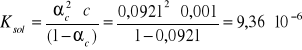
Wszystkie pozostałe wyniki obliczeń są zamieszczone w tabeli 1.
Tabela 1:
Rozpuszczalnik |
Stężenie CH3COOH [mol/dm3] |
Gc[S] |
(c)sol [Scm2/mol] |
sol |
|
1:4 |
0,0010 |
0,0000496 |
24,3040 |
0,0921 |
0,00000935 |
|
0,0025 |
0,0000769 |
15,0724 |
0,0571 |
0,00000866 |
|
0,0050 |
0,0001150 |
11,2700 |
0,0427 |
0,00000953 |
|
0,0075 |
0,0001480 |
9,6693 |
0,0367 |
0,00001046 |
|
0,0100 |
0,0001720 |
8,4280 |
0,0319 |
0,00001054 |
1:8 |
0,0010 |
0,0000637 |
31,2130 |
0,1183 |
0,00001588 |
|
0,0025 |
0,0001053 |
20,6388 |
0,0782 |
0,00001660 |
|
0,0050 |
0,0001580 |
15,4840 |
0,0587 |
0,00001830 |
|
0,0075 |
0,0001990 |
13,0013 |
0,0493 |
0,00001916 |
|
0,0100 |
0,0002310 |
11,3190 |
0,0429 |
0,00001923 |
Sumaryczne stałe dysocjacji kwasu octowego dla roztworów 1:4 i 1:8 wynoszą:
K1:4 = 0,000009708 = 9,7*10-6
K1:8 = 0,000017834 = 1,78*10-5
Dla wody natomiast:
Kwoda = 1,754 10-5
Ułamki molowe wody w roztworach MeOH:H2O wynoszą odpowiednio:
dla 1:4 XH2O = 0,9
dla 1:8 XH2O = 0,9472
Po odczytaniu z wykresu =f(XH2O) stałych dielektrycznych mam:
dla 1:4 = 79,02
dla 1:8 = 79,55
dla czystej wody 80,08
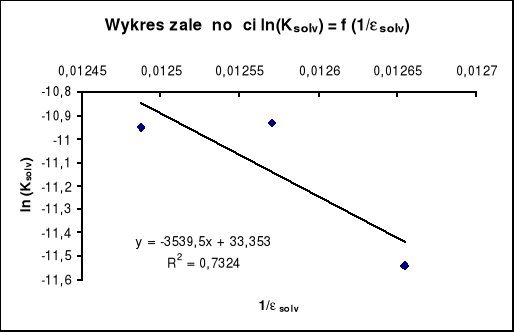
Wnioski:
Wykres zależności ln(K)solv = f(1/solv) odbiega od wartości rzeczywistych ponieważ stała dysocjacji dla roztworów MeOH wyznaczona przeze mnie ma wartość większą od stałej dysocjacji dla czystej wody.
Widać jednak iż ze wzrostem stężenia metanolu w roztworze stała dysocjacji maleje.
Wynika to z faktu hamowania dysocjacji w roztworze metanol woda.