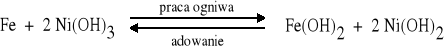Klucz elektrolityczny |
przewodnik jonowy łączący elektrolity i umożliwiający przepływ prądu. [ | - granice faz; || - klucz elektrolityczny] |
Katoda |
|
Anoda |
|
|
|
Potencjał półogniwa |
|
SEM |
|
Wzór Nernsta |
|
Półogniwa I rodzaju |
|
|
|
||
1. Półogniwo cynkowe |
Zn / Zn2+ |
Zn = Zn2+ + 2 e |
2. Półogniwo miedziowe |
Cu / Cu2+ |
Cu = Cu2+ + 2 e |
3. Półogniwo wodorowe |
Pt, H2 (g) / H+ aq |
H2 = 2 H+ + 2 e |
|
Zbudowane z platynowej płytki pokrytej rozdrobnioną platyną czyli tzw. czernią platynową; zanurzoną w 1 M kwasie solnym i opłukiwana gazowym wodorem, wprowadzonym do układu pod ciśnieniem 1013 hPa. |
|
4. Półogniwo chlorowe |
Pt, Cl2 / Cl- |
Cl2 + 2 e = 2 Cl- |
Półogniwa II rodzaju |
|
|||
|
||||
1. Półogniwo chlorosrebrowe |
Ag, AgCl / Cl- |
Ag + Cl- = AgCl + e |
||
2. Półogniwo kalomelowe |
Hg, Hg2Cl2 / Cl- |
2 Hg + 2 Cl- = Hg2Cl2 + 2 e |
||
|
|
|||
Półogniwa III rodzaju (tzw. redox) |
|
|||
|
||||
1. Półogniwo |
Pt / Fe3+ , Fe2+ |
Fe3+ + e = Fe2+ |
||
2. Półogniwo |
Pt / MnO4-, Mn2+, H+ |
MnO4- + 8 H+ + 5 e = Mn2+ + H2O |
||
|
|
|
||
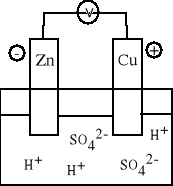
Ogniwo Volty A (-) Zn | roztwór H2SO4 | Cu (+) K Anoda: Zn = Zn2+ + 2e Katoda: 2 H+ + 2e = H2 Zn + H2SO4 = ZnSO4 + H2 Zn + 2 H+ = Zn2+ + H2 |
|
Ogniwo to składa się z zanurzonych w roztworze kwasu siarkowego (VI) płytek cynkowej i miedzianej połączonych metalicznym przewodnikiem. Na powierzchni obu zanurzonych w cieczy płytek wydziela się wodór. Do roztworu przechodzą kationy cynku, elektrony zaś przewodnikiem płyną ku płytce miedzianej, na której powierzchni zachodzi redukcja kationów wodorowych. Jest ogniwem nieodwracalnym. W ogniwie zachodzą procesy niezależnie czy układ jest zamknięty czy otwarty. |
|
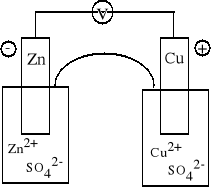
Ogniwo Daniella A (-) Zn | Zn2+ || Cu2+ | Cu (+) K
Anoda: Zn = Zn2+ + 2e Katoda:
Cu2+ + 2e = Cu Zn + Cu2+ = Cu + Zn2+ |
|
Ogniwo odwracalne. Przed zamknięciem obwodu nie zachodzi żadna reakcja chemiczna, ustala się jedynie równowaga dynamiczna w półogniwach tworzących ogniwo.
|
|
Ogniwo wodorowo - cynkowe A (-) Zn | Zn2+ || H+ | H2, Pt (+) K |
Ogniwo wodorowo - miedziowe A (-) Pt, H2 | H+ || Cu2+ | Cu (+) K |
|
Anoda: Zn = Zn2+ + 2 e Katoda: 2 H+ + 2 e = H2 Ogólnie: Zn + 2 H+ + 2 e = Zn2+ + H2 + 2 e |
Anoda: H2 = 2 H+ + 2 e Katoda: Cu2+ + 2 e = Cu Ogólnie: Cu2+ + H2 + 2 e = Cu + 2 H+ + 2 e |
|
Ogniwo ołowiowo - miedziowe A (-) Pb | Pb2+ || Cu2+ | Cu (+) K |
||
Anoda: Pb = Pb2+ + 2 e |
Katoda: Cu2+ + 2 e = Cu |
|
Ogólnie: Pb + Cu2+ + 2 e = Cu + Pb2+ + 2 e |
||
Ogniwo Leclanchego A (-) Zn | roztwór ZnCl2 ,NH4Cl | MnO2, C (grafit) (+) K |
|
Elektroda ujemna ogniwa ma najczęściej postać cynkowego kubeczka napełnionego pastą z chlorku amonowego, w którym osadzono pałeczkę węglową - elektrodę dodatnią otoczoną woreczkiem zawierającym stały dwutlenek manganu. Jest ogniwem nieodwracalnym. W ogniwie zachodzą procesy niezależnie czy układ jest zamknięty czy otwarty. Stosowane do zasilania przenośnych urządzeń elektrycznych i elektronicznych: latarek; aparatów słuchowych, kalkulatorów. |
|
Anoda: Zn = Zn2+ + 2 e |
Katoda: Mn+IV + 2 e = Mn+II |
Ogólnie: Zn + 2 NH4Cl + 2 MnO2 = [Zn(NH3)2]Cl2 + Mn2O3 + H2O |
|
Akumulator ołowiowy (kwasowy) A (-) Pb | roztwór H2SO4 | PbO2, Pb (+) K |
|
Elektrodami są płyty ołowiowe pokryte gąbczastym ołowiem stanowiące anodę oraz płyty ołowiane pokryte warstwą tlenku ołowiu (IV), będące katodą. Płyty te zanurzone są w roztworze kwasu siarkowego (VI) - 37%. |
|
Anoda: Pb + SO42- = PbSO4 + 2e |
Katoda: PbO2 + 4 H+ + SO42- + 2e = PbSO4 + 2 H2O |
Rozładowanie akumulatora (proces samorzutny zachodzący podczas pracy akumulatora) Pb + 2 SO42- + PbO2 + 4 H+ = 2 PbSO4 + 2 H2O Ładowanie akumulatora (regeneracja akumulatora - proces wymuszony przez zewnętrzne źródło prądu) 2 PbSO4 + 2 H2O = Pb + 2 SO42- + PbO2 + 4 H+ Ogólnie:
|
|
Akumulator Edisona (alkaliczny) A (-) Fe, Fe(OH)2 | roztwór KOH | Ni(OH)2, Ni(OH)3, Ni (+) K
|
|
Anodę stanowi żelazo, katodę mieszanina niklu i jego stałych związków. Elektrolitem jest 20% wodny roztwór wodorotlenku potasu. |
|
Anoda: Fe + 2 OH- = Fe(OH)2 + 2e |
Katoda: 2 Ni(OH)3 + 2e = 2 Ni(OH)2 + 2 OH- |
Ogólnie:
|
|
Szereg Napięciowy metali
|
|
Półogniwo |
E0[V] |
|
-3,01 |
|
-2,92 |
|
-2,92 |
|
-2,89 |
|
-2,84 |
|
-2,71 |
|
-2,38 |
|
-1,70 |
|
-1,66 |
|
-1,05 |
|
-0,76 |
|
-0,71 |
|
-0,44 |
|
-0,44 |
|
-0,28 |
|
-0,22 |
|
-0,14 |
|
-0,13 |
|
-0,04 |
|
0,00 |
|
+0,20 |
|
+0,20 |
|
+0,30 |
|
+0,34 |
|
+0,80 |
|
+0,87 |
|
+1,20 |
|
+1,42 |
Wyszukiwarka
Podobne podstrony:
6870
6870
praca-magisterska-6870, Dokumenty(1)
07 Historia III wer 3[1]id 6870
6870
więcej podobnych podstron