POJĘCIA PODSTAWOWE.
Substancje chemiczne rozpoznaje się po ich właściwościach takich jak:
stan skupienia
temp. topnienia
temp. wrzenia
gęstość
rozpuszczalność
zdolność przewodzenia ciepła i prądu elektrycznego
zapach
barwa
smak
połysk
twardość
Reakcja chemiczna - przemiana, w czasie której z jednej substancji powstaje nowa o odmiennych właściwościach.
Substraty i produkty to reagenty.
Masa substratów równa jest masie produktów reakcji. Jest to prawo zachowania masy - Łomonosowa lub Lavoisiera.
Prawo stałości związku chemicznego (Proust) - stosunek mas pierwiastków w każdym związku chemicznym jest stały i charakterystyczny dla danego związku.
W mieszaninie poszczególne składniki można dowolnie dobrać, natomiast w przypadku związku chemicznego ilość poszczególnych składników musi być ściśle określona.
Rodzaje reakcji chemicznych:
reakcje rozkładu (analizy) - są to reakcje, w których z jednego substratu powstają dwa lub więcej produktów AB = A + B
reakcje rozkładu (syntezy) - są to reakcje, w których z dwóch lub więcej substratów powstaje jeden produkt A + B = AB
reakcje wymiany - są to reakcje w wyniku których następuje wymiana składników między substratami
AB + C = AC + B LUB AB + CD. = AC + BD
Reakcje egzoenergetyczne są to reakcje, którym towarzyszy przekazywanie energii z układu do otoczenia na sposób ciepła i na sposób pracy.
Reakcje endoenergetyczne są to reakcje, w których substancje pochłaniają energię z otoczenia.
Reakcja egzotermiczna - powstają produkty o mniejszej energii wewnętrznej niż energia substratów:
C + O2 = CO2 + 394kJ * mol -1
Reakcja endotermiczna - energia jest pobierana z otoczenia
Ag2O + 30kJ = 2Ag2 + ½ O2
Atom jest to najmniejsza część pierwiastka chemicznego zachowująca jeszcze jego charakterystyczne własności.
Postulaty Daltona:
Każdy pierwiastek chemiczny jest zbiorem małych cząstek zwanymi atomami. Wszystkie atomy danego pierwiastka mają identyczne właściwości chemiczne. Izotopy są to odmiany danego pierwiastka.
Atomy różnych pierwiastków różnią się od siebie cechami chemicznymi i fizycznymi. Istnieje tyle rodzajów atomów o określonych właściwościach chemicznych, ile jest pierwiastków.
Atom danego pierwiastka nie może ulec przekształceniu w atom innego pierwiastka podczas reakcji chemicznej (oprócz reakcji jądrowych).
Łączenie się pierwiastków w związki chemiczne polega na łączeniu się atomów różnych pierwiastków w większe zespoły, zwane cząsteczkami.
Związek chemiczny jest zbiorem cząsteczek. Wszystkie cząsteczki danego związku chemicznego zawierają tę samą liczbę tych samych rodzajów atomów i mają identyczne właściwości chemiczne.
Rozłożenie związku chemicznego na pierwiastki polega na rozpadzie cząsteczek na atomy. Proces ten może przebiegać w kilku etapach.
Atomy tego samego pierwiastka mogą łączyć się w cząsteczki.
Reakcje homogeniczne - są to reakcje, w których wszystkie substraty i produkty znajdują się w tej samej fazie.
Reakcje heterogeniczne - substraty i produkty znajdują się w różnych fazach.
Reakcje jonowe - Ag+ + Cl - = AgCl
Redoks - reakcja utleniania, redukcji, polega na jednoczesnym utlenieniu jednej substancji (reduktora) i redukcji drugiej (utleniacza). Rozróżniamy również reakcje oksred. - str. 241
Reakcje cząsteczkowe - jonowe i rodnikowe. - str. 229
Szybkość reakcji określamy jako ubytek molekuł substratów albo przyrost ilości molekuł produktów w jednostce czasu.
Aby zdarzenia były efektywne molekuły muszą mieć pewną energię, charakterystyczną dla danej reakcji zwaną energią aktywacji.
Cechą katalizatorów (inhibitorów) jest to, że nie są one reagentami lecz substancjami, które obniżają energię aktywacji i zwiększają szybkość reakcji.
Czynniki wpływające na szybkość reakcji:
podwyższenie temperatury reagentów,
rozdrobnienie reagentów,
stężenie reagentów,
katalizatory,
Jednostka masy atomowej (u) jest to 1/12 masy atomu węgla, a ściślej atomu jednego z izotopów węgla - węgla -12.
Masa atomowa i cząsteczkowa substancji wyrażana jest w jednostkach masy atomowej u, które stanowią 0,166 * 10-23 g.
Próbka każdego pierwiastka, której masa w gramach jest liczbowo równa masie atomowej zawiera 6,02 * 10_23 atomów.
Liczba Avogadra - Na = 6,02 * 10 - 23 mol -1
Masa molowa M. jest to ilość gramów substancji liczbowo równa jest masie atomowej lub cząsteczkowej,
1 g = Na * u
Masy atomów wyrażone w jednostkach masy atomowej noszą nazwę mas atomowych, a masy wyrażone w gramach są nazywane bezwzględnymi masami atomów.
Masa cząsteczkowa - suma mas atomowych atomów tworzących cząsteczkę.
Postulaty teorii strukturalnej:
Atomy tworzące cząsteczkę są połączone wiązaniami chemicznymi. Wiązanie chemiczne jest to pewien sposób wzajemnego oddziaływania atomów tworzących cząsteczkę.
Liczba wiązań chemicznych, które tworzy atom, jest cechą charakterystyczną pierwiastka i jego podstawową właściwością chemiczną,
Pierwiastki mogą zmieniać wartościowość(liczbę wiązań) w zależności od pierwiastka, z którym tworzą związek chemiczny, lub w zależności od warunków przeprowadzenia reakcji,
Mogą istnieć związki o identycznych wzorach sumarycznych, lecz różnych wzorach strukturalnych,
Zjawisko polegające na tym, że związki mają ten sam wzór sumaryczny, ale różną budowę strukturalną, jest nazywane izomerią. Izomeria występuje często wśród związków węgla. Zjawisko izomerii wskazuje, że właściwości chemiczne i fizyczne związku są funkcją nie tylko liczby i rodzaju atomów tworzących cząsteczkę, lecz także wewnętrznej struktury cząsteczki.
Atomy składają się ze zlokalizowanego w geometrycznym środku atomu dodatnio naładowanego jądra o małych wymiarach (10 - 13cm) i stosunkowo dużej masie oraz z poza jądrowego układu elektronów, zajmującego w porównaniu z jądrem znaczną przestrzeń (10 - 8cm), mającego minimalną masę i łączny ładunek ujemny równy co do wartości dodatniemu ładunkowi jądra.
Masa elektronu wynosi 0,0005434 u (czyli 1/1840 u). Ujemny ładunek elektryczny zgromadzony na pojedynczym elektronie wynosi ok. 1,6 * 10 - 19 C i nosi nazwę ładunku elementarnego lub elementarnej jednostki ładunku (symbol e w odróżnieniu od symbolu samego elektronu e - )
Jądro nie jest bryłą jednorodną. Składa się ono z dwóch rodzajów nukleonów: protonów i neutronów, które, podobnie jak elektrony, uważane są za cząstki elementarne. Oba nukleony mają prawie identyczne masy ok. 1 u (proton dokładnie 1,007 u, a neutron 1,009 u), natomiast różnią się ładunkiem elektrycznym: neutron elektrycznie obojętny, ma ładunek równy zeru; proton zaś obdarzony jest jednym elementarnym ładunkiem dodatnim.
Liczba protonów w danym atomie jest równa liczbie elektronów i nosi nazwę liczby atomowej z. Łączna liczba protonów i neutronów w danym jądrze jest nazywana liczbą masową - symbol A. Zbiór atomów o tej samej licznie protonów i tej samej liczbie neutronów został nazwany nuklidem - np. fluor, sód, glin.
Energia wiązania jądra jest miarą jego trwałości. Jest to energia, jaką należałoby dostarczyć do jądra, aby rozdzielić je na poszczególne nukleony.
LICZBY KWANTOWE.
Liczby kwantowe - cztery charakterystyczne wielkości, za pomocą których określa się stan energetyczny elektronu w atomie.
Liczba stanów kwantowych jest to maksymalna liczba elektronów w powłoce.
Zakaz Pauliego - w atomie nie może być dwóch elektronów w jednakowym stanie kwantomechanicznym, tzn. takich, które miałyby te same wartości wszystkich czterech liczb kwantowych.
Liczby kwantowe to :
główna liczba kwantowa (n) - czyli powłoki elektronowe, n = 1,2,3 ... 7
orbitalna (poboczna) liczba kwantowa (l) - kwantuje moment pędu elektronu, czyli rozróżnia stany energetyczne znajdujące się na powłoce. Wartość tej liczby to: od 0 do n-1 czyli 0 ,1 ,2 ,3 /4, co odpowiada symbolom podpowłoki s, p, d, f oraz g. Orbitalem nazywamy funkcję falową opisującą stan elektrony w atomie.
Magnetyczna liczba kwantowa (m) - kwantuje wartość rzutu momentu pędu na kierunek pola magnetycznego. Charakteryzuje niewielkie różnice energetyczne między elektronami jednej podpowłoki. Jej wartość wynosi od -1, poprzez 0 i do 1.
Spinowa wartość kwantowa (ms) - kwantuje rzut momentu spinowego na wyróżniony kierunek w przestrzeni
Numer powłoki |
Symbol powłoki |
Symbole podpowłok |
Liczba orbitali w podpowłokach S P D F |
1 |
K |
S |
1 - - - |
2 |
L |
S, P. |
1 3 - - |
3 |
M. |
S, P., D |
1 3 5 7 |
4 |
N |
S, P., D ,F |
1 3 5 7 |
Reguła Hunda (maksymalnej różnorodności) - w każdej podpowłoce kolejne elektrony obsadzają pojedynczo poszczególne orbitale, a w następnej kolejności na orbitalach tych są umieszczane drugie elektrony o przeciwnych liczbach spinowych.
Elektrony walencyjne - biorą udział w tworzeniu wiązań chemicznych. Są to elektrony s i p. oraz w niektórych pierwiastkach promieniotwórczych d i f.
Poziome szeregi układu okresowego obejmujące pierwiastki, których atomy mają tę samą liczbę powłok elektronowych nazywamy okresami i numerujemy je kolejnymi cyframi od 1 do 7.
Zgodnie z kolejnością zapełnienia przez elektrony podpowłok atomowych s, p., d, f, grupy pierwiastków połączono w odpowiednie bloki:
blok p. - grupy 13 - 18
blok s - grupy 1 i 2 - atomy tych pierwiastków w zewnętrznej powłoce n mają tylko jedną podpowłokę s , a na niej 1 lub 2 elektrony (s1 lub s2)
blok d - grupy 3 - 12
blok f - grupy lantanowców i aktynowców
Po zapełnieniu podpowłoki s dwoma elektronami nie następuje rozbudowa podpowłoki 4p., lecz zapełnia się podpowłoka 3d, której odpowiada mniejsza energia.
OKRESOWOŚĆ ENERGII JONIZACJI.
Energia jonizacji - jest to energia potrzebna do oderwania elektronu najsłabiej związanego z atomem i przeniesienia go poza sferę oddziaływania atomu; jest ona nazywana pierwszą energią jonizacji.
A + energia = A+ + e -
OKRESOWOŚĆ POWINNOWACTWA ELEKTRONOWEGO.
Powinowactwo elektronowe, czyli powinowactwo atomu do elektronu, jest to energia potrzebna do oderwania elektronu od jonu ujemnego.
X - = X + e
OKRESOWOŚĆ ELEKTROUJEMNOŚCI.
Elektroujemność - jest umowną miarą skłonności atomu do przyciągania elektronów podczas tworzenia wiązania chemicznego.
Skala Paulinga 4 (najbardziej elektroujemny czyli fluor) - 0,7 (najbardziej elektrododatni czyli cez).
WIĄZANIE CHEMICZNE. ELEKTRONY WALENCYJNE.
Wiązanie chemiczne - wzajemne oddziaływanie atomów w cząsteczkach pierwiastków i związków chemicznych.
Cząsteczka - zespół atomów powiązanych ze sobą mocno aby można je było powiązać.
Rozróżniamy 2 rodzaje sił działających między atomami zbliżonymi do siebie na dostatecznie małą odległość:
siły powstające wskutek wymiany elektronów między atomami, prowadzące do utworzenia wiązań chemicznych,
siły van der Waalsa (siły drugiego rzędu) - oddziaływują między zbliżającymi się atomami,
Typy wiązań chemicznych:
wiązania kowalencyjne, czyli atomowe lub homeopolarne,
wiązania jonowe czyli heteropolarne,
wiązania metaliczne,
Teoria wiązania chemicznego (wg Lewisa i Kossela) - atomy wiążą się w cząsteczki aby uzyskać trwałą konfigurację zewnętrznej powłoki najbliższego w układzie okresowym helowca.
WIĄZANIE KOWALENCYJNE.
Wiązanie kowalencyjne (atomowe) - wiązanie chemiczne utworzone za pomocą wspólnej pary elektronowej.
Wiązania kowalencyjne mogą być realizowane przez jedną, dwie lub trzy pary elektronowe; mówimy wtedy o pojedynczym, podwójnym lub potrójnym wiązaniu kowalencyjnym.
Wiązanie powstające przez powstanie pary elektronowej, którą opisuje orbital molekularny s-s lub ukierunkowany wzdłuż linii prostej. Orbital molekularny p.-p. oznacza się poprzez literę σ (sigma) i nazywamy wiązaniem sigma.
Orbital zhybryzydowany - orbitale wiążące są równocenne, nie można odróżnić, które elektrony uprzednio należały do orbitali s, a które do orbitali p.
PODSTAWY TEORII ORBITALI MOLEKULARNYCH.
Strukturę elektronową atomu opisuje się za pomocą orbitali atomowych, tak też strukturę cząsteczki opisać można za pomocą orbitali molekularnych(cząsteczkowych). Istota teorii orbitali polega na przypisaniu każdemu elektronowi w cząsteczce pewnej funkcji falowej, nazywanej orbitalem molekularnym. Orbitale molekularne opisują strukturę molekularną całej cząsteczki. Powstają w wyniku nakładania orbitali atomowych elektronów walencyjnych. Jeżeli wytworzone orbitale molekularne mają przestrzenie orbitalne umiejscowione wzdłuż osi cząsteczki, to nazywamy je orbitalami typu σ. Orbitale typu σ mogą mieć charakter wiążący (σ) lub antywiążący (σ*). Przeniesieniu elektronu z orbitalu atomowego na wiążący orbital molekularny towarzyszy zmniejszenie energii potencjalnej elektronu, zaś przeniesienie elektronu na orbital antywiążący powoduje zwiększenie jego energii.
Szczególnym przypadkiem wiązania kowalencyjnego jest wiązanie koordynacyjne (donorowo - akceptorowe), w którym wspólna para elektronowa pochodzi tylko od jednego z wiążących się 2 atomów, np. H3O+, jon hydroniowy). Atom ten nazywamy donorem. Atom, który przyłącza parę elektronową na swój wolny orbital, nazywamy akceptorem.
PODSUMOWANIE.
Wiązanie kowalencyjne polega na wytworzeniu par elektronowych, wspólnych dla dwu wiążących się atomów.
Warunkiem utworzenia wiązania kowalencyjnego jest powstanie orbitalu molekularnego poprzez nałożenie się orbitali atomowych obsadzonych pojedynczymi elektronami o przeciwnej orientacji spinów.
Kształt orbitalu molekularnego zależy między innymi od kształtu tworzących go orbitali atomowych.
Liczba wiązań kowalencyjnych jakie może utworzyć atom jest równa liczbie jego niesparowanych elektronów.
Pojedyncze wiązanie kowalencyjne jest zawsze wiązaniem σ. Poznaliśmy wiązanie σ, które powstaje przez nałożenie się orbitali atomowych s i s lub liniowe nałożenie orbitali p. i p.
W wiązaniu wielokrotnym jedno jest zawsze wiązaniem σ, drugie i trzecie są wiązaniami Π. Wiązania Π powstają przez boczne nałożenie się orbitali p. i p. Są to wiązania słabsze od wiązań σ.
POLARYZACJA WIĄZAŃ KOWALENCYJNYCH.
Miarą polarności wiązania jest moment dipolowy układu atomów tworzących wiązanie, nazywany momentem dipolowym grupy.
Moment dipolowy jest to wektor, skierowany od ujemnego do dodatniego bieguna dipola, o wartości skalarnej
μ = q * d
gdzie: q - wartość bezwzględna ładunku jednego bieguna, d - odległość biegunów.
WIĄZANIE JONOWE.
Siła wiązania jonowego jest to siła wzajemnego przyciągania różnoimiennych jonów.
Kationy są zawsze znacznie mniejsze od atomów, z których powstały, aniony zaś - większe od macierzystych atomów.
Skłonność atomów do tworzenia wiązania jonowego jest tym większa, im większa jest różnica ich elektroujemności.
Siły wiązania jonowego stanowią sferę oddziaływań nie mającą żadnych uprzywilejowanych kierunków.
WIĄZANIE METALICZNE.
Zjonizowane dodatnio jony metalu tworzą gęsto upakowaną sieć krystaliczną. Uwolnione w wyniku jonizacji elektrony walencyjne są zdelokalizowane, tzn., w odróżnieniu od elektronów uczestniczących w wiązaniach jonowych i atomowych, nie są przypisane do określonych jonów lub par atomów, lecz poruszają się w obrębie całej sieci krystalicznej. Siły wiązania metalicznego są wynikiem oddziaływania dodatnich jonów metalu z chmurą elektronów, nazywaną często gazem elektronowym.
ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE.
Oddziaływania międzycząsteczkowe, nazywane też siłami van der Waalsa lub wiązaniami drugiego rzędu, są to słabe oddziaływania między atomami lub cząsteczkami, nie mające charakteru wiązania chemicznego.
Oddziaływania międzycząsteczkowe mogą być typu:
dipol - dipol,
dipol - cząsteczka niepolarna,
cząsteczka niepolarna - cząsteczka niepolarna,
Energia oddziaływań międzycząsteczkowych wynosi od 4 do 40 kJ * mol-1, co stanowi około 10 % energii typowego wiązania chemicznego.
WIĄZANIE WODOROWE.
Wiązanie wodorowe polega na utworzeniu mostków wodorowych między cząsteczkami zawierającymi atomy wodoru i związane z nim atomy pierwiastka silnie elektroujemnego mającego wolne pary elektronowe.
ROZTWORY.
Roztworem nazywamy jednofazowy układ złożony z rozpuszczalnika i substancji rozpuszczonej.
Rozróżniamy:
roztwory ciekłe - można je otrzymać przez rozpuszczenie gazu lub ciała stałego w cieczy, zwanej rozpuszczalnikiem, przez zmieszanie dwu cieczy lub przez reakcję chemiczną, której produkt pozostaje w fazie ciekłej,
roztwór rzeczywisty - jest to roztwór, w którym substancja rozpuszczona występuje w postaci pojedynczych atomów, jonów lub cząsteczek o wymiarach mniejszych od około 1 mm,
roztwór koloidalny (zol) - zawiera cząstki substancji rozpuszczonej większe od 1 nm, a mniejsze od 200 nm,
roztwory wodne i niewodne,
elektrolit - substancja, która po rozpuszczeniu dysocjuje (rozkłada się) na jony,
Solwatacja - polega na przyłączaniu się polarnych cząsteczek rozpuszczalnika do jonów lub cząsteczek substancji rozpuszczonej.
Hydratacja - jest to solwatacja w roztworach wodnych, czyli proces przyłączania się cząsteczek wody.
![]()
gdzie:
F - siła wzajemnego oddziaływania jonów Q1 i Q2
Q1,Q2 - ładunki jonów
r - odległość ładunków
εr - stała dielektryczna rozpuszczalnika
εo - stała dielektryczna próżni
Ciecze polarne są dobrymi rozpuszczalnikami związków polarnych, ciecze niepolarne zaś są dobrymi rozpuszczalnikami związków niepolarnych, czyli „podobne rozpuszcza podobne”.
Równowagą pozorną nazywamy taki stan układu, w którym nie ma rzeczywistej równowagi pomiędzy składnikami, a przemiana fazowa (lub reakcja chemiczna) nie następuje ze względów kinetycznych.
ROZPUSZCZALNOŚĆ = ILOŚĆ SUBSTANCJI ROZPUSZCZONEJ/ 100g ROZPUSZCZALNIKA
STĘŻENIA ROZTWORÓW.
Stężenie roztworu jest to stosunek ilości substancji rozpuszczonej do ilości rozpuszczalnika lub roztworu.
Stężenie molowe (licznościowe) - jest to stosunek liczności substancji rozpuszczonej do objętości roztworu.
![]()
gdzie: c - stężenie molowe; m. - masa, M. - masa molowa substancji rozpuszczonej, V - objętość roztworu
Stężenie masowe, nazywane też stężeniem wagowym, ułamkiem wagowym lub ułamkiem masowym, jest stosunkiem masy substancji rozpuszczonej do masy roztworu.
LICZNOŚĆ MATERII = ILOŚĆ MOLI
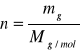
Stężenie procentowe masowe określamy liczbą jednostek masy substancji rozpuszczonej, przypadającą na sto jednostek masy roztworu.
![]()
![]()
![]()
WRZENIE I KRZEPNIĘCIE ROZTWORÓW.
Prawo Raoulta - prężność pary składnika A nad roztworem w określonej temperaturze zależy od ułamka molowego tego składnika.
![]()
![]()
gdzie:
∆T - podwyższa temperaturę wrzenia lub obniża temperaturę krzepnięcia roztworu,
k - wartość stała dla danego rozpuszczalnika ( stała ebulioskopowa ke dla wrzenia lub stała krioskopowa kkr dla krzepnięcia,
mb - stężenie substancji rozpuszczonej wyrażone stosunkiem liczebności substancji rozpuszczonej do masy rozpuszczalnika
DYSOCJACJA ELEKTROLITYCZNA.
Dysocjacją elektrolityczną nazywamy:
uwalnianie jonów z sieci krystalicznej, zachodzące w trakcie rozpuszczania związków o budowie jonowej, np. soli, w rozpuszczalniku polarnym:
NaCl = Na+ + Cl -
Na3PO4 = 3 Na+ + PO43 -
tworzenie jonów z cząsteczek wprowadzonych do roztworu w wyniku ich reakcji z cząsteczkami polarnego rozpuszczalnika :
NH3 + H2O = NH4+ + OH -
CH3COOH + H2O = CH3COO - + H3O+
HCl + H2O = H3O+ + Cl -
rozpad na jony pewnej liczby cząsteczek rozpuszczalnika, np. wody:
2H2O = H3O+ + OH -
2NH3 = NH4+ + NH2 -
Elektrolit - substancja ulegająca dysocjacji
MOC ELEKTROLITÓW ( DYSOCJACJA ELEKTROLITYCZNA).
α = LICZBA CZĄSTEK ZDYSOCJONOWANYCH / LICZBA CZĄSTEK PRZED DYSOCJACJĄ
Mocne elektrolity są to substancje, które nawet w roztworach o dużych stężeniach w znacznym stopniu dysocjują na jony.
Należą do nich sole oraz mocne kwasy i mocne zasady, np. KCl, NH4Cl, HNO3, HCl, H2SO4, NaOH, Ba(OH)2
Słabe elektrolity, średnio stężone, dysocjują na jony tylko częściowo, α<0,003.
Należą do nich np. kwas octowy (CH3COOH), kwas węglowy (H2CO3) i inne.
Stała dysocjacji - miara mocy słabych elektrolitów, nazywana stałą równowagi reakcji dysocjacji.
Stała równowagi, w odróżnieniu od stopnia dysocjacji, nie zależy od stężenia elektrolitu.
![]()
TEORIA JONOWA ARRBENIUSA.
Według Arrbeniusa kwasami są substancje, które w roztworach wodnych odczepiają jon wodorowy:
HA = H+ + A-
Zasadami natomiast substancje, które odszczepiają jon wodorotlenowy:
MOH = M+ + OH-
Solami są związki otrzymywane, w reakcji kwasu z zasadą (reakcji zobojętniania).
TEORIA HYDRONOWA BRŐNSTEDA I LAWRY'EGO.
Hydron jest to dodatni jon wodoru o naturalnym składzie izotopowym.
Kwasy są donorami, a zasady akceptorami hydronów.
Kwas oddając hydron staje się zasadą, a zasada przyłączając hydron staje się kwasem.
NH4+ + H2O = NH3 + H3O -
Kwas zasada zasada kwas
H3O+ + CN- = HCN + H2O
Kwas zasada kwas zasada
Dysocjacja elektrolityczna wody:
2H2O = H3O+ + OH-
Jon H3O+ nazywamy jonem oksoniowym. Powstaje on przez przyłączenie jonu H+ (hydronu) do cząstki wody.
H2O = H+ + OH-
Stała dysocjacji wody ma w temperaturze 298 K wartość 1,8 * 10-16.
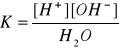
Stężenie wody w wodzie (CH2O) jest stałe i wynosi 55 kmol * m-3, czyli:
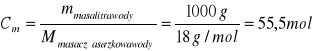
Kw = [H+] [OH-] = 1*10-14
Wartość iloczynu jonowego wody jest stała w stałej temperaturze, zarówno dla czystej wody, jak i dla wszystkich układów, w których występuje woda. W czystej wodzie stężenia molowe jonów wodorowych i wodorotlenkowych są sobie równe.
[H+] = [OH-] = 10-7
Odczyn czystej wody jest obojętny. Roztwory, w których stężenie jonów wodorowych [H+] jest większe od stężenia jonów wodorotlenowych [OH-], czyli [H+]>10-7, są kwaśne. W roztworach zasadowych [OH-] >[H+], czyli [H+]<10-7 a [OH-] >10-7.
Odczyn roztworu określa wartość pH, która jest zdefiniowana następująco:
pH = - log[H+]
Roztwory o pH=7 mają odczyn obojętny, o pH<7 - kwaśny, zaś pH>7 - zasadowy.
HYDROLIZA.
Niektóre jony, powstające podczas rozpuszczania soli w wodzie reagują z cząsteczkami wody tworząc cząsteczki zasady lub kwasu, np.
NH4Cl = NH4+ + Cl - oraz NH4+ + H2O = NH4OH + H+
W reakcji powstaje zasada amonowa i jony wodorowe, których stężenie jest większe niż stężenie jonów wodorowych w czystej wodzie. Roztwór ma odczyn kwaśny.
Rozpuszczanie octanu sodu w wodzie zachodzi z uwolnieniem jonów:
CH3COONa = CH3COO - + Na+
I jon octanowy hydrolizuje:
CH3COO - + H2O = CH3COOH + OH -
Hydrolizie ulegają jony, które w reakcji z wodą tworzą słabsze kwasy i jony OH - lub słabe zasady i jony H+.
ROZPUSZCZALNOŚĆ I ILOCZYN ROZPUSZCZLNOŚCI.
Każdy związek chemiczny charakteryzują się określoną rozpuszczalnością, tzn. maksymalną ilością substancji, która może się rozpuścić w danej temperaturze w określonej ilości rozpuszczalnika lub roztworu.
Roztwór zawierający maksymalną w danej temperaturze ilość substancji rozpuszczonej nazywamy roztworem nasyconym.
W nasyconym roztworze mało rozpuszczalnego elektrolitu panuje równowaga pomiędzy jonami a osadem.
Ag2S(s) = 2Ag+ + S2-
Stałą równowagi tej reakcji:
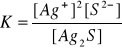
zastępuje się wyrażeniem:
[Ag+]2 [S2-] = KAg2S
Iloczyn stężeń względnych jonów mało rozpuszczalnego elektrolitu w roztworze nasyconym jest nazywany iloczynem rozpuszczalności tego elektrolitu.
REAKCJE UTLENIANIA - REDUKCJI.
Proces polegający na utracie elektronów przez atomy, cząstki lub jony nazywamy utlenianiem.
Odwrotny proces polegający na pobieraniu elektronów nosi nazwę redukcji.
Substancję ulegającą utlenieniu, czyli oddającą elektron substancji redukowanej nazywamy reduktorem.
Substancję ulegającą redukcji, czyli pobierającą elektron od substancji utlenianej nazywamy utleniaczem.
2Mg+ + O2 = 2MgO
2Mg = Mg2+ + 4 e - r. procesu utleniania równania
O2 + 4e = 2 O2 - - r. procesu redukcji połówkowe
UTLENIANIE
UTLENIACZ
(AKCEPTOR ELEKTRONÓW)
2Na + Cl2 → 2Na+ + 2Cl -
REDUKCJA
REDUKTOR
(DONOR ELEKTRONÓW)
Są to reakcje tzw. redoks.
REAKCJA REDOKS = PRZENIESIENIE ELEKTRÓW
Utlenianie i redukcja zachodzą równocześnie.
STOPNIE UTLENIANIA.
W przypadku związków o wiązaniach jonowych stopnie utlenienia są równe liczbie oddanych lub przyjętych elektronów.
Pierwiastki w stanie wolnym mają stopień utlenienia równy zero, np.: Pb0, Cl20, H20, He0.
Suma stopni utlenienia wszystkich atomów pierwiastków wchodzących w skład obojętnej cząsteczki związku wynosi zero. 2 + 2(-1) = 0
FeCl2
Suma stopni utlenienia wszystkich atomów pierwiastków wchodzących w skład jonu złożonego jest równa ładunkowi tego jonu.
W procesach utleniania następuje podwyższenie stopnia utleniania reduktora.
W prosach redukcji - obniżenie stopnia utlenienia utleniacza.
X Al0 + yS0 → Al23+ S32-
2 Al0 → 2 Al+3 + 3e 3e najmniejsza wspólna x2
3 S0 + 2e → 3S2- 2e wielokrotność x3
2 Al + 3 S + 6e → Al2S3 + 6e
K+1Mn+7O4- 2 manganian (VII) potasu
(+1) (+7) 4(-2)
ELEKTROCHEMIA.
Elektrochemia zajmuje się współzależnością zjawisk elektrycznych i chemicznych, z zwłaszcza przemianą energii reakcji chemicznych w energię elektryczną i vice versa, czyli procesami przebiegającymi podczas pracy ogniw galwanicznych i podczas elektrolizy.
OGNIWA GALWANICZNE.
Prostym przykładem samorzutnego procesu redoksowego jest reakcja metalicznego cynku z jonami miedzi:
![]()
Jon Cu2 + redukuje się do miedzi metalicznej. Reakcja przebiega samorzutnie, tzn. potencjał termodynamiczny zmniejsza się.
Przestrzeń elektrodowa, w której zachodzi reakcja utleniania może być oddzielona od przestrzeni, w której zachodzi reakcja redukcji. Układ, w którym reakcja utleniania została przestrzennie oddzielona od reakcji redukcji, stanowi ogniwo galwaniczne. Metal wraz z roztworem elektrolitu nazywamy półogniwem lub elektrodą. Np., na elektrodzie miedzianej, zanurzonej w roztworze soli miedzi, następuje redukcja jonów miedzi:
![]()
Elektroda, na której odbywa się redukcja, jest katodą ogniwa galwanicznego. Na drugiej elektrodzie, która jest anodą, następuje reakcja utleniania:
![]()
POTENCJAŁY ELEKTROD.
Normalna (standardowa) elektroda wodorowa jest to elektroda gazowa, wykonana z platyny pokrytej czernią platynową, omywana strumieniem gazowego wodoru pod ciśnieniem 100,0 kPa, zanurzona w roztworze o jednostkowej aktywności jonów wodorowych, pracująca w temperaturze 298,15 K.
Na powierzchni tej elektrody ustala się stan równowagi między gazowym wodorem a jonami wodorowymi H+, a równanie połówkowej reakcji oksydacyjno - redukcyjnej ma postać:
![]()
Normalny potencjał oksydacyjno - redukcyjny tej reakcji, czyli normalny potencjał elektrody wodorowej, jest z definicji równy zeru w każdej temperaturze.
Normalny (standardowy) potencjał metalu Eo jest różnicą potencjałów mierzoną między półogniwem z rozpatrywanego metalu, pracującym w warunkach standardowych, a normalną elektrodą wodorową.
Szereg pierwiastków uporządkowany według wzrastającego potencjału normalnego, nazywamy szeregiem napięciowym.
Zależność potencjału elektrody od temperatury i aktywności jonów w roztworze wyraża równanie Nernsta:
![]()
gdzie: a(oks) i a(red) - względne aktywności formy utlenionej i zredukowanej, E o - potencjał normalny elektrody, R - stała gazowa (8,314 J mol -1 K -1), T - temperatura, n - liczba ładunków jonu, F- stała Faradaya równa ładunkowi jednego mola elektronów (tj, 96485 C mol -1
SIŁA ELEKTROMOTORYCZNA OGNIWA GALWANICZEGO.
![]()
Siłę elektromotoryczną ogniwa galwanicznego definiuję się jako różnicę między potencjałem przewodnika metalicznego, przedstawionego z prawej strony na schemacie ogniwa a potencjałem przewodnika metalicznego znajdującego się z lewej strony na schemacie ogniwa.
AKUMULATOR OŁOWIANY.
Akumulator ołowiany jest baterią złożoną najczęściej z trzech lub z sześciu ogniw galwanicznych.
W gotowym do pracy ogniwie elektrodę ujemną stanowi płyta z metalicznego ołowiu, a dodatnią - płyta pokryta warstwą PbO2. Są one zanurzone w 25 % roztworze wodnym kwasu siarkowego. Różnica potencjałów między elektrodami wynosi około 2,2V. Źródłem energii elektrycznej są reakcje na elektrodach.
ELEKTROLIZA.
Przemiany energii elektrycznej w chemiczną ilościowo ujmują prawa Faradaya:
masa m. produktu wydzielonego na elektrodzie podczas elektrolizy jest proporcjonalna do wielkości ładunku Q przeniesionego przez elektrolit.
Przepływ jednakowych ładunków przez różne elektrolity powoduje wydzielenie substancji ,m. których masy są proporcjonalne do mas molowych substancji podzielonych przez liczbę ładunków jonu ( do ich równoważników chemicznych).
Pierwsze prawo Faradaya można zapisać:
![]()
współczynnik k jest równoważnikiem elektrochemicznym danej substancji:
![]()
![]()
![]()
![]()
gdzie: i - natężenie prądu, t - czas, n - liczba ładunków jonu, M. - masa atomowa lub cząsteczkowa, F - stała Faradaya.
KOROZJA.
Korozją nazywamy proces niszczenia materiałów, najczęściej metali, wskutek chemicznego lub elektrochemicznego oddziaływania środowiska. Korozja materiałów niemetalicznych, takich jak materiały budowlane i organiczne tworzywa sztuczne, polega najczęściej na ich prostym rozpuszczaniu, uwadnianiu lub utlenianiu.
Korozja chemiczna metalu występuje wtedy, gdy reakcji nie towarzyszy przepływ ładunku elektrycznego przez metal lub elektrolit. Przykładami takiej korozji są reakcje metali z aktywnymi gazami, np. z tlenem, związkami siarki lub z fluorowcami, zachodzące w wysokiej temperaturze.
W procesie korozji elektrochemicznej tworzą się ogniwa galwaniczne i wskutek tego następuje przepływ elektronów przez granicę metal - elektrolit.
METALE.
POJĘCIA OGÓLNE.
Substancje bezpostaciowe - atomy ułożone w sposób nieuporządkowany, wykazują jednakowe własności we wszystkich kierunkach.
Substancje krystaliczne - atomy ułożone są w sposób uporządkowany, kierunkowo uporządkowana budowa - własności różnią się w zależności od kierunku ( grafit - heksagonalny). Taki elementarny układ geometryczny stanowi siatkę przestrzenną.
LICZBA KOORDYNACYJA (LK) - jest to liczba atomów jednakowych i najbliższych, równoległych do dowolnego atomu w sieci krystalicznej.
BUDOWA KRYSTALICZNA METALI.
UKŁADY O DUŻEJ SYMETRII.
UKŁAD REGULARNY:
płasko centrowany LK = 12 ( 14 atomów daje siatkę),
centrowany przestrzennie LK = 8 (9 atomów daje siatkę)
UKŁAD HEKSAGONALNY LK = 12 (17 atomów daje siatkę)
CECHY METALI.
dobre przewodnictwo cieplne i elektryczne,
połysk,
plastyczność ( związana z budową chemiczną)
Te trzy cechy wynikają z wiązania metalicznego.
W krysztale kationy metalu ułożone są w węzłach sieci a elektrony ( gaz elektronowy) są wspólne dla wszystkich kationów i mogą się swobodnie przemieszczać wewnątrz sieci. Prąd elektryczny jest ruchem elektronów.
STOP - mieszanina dwóch lub więcej metali - w celu polepszenia własności ( twardości, odporności na korozję).
ŻELAZO - OTRZYMYWANIE: FeO - Fe2O3 - magnetyt,
Fe2O3 - hematyt![]()
wytop surówki ( w wielkim piecu) - redukcja tlenków Fe,
świeżenie surówki ( metoda konwertorowa i Siemensa - Martina) - utlenianie nadmiaru C, Si, P. i S
WYTOP - reduktorem jest C (koks hutniczy) lub CO ( z koksu). Topniki ułatwiają tworzenie łatwo topliwego żużla. Skała płonna jest kwaśna (SiO2), topniki zasadowe (CaCO3 - wapniak - kalcyt, CuCO3 - MgCO3 - dolomit).
Gaz wielkopiecowy zawiera ok. 60 % N, 25 % CO, 15 % CO2.
RUDA+ZŁOŻE+TOPNIK+KOKS+POWIETRZE=SURÓWKA+ŻUŻEL+GAZ WIELKOPIECOWY
WIELKI PIEC - typu szybowego - pracuje przeciw prądowo, w sposób ciągły, konieczne są 2 podgrzewacze.
odwadnianie rudy,
redukcja za pomocą CO,
redukcja węglem.
2CO↔ C + CO2 - RÓWNOWAGA W PIECU
Redukcja rozpoczyna się w temperaturze powyżej 400˚C , następnie w temperaturze ok. 500 ˚C: FeO+CO=Fe+CO2, w temperaturze od około 900˚C: FeO+ C= Fe+ CO
Węgiel rozpuszcza się częściowo w powstającym żelazie i nawęgla je. Surówka przesuwa się do strofy z wyższą temperaturą (~ 1200˚C) i w tej temperaturze topi się i spływa do gara. Żużel to niskotopliwe gliniany i krzemiany wapnia, odpływa z górnej strefy gara.
SURÓWKA, ŻELIWO, STAL.
SURÓWKA- biała ( zawiera węgiel w formie Fe3C - cementyt - twardy, kruchy, jasny) lub szara - płytki grafitu
( plastyczna).
Surówki zawierają 3 - 4,5% C - są kruche i nie nadają się do kucia ani do walcowania.
ŻELIWO - zmniejszając C i Si otrzymuje się żeliwo. Robi się to przetapiając surówkę ze złomem ubogim w C i Si. Są żeliwa białe i szare. Odlewa się je w formy, są kruche, nie dają się kuć ani walcować.
ŚWIEŻENIE SURÓWKI:
Zmniejszenie zawartości C poniżej 1,5% Si, Mg, P i S.
Spalenie tlenem powietrza lub tlenkami Fe:
METODA KONWERTOROWA
Bessemera - wyłożenie kwaśne (kwarc)
Thomasa - wyłożenie zasadowe - wypalony dolomit,
Ogrzewanie ciepłem spalania domieszek tj. C, Si i P
Przedmuchuje się przez płynną surówkę powietrze.
Konwertor Bessemera ma kształt gruszki.
Konwertor Thomasa - może świeżyć surówkę bogatą w P. i Mg ( w Bessemera nie może). P2O5 z CaO i MgO - tworzą fosforany Ca i Mg - co stanowi żużel Thomasa - TOMASYNA - nawóz.
b) METODA SIEMENSA - MARTINA - najpopularniejsza, stopienie surówki z zardzewiałym złomem. Rdza redukuje się do Fe utleniając węgiel i Si - w temperaturze ok. 1500˚C, nagrzewanie pieca martenowskiego gazem generatorowym.
RODZAJE STOPÓW:
stal - stop Fe i C o zawartości powyżej 1,7%C
stal o niskiej zawartości C (o,3 - 0,6%) - stal miękka,
stal o średnie zawartości ( 0,6 - 1,2)
stal o wysokiej zawartości (1,2 - 1,5)
Stale stopowe - oprócz Fe i C zawierają inne pierwiastki polepszające własności mechaniczne lub zmniejszające korozyjność.
własności mechaniczne polepszają: Cr, Ni, W, Mo, V ( stal stopowa), elektrostal - piece łukowe
odporne na korozję - nierdzewne, kwasoodporne (stopy z ? ).
ŻELIWO KRZEMOWE - stop Fe i Si - na rurociągi kwasowe,
MIEDŹ.
RUDY: chalkozyn - Cu2S
Chalkopiryt - CuFeS2
Kowelin - CuS
Bormit - Cu3FeS3
Rudy zawierają powyżej 2% Cu - bogate, ubogie wzbogaca się metodą flotacji do koncentratów zawierających 15 - 35% Cu. Z tego uzyskuje się miedź pirometalurgiczną - poprzez kamień miedziowy.
Najpierw - prażenie i usunięcie nadmiaru S, przetopienie na kamień miedziowy (Cu2S i FeS) (temperatura topnienia ~ 1000˚C) - płynny kamień miedziowy, wlewa się do konwertora i dmucha powietrzem - świeżenie kamienia miedziowego - 2 etapy:
2 Fe + 3 O2 + 2 SiO2 = 2 FeO SiO2 + 2 SO4 ↑
pow. Topnik żużel
po całkowitym utlenieniu Fe wylewa się z konwertora żużel, pozostaje Cu2S ( biały mat)
dalsze świeżenie matu
Cu2S +1 ½ O2 = Cu2O + SO2↑
2 Cu2O + Cu2S = 6 Cu + SO2↑
miedź surowa
(konwertorowa)
Miedź konwertorową poddaje się rafinacji ogniowej i elektrolitycznej.
RAFINACJA OGNIOWA.
Utlenianie zanieczyszczeń ( Fe, Ni, Co) oraz odparowanie domieszek (As, Sb, Zn) - piece płomienne - przedmuchuje się powietrze przez stopioną miedź, metale takie jak Ag, Au, Pt pozostają w Cu, jest to miedź hutnicza.
Gdy miedź zawiera metale szlachetne lub gdy ma służyć do celów elektrotechnicznych, poddaje się ją rafinacji elektrolitycznej.
RAFINACJA ELEKTROLITYCZNA.
Rozpuszczanie elektrolityczne miedzi (anoda) i osadzanie czystej na katodzie. Elektrolit CuSO4 i H2SO4.
+ -
anoda katoda
Cu →Cu++ + 2e - Cu++ + 2e - →Cu
Zanieczyszczenia tworzą szlam zawierający Ag, Au, Tl, Se. Rafinacji elektrolitycznej poddaje się obecnie całą miedź.
Stopy jubilerskie - Au i Ag z Cu
Nowe srebro - Cu - Zn - Ni - naczynia Dewara
Zastosowanie - elektrotechnika
Stopy odporne na korozję - nie działa - woda morska, para przegrzana.
MOSIĄDZ - Cu + Zn ( 40 - 45% Zn) czasem Sn, Al., Ni, Mn.
Brązy - cynowy [Cu - Sn [ Cu - Sn - Zn] Cu - Sn - Zn - Pb] Cu - Sn - Pb]
aluminiowy Cu - Al. (5 - 10% Al.) - odporne na korozję
manganowy Cu - Si ( 3 - 4% Si) - nie koroduje, nie wybucha
berylowy Cu - Be (2%)
ołowiowy Cu - Pb - łożyska
KOROZJA - proces niszczenia metali wskutek chemicznej lub elektrochemicznej reakcji metalu ze środowiskiem.
RODZAJE KOROZJI.
Z punktu widzenia termodynamiki korozja jest samorzutnym procesem, w którym metal dąży do przejścia w stan bardziej stabilny ( w przyrodzie nie występuje w stanie rodzimym)
Ze względu na rodzaj środowiska rozróżniamy korozję:
atmosferyczną,
gazową,
wodną,
ziemną,
Ze względu na mechanizm:
chemiczną,
elektrochemiczną,
2. Korozja chemiczna - przejście metalu w stan związany. Reakcjom nie towarzyszy przepływ prądu - zachodzi w atmosferze suchych gazów i ciekłych środowisk nieelektrolitów : O2, Cl2, Br, S
![]()
1
12
Wyszukiwarka
Podobne podstrony:
5069
5069
5069
5069
5069
5069
5069
5069
5069
więcej podobnych podstron