18. 19. A M I D Y i N I T R Y L E
Aleksander Kołodziejczyk, Krystyna Dzierzbicka Gdańsk 2012.09.
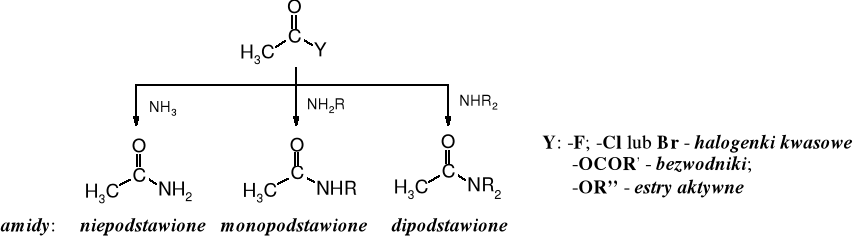
Amidami nazywane są pochodne kwasów karboksylowych, w których w grupie karboksylowej zamiast funkcji -OH znajduje się reszta amoniaku lub aminy: -NH2, -NHR lub -NR2, przy czym R może być alkilem lub arylem.
18.1 Rodzaje amidów
Monoacylowe pochodne amoniaku, a więc amidy, które zawierają grupę -NH2 nazywają się amidami niepodstawionymi, lub potocznie „pierwszorzędowymi”, ale ten sposób nazewnictwa nie jest zalecany. Amidy z grupami -NHR i -NR2 to odpowiednio amidy monopodstawione i dipodstawione (lub „drugorzędowe” i „trzeciorzędowe”).
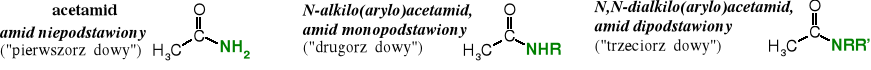
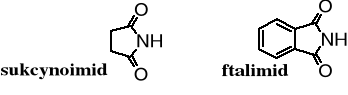
Aminy diacylowane zostały nazwane imidami. Powszechnie znane są imidy cykliczne, np. sukcynoimid i ftalimid.
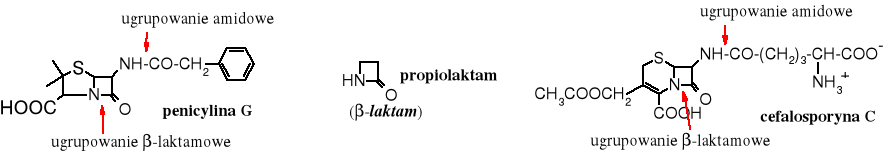
Amidy cykliczne noszę nazwę laktamów; należą do nich, np. znane antybiotyki -laktamowe czyli penicyliny i cefalosporyny; posiadają one strukturę propiolaktamu.
Popularnym, produkowanym na dużą skalę laktamem jest kaprolaktam. Powszechnie znany jest również butyrolaktam.

18.2 Elektronowa budowa grupy amidowej
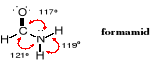
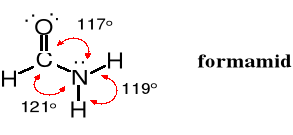
Atom węgla grupy amidowej, podobnie jak we wszystkich innych związkach zawierających funkcję karbonylową ma hybrydyzację sp2. Kąty wokół atomu azotu amidowego w formamidzie są zbliżone do 120o.
Wolna para elektronów atomu azotu jest sprzężona z elektronami funkcji karbonylowej i przez to atom ten nie tylko traci właściwości zasadowe (powinowactwo do protonu), ale również wiązanie C-N nabiera charakteru wiązania częściowo podwójnego, wobec czego obrót wokół niego wymaga pokonania większego oporu niż wokół większości pojedynczych wiązań.

W amidach podstawionych, w wyniku zahamowania swobodnego obrotu wokół wiązania C-N dochodzi do izomerii cis/trans. Zjawisko to występuje w peptydach i białkach, szczególnie często w miejscu zajmowanym przez resztę proliny.

konformery podstawionych amidów;
w konformerze cis obie grupy R są po tej samej stronie wiązania C-N
Silne kwasy są wstanie utworzyć sól z amidami; przy czym atom proton przyłącza się do atomu tlenu, gdyż jest on silniejszym akceptorem protonu.
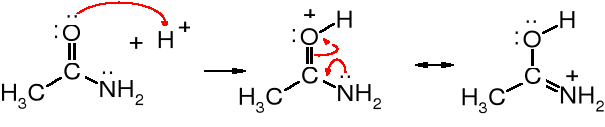
Z drugiej strony amidy są silniejszymi kwasami niż aminy, ponieważ atom wodoru związany z amidowym atomem azotu jest bardziej ruchliwy niż w aminach (pKa amidów < pKa amin).
Zadanie: przedstaw schemat reakcji wskazujący na kwasowe właściwości amidowego atomu wodoru acetamidu.
18.3 Występowanie
Amidy jako peptydy i białka należą do bardzo rozpowszechnionych związków naturalnych. Są to głównie pochodne aminokwasów, w których wiązanie amidowe, zwane wiązaniem peptydowym zostało utworzone przez grupę aminową jednego aminokwasu z grupą karboksylową drugiego aminokwasu. W skład białek może wchodzić od 100 do wielu tysięcy reszt aminokwasów, w peptydach od 2-100.
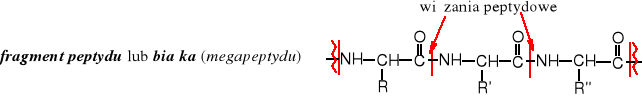
Amidami są dwa kodowane aminokwasy - asparagina i glutamina.

W antybiotykach -laktamowych oprócz ugrupowania laktamowego występuje również zwykłe amidowe. Popularne aminocukry, do których należą glukozoamina i galaktozoamina występują w postaci N-acetylowanej, tzn. są amidami. N-Acetyloglukozoamina jest składnikiem ścian komórkowych bakterii, a razem z N-acetylogalaktozoaminą wchodzą w skład markerów grup krwi, ponadto chityna to poli-N-acetyloglukozoamina.
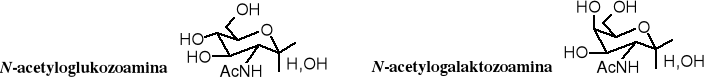
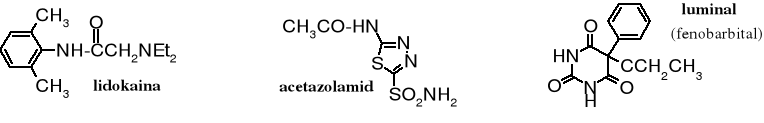
Ugrupowanie amidowe często występuje w lekach. Znajdziemy je w środkach miejscowo znieczulających, np. w lidokainie. Amidami są też pochodne kwasu barbiturowego, np. luminal czy lek moczopędny - acetazolamid.
Wiele włókien syntetycznych ma budowę poliamidową, np. nylon, perlon i inne włókna różniące się często tylko nazwą komercyjną. Nylon jest produktem kondensacji kwasu adypinowego z 1,6-heksametylenodiaminą, a perlon powstaje przez otwarcie pierścienia i polimeryzację kaprolaktamu.
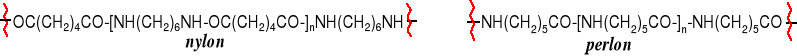
18.4 Nomenklatura
18.4.1 Nazwy zwyczajowe
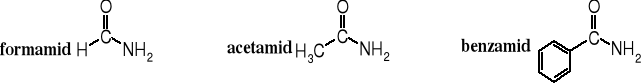
Zwyczajową nazwę amidów tworzy się przez dodanie końcówki -amid do rdzenia wywodzącego się od zwyczajowej nazwy reszty acylowej kwasu, np. formamid, acetamid, benzamid.
18.4.2 Systematyczne nazewnictwo polega na dodaniu do nazwy węglowodoru macierzystego końcówki -amid i łącznika „o”, np. etanoamid (etan + o + amid), propanoamid czy heksanoamid.

18.4.3 Sposób karboksyamidowy
Można również stosować nazewnictwo podobnie jak dla kwasów, tzn. do nazwy węglowodoru połączonego z grupą -CONH2 dodaje się końcówkę karboksyamid, np. cykloheksanokarboksyamid.
18.4.4 Stosuje się również sposób podstawnikowy, wówczas reszta -CONH2 przyjmuje nazwę karbamoilu.
![]()
cykloheksanokarboksyamid kwas o-karbamoilobenzoesowy
(kwas ftalamowy)
18.4.5 Amidy zawierające ugrupowanie N-arylowe nazywane są anilidami.
18.4.6 Pochodne acylowe amin
Amidy można traktować także jako acylowe pochodne amin i nazywać je zgodnie nomenklaturą aminową. Tak nazywana jest prezentowana powyżej N-acetyloglukozoamina. Podobne nazwy noszą pochodne aniliny czy bardziej skomplikowanych amin.
18.5 Otrzymywanie
18.5.1 Amonoliza (aminoliza) pochodnych kwasów karboksylowych
Amidy powstają w wyniku reakcji reaktywnych pochodnych kwasów karboksylowych, takich jak chlorki kwasowe, bezwodniki i estry (aktywne) z amoniakiem (amonoliza) lub z aminami (aminoliza), np.
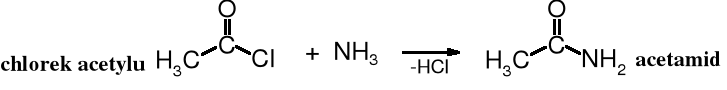
Amonolizę halogenków kwasowych i bezwodników przeprowadza się z nadmiarem aminy (amoniaku) lub dodaje się NaOH w celu wiązania wydzielającego się halogenowodoru lub kwasu karboksylowego. Reakcja amonolizy w wodzie w obecności NaOH nazywana jest reakcją Schottena-Baumanna.
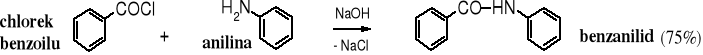
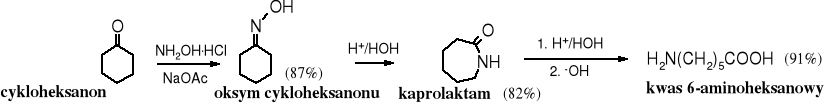
18.5.2 Przegrupowanie Beckmanna (E. Beckmann, Ber. Deut. Chem. Ges., 20, 1507 (1887)
Ketoksymy w obecności kwasów (lub odczynników wydzielających kwasy, np. bezwodników, PCl5 czy SOCl2) ulegają przegrupowaniu do monopodstawionych amidów.
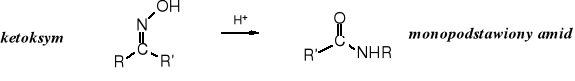
Należy zwrócić uwagę, że przegrupowaniu ulega reszta organiczna znajdująca się w położeniu trans do grupy hydroksylowej oksymu.
W praktyce jest to reakcja wykorzystywana zarówno do otrzymywania laktamów, np. kaprolaktamu lub poprzez ich hydrolizę, służy jako źródło odpowiednich kwasów karboksylowych.
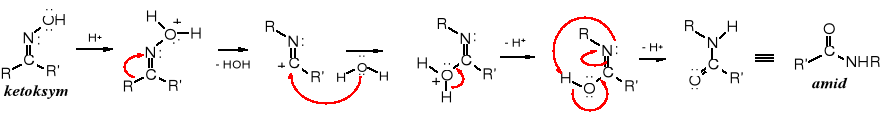
Mechanizm reakcji
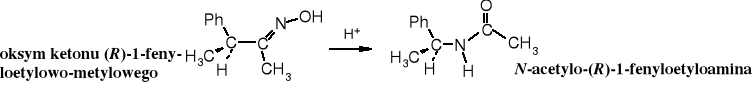
Jeżeli grupa migrująca R jest bezpośrednio związana z karbonylowym atomem C poprzez atom chiralny, to podczas przegrupowania nie dochodzi do zmiany konfiguracji na tym centrum. Retencja konfiguracji świadczy o tym, że jest to przegrupowanie wewnątrzcząsteczkowe, czyli reszta R zmienia lokalizację nie odrywając się od cząsteczki.
18.6 Właściwości fizyczne
Formamid jest cieczą o wysokiej temperaturze wrzenia - 193oC (z rozkładem). Miesza się z wodą w każdym stosunku, podobnie jak z etanolem. W innych rozpuszczalnikach organicznych jest trudniej rozpuszczalny. Właściwości te wynikają z jego wysokiej polarności. Znalazł zastosowanie jako dobry rozpuszczalnik związków polarnych, ale znacznie popularniejszym wysokopolarnym rozpuszczalnikiem jest jego pochodna - dimetyloformamid (DMF). Rozpuszczają się w nim nawet niektóre sole nieorganiczne. Acetamid (t.t. 82oC) i wyższe amidy są ciałami stałymi.
Zadanie: narysuj wzór dimetyloformamidu. Wytłumacz, dlaczego jest bardziej polarny niż formamid; wartości momentu dipolowego wynoszą odpowiednio: 3,8 D i 3,4D.
18.7 Właściwości chemiczne
18.7.1 Hydroliza
Amidy są znacznie mniej reaktywne niż inne pochodne kwasowe. Sprzężenie wolnej pary elektronowej atomu azotu z elektronami wiązania C=O zmniejsza ładunek dodatni na karbonylowym atomie węgla, co czyni to miejsce mniej podatne na atak nukleofilowy.
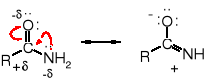
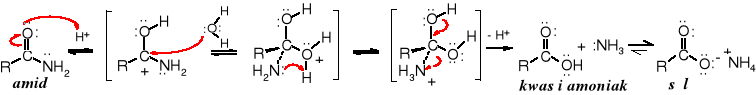
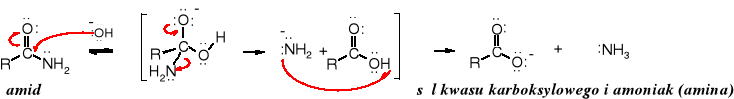
Amidy pod wpływem wody ulegają hydrolizie, jednak reakcja biegnie wolno i wymaga podwyższonej temperatury. Jest katalizowana zarówno przez kwasy i zasady. Jej produktami są kwasy karboksylowe i sole amin (dla katalizy kwaśnej) lub sole kwasów karboksylowych i aminy (w obecności zasad).
![]()
Hydroliza amidów stanowi metodę otrzymywania specyficznych kwasów i amin z amidów naturalnych, a także kwasów syntetycznych, głównie tych uzyskiwanych poprzez przegrupowanie Beckmanna.
Mechanizm
Mechanizm hydrolizy amidów jest taki sam jak hydrolizy innych pochodnych kwasowych i zaczyna się od ataku protonu na atom tlenu grupy karbonylowej w reakcji katalizowanej kwasami lub atakiem nukleofilowym grupy hydroksylowej na karbonylowy atom węgla w reakcji katalizowanej zasadami.
Hydroliza katalizowana kwasami:
Hydroliza katalizowana zasadami:
18.7.2 Alkoholiza, amonoliza, hydrazynoliza
Amidy ze względu na małą reaktywność trudno ulegają alkoholizie i amonolizie. Łatwo natomiast biegnie ich hydrazynoliza w wyniku, której powstają hydrazydy. Reakcja ta jest wykorzystywana do oznaczania tzw. C-końcowego aminokwasu w peptydach i białkach, tj. aminokwasu z wolną grupą karboksylową. Podczas hydrazynolizy wszystkie aminokwasy tworzące wiązanie peptydowe (amidowe) zostają przekształcone w hydrazydy, a ten z wolną grupą karboksylową tworzy sól z hydrazyną.
Zadanie: napisz schemat reakcji hydrazynolizy formanilidu.
18.7.3 Redukcja
Amidy podobnie jak inne pochodne kwasowe ulegają redukcji za pomocą tetrahydroglinianu litu. Znika przy tym grupa karbonylowa i tworzy się amina zawierająca taką samą liczbę atomów węgla, jak wyjściowy amid. W reakcjach z udziałem wodorków redukcja polega na addycji anionu wodorkowego. Jest to jedna z cennych metod otrzymywania amin.
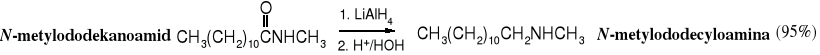
Substratami tej reakcji zwykle bywają kwasy karboksylowe, które po przekształceniu w odpowiednie amidy poddawane są redukcji.
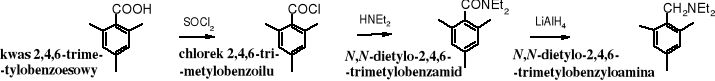
Z laktamów otrzymuje się aminy cykliczne.
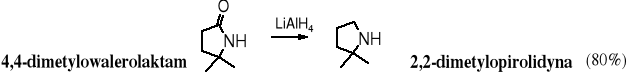
18.7.4 Dehydratacja
Amidy traktowane w podwyższonej temperaturze silnymi środkami odwadniającymi, takimi jak P2O5 czy SOCl2 tracą cząsteczkę wody i przechodzą w nitryle. DCC (dicykloheksylokarbodiimid) przekształca amidy w nitryle w temperaturze pokojowej.
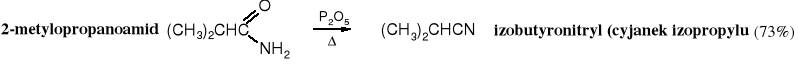
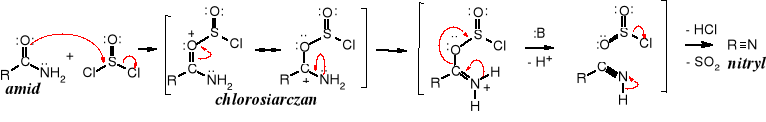
Użycie chlorku tionylu do odwadniania amidów ma tę zaletę, że jedynymi produktami reakcji obok nitrylu są lotne związki, łatwe do oddzielenia od głównego produktu.
![]()
Mechanizm powyższej reakcji polega na addycji chlorku tionylu do atomu tlenu grupy amidowej, utworzeniu chlorosiarczanu i eliminacji cząsteczki SO2 oraz chlorowodoru.
18.7.5 Przegrupowanie Hofmanna
Amidy niepodstawione pod wpływem bromu (również chloru) ulegają w środowisku zasadowym przegrupowaniu i degradacji do amin pierwszorzędowych (wydziela się CO2). Powstałe aminy zawierają o jeden atom węgla mniej niż wyjściowy amid (kwas). Dla przypomnienia: w wyniku redukcji amidów tetrahydroglininem litu powstają aminy o tej samej liczbie atomów węgla, co substrat.
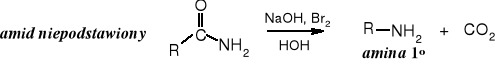
Reakcja ta od nazwiska odkrywcy nosi nazwę przegrupowania Hofmanna.
August Wilhelm von Hofmann (1818-1892); ur. w Giessen (Niemcy); prof. w Bonn, w Londynie i Berlinie.
Mechanizm reakcji:
Reakcja rozpoczyna się atakiem jonu -OH i oderwaniem protonu z grupy -NH2, co prowadzi do utworzenia anionu I. Do tego anionu (w miejsce po protonie) przyłącza się kation bromkowy, po czym w identyczny sposób jak poprzednio następuje oderwanie drugiego protonu. Powstały anion II jest nietrwały, stabilizuje się poprzez odszczepienie anionu bromkowego i przegrupowanie (reszta R przechodzi z atomu C do N) do izocyjanianu.
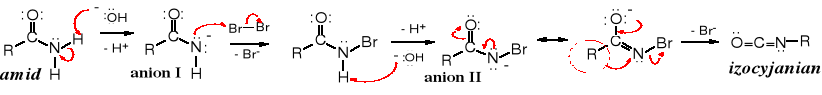
Izocyjanian w środowisku reakcji hydrolizuje do nietrwałego, podstawionego kwasu karbaminowego. który szybko samorzutnie rozpada się do aminy, wydzielając cząsteczkę CO2 .
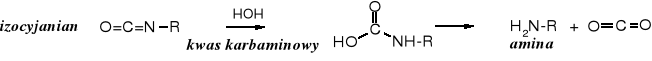
Przegrupowanie Hofmanna jest wykorzystywane w praktyce laboratoryjnej i przemysłowej do otrzymywania amin. Jako przykład może służyć produkcja fenterminy, preparatu obniżającego łaknienie. Struktura fenterminy przypomina amfetaminę, która też ma podobne działanie i dlatego wchodziła w skład niektórych środków na odchudzanie. Obecnie przyjmowanie amfetaminy w jest zabronione ze względu na jej narkotyczne właściwości.
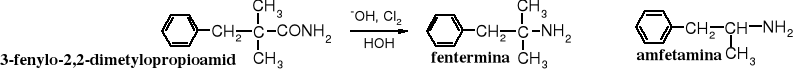
Z ftalimidu w reakcji przegrupowania Hofmanna powstaje kwas antranilowy.
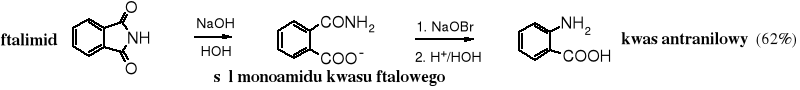
18.7.6 Reakcje ze związkami metaloorganicznymi
Amidy niepodstawione oraz monopodstawione zawierają ruchliwe (kwasowe) atomy wodoru, wobec czego ze związkami Grignarda i podobnymi odczynnikami reagują tak, jak kwasy, tzn. amidowy atom wodoru przyłącza się do reszt R' związku metaloorganicznego i powstaje węglowodór.
![]()
Amidy dipodstawione nie zawierają kwasowego atomu wodoru i w reakcjach ze związkami Grignarda zachowują się tak, jak inne reagenty z grupą karbonylową, tzn. zostają przekształcane w alkohole.
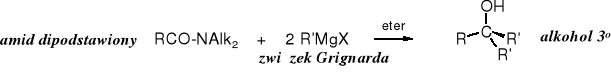
19. N I T R Y L E
Nitrylami, inaczej cyjankami alkilowymi lub arylowymi nazywane są pochodne kwasu cyjanowodorowego, w którym atom wodoru został zastąpiony resztą organiczną -R. Może być ona alkilem (cyjanki alkilu) lub arylem (cyjanki arylu).
![]()
Nitryle, chociaż tego na pierwszy rzut oka nie widać (brakuje grupy C=O) są pochodnymi kwasów karboksylowych, ponieważ w wyniku ich częściowej hydrolizy tworzą się amidy (niewątpliwe pochodne kwasowe), a ich całkowita hydroliza prowadzi do kwasów karboksylowych; dodatkowym dowodem jest reakcja odwadniania amidów - powstają w niej nitryle.
Hydroliza nitryli:
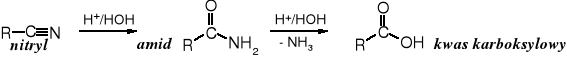
Nitryle można również hydrolizować w środowisku zasadowym.
Odwodnienie amidów:
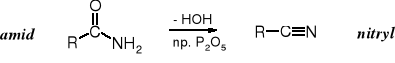
19.1 Budowa grupy cyjankowej (nitrylowej)
Atom węgla w grupie -C≡N ma hybrydyzację sp, wobec czego atomy tworzące to ugrupowanie są ułożone liniowo. Atom węgla połączony jest trzema wiązaniami z atomem znacznie bardziej elektroujemnym od siebie i z tego powodu ugrupowanie to, podobnie jak grupa karboksylowa jest silnie spolaryzowana, z ładunkiem dodatnim zlokalizowanym na atomie węgla. Oczywiście atomy tworzące ugrupowanie karboksylowe i nitrylowe różnią się hybrydyzacją.

19.2 Występowanie
Nitryle pomimo toksycznych właściwości są spotykane w przyrodzie. Grupa cyjankowa znajduje się między innymi w amigdalinie, w pierwszym, wyizolowanym naturalnym glikozydzie. Amigdalina występuje w gorzkich migdałach oraz w pestkach wielu owoców, takich jak śliwek, brzoskwiń, czereśni, wiśni, a nawet jabłek. Składa się z dicukru i nitrylu kwasu migdałowego. Całkowita hydroliza amigdaliny prowadzi do kwasu migdałowego, glukozy i cyjanowodoru. Znanych jest kilkanaście innych glikozydów zawierających ugrupowanie cyjanohydrynowe.
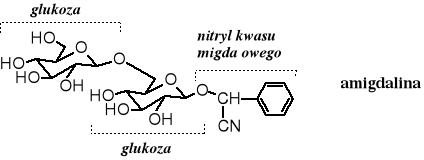
19.3 Nomenklatura
19.3.1 Systematyczna
Wg IUPAC nazwy systematyczne tej grupy związków tworzy się przez dodanie do rdzenia słowa nitryl i łącznika „o” nazwę węglowodoru macierzystego.
![]()
19.3.2 Wywodząca się z nazw kwasów hydroksylowych
Nitryle można również nazywać traktując je jako pochodne kwasów karboksylowych dodając do rdzenia nitryl nazwę acylu w formie przedrostka. Oba człony łączy się łącznikiem „o”
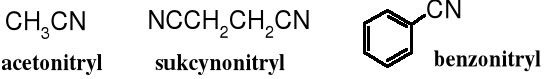
19.3.3 Przedrostkowa, za pomocą przedrostka karbonitryl
Inny sposób nazywania nitryli, też wywodzący się od kwasów, polega na dodaniu przyrostka karbonitryl do nazwy węglowodoru połączonego z grupą -CN. Jest to sposób szczególnie przydatny w przypadku tworzenia nazw związków zawierających kilka grup funkcyjnych.
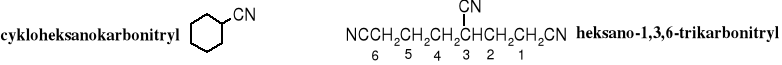
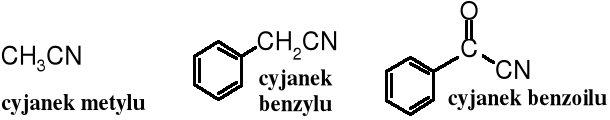
19.3.4 Grupowo-funkcyjna
Dla nitryli o ogólnym wzorze R-CN stosuje się często nomenklaturę grupowo-funkcyjną tworząc ich nazwę ze słów cyjanek + nazwę alkilu lub arylu (a nawet acylu), tzn. nazwę grupy R- przyłączonej do funkcji -CN.
19.3.5 Podstawnikowa
Grupa -CN jako podstawnik nosi nazwę cyjano.
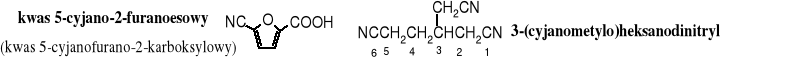
19.4 Otrzymywanie
19.4.1 Alkilowanie soli cyjanowodoru
Cyjanki można alkilować 1o halogenkami alkilowymi, estrami kwasów sulfonowych lub siarczanem alkilu. Reakcja biegnie wg mechanizmu SN2, a produktami są nitryle o ogólnym wzorze RCH2CN. Prowadzi się ją zwykle we wrzącym metanolu lub etanolu.
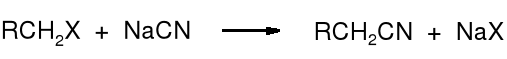
![]()

19.4.2 Dehydratacja amidów
Amidy niepodstawione pod wpływem odczynników silnie odwadniających, takich jak P2O5, SOCl2, POCl3 czy bezwodnik octowy ulegają dehydratacji. Reakcja biegnie w podwyższonej temperaturze. Do dehydratacji można też użyć DCC (dicykloheksylokarbodiimidu), który przekształca amidy w nitryle już w temperaturze pokojowej.
![]()
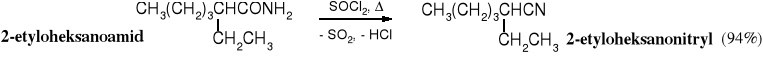
Dehydratacja amidów jest ogólną metodą otrzymywania nitryli, nie ogranicza się do nitryli typu RCH2CN, jak w przypadku alkilowania cyjanków.
Mechanizm
Reakcja z chlorkiem tionylu zaczyna się od utworzenia estru chlorosulfonylowego, po czym następują kolejne etapy eliminacji anionów, protonów i SO2.
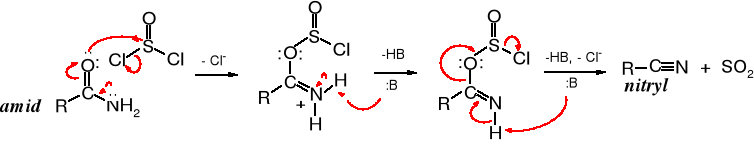
19.4.3 Addycja akrylonitrylu, cyjanoetylowanie
Akrylonitryl przyłącza się do związków zawierających uaktywnione atomy wodoru, np. do estrów malonowych, estrów acetylooctanowych i innych związków 1,3-dikarbonylowych. Jest to tzw. reakcja Michaela, w której akrylonitryl (propenonitryl) pełni rolę akceptora Michaela.

19.4.5 Reakcja Sandmayera
Sole diazoniowe związków aromatycznych reagują z cyjankiem potasu w obecności cyjanku miedzi (I) w wyniku, czego grupa -N≡N zostaje wymieniona na funkcję -C≡N, przy czym wydziela się cząsteczka azotu. Reakcja biegnie wg mechanizmu SET. Sól diazoniową przygotowuje się z odpowiedniej aminy bezpośrednio przed otrzymywaniem nitrylu.
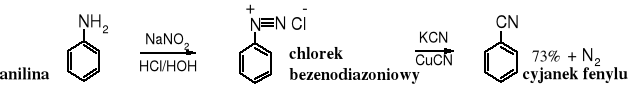
19.5 Właściwości fizyczne i fizjologiczne
Nitryl wywodzący się z kwasu mrówkowego - cyjanowodór - jest gazem; nie zalicza się on do związków organicznych. Acetonitryl wrze w 81oC, a propionitryl w 97oC. Są to stosunkowo wysokie temperatury wrzenia jak na związki o niskiej masie molowej. Podwyższenie temperatur wrzenia niskocząsteczkowych nitryli wynika z ich wysokiej polarności. Dzięki temu są też dobrze rozpuszczalne w wodzie. Acetonitryl miesza się z wodą w każdym stosunku, a rozpuszczalność propionitrylu w wodzie w 20oC sięga 10% (v/v). Acetonitryl jest powszechnie stosowanym rozpuszczalnikiem, np. jako składnik fazy ruchomej w RP-HPLC.
Nitryle są substancjami toksycznymi, znacznie jednak słabszymi od cyjanowodoru, przy czym propionitryl jest kilkadziesiąt razy bardziej trujący niż acetylonitryl (LD50 dla szczura doustnie wynosi odpowiednio 39 i 2460 mg/kg ciała).
19.6 Właściwości chemiczne
19.6.1 Hydroliza
Nitryle podobnie jak i inne pochodne kwasowe ulegają hydrolizie do kwasów karboksylowych (pośrednio do amidów). Reakcja jest katalizowana silnymi kwasami lub zasadami i wymaga podwyższonej temperatury.
![]()
Mechanizm
Kataliza kwasowa
Początkiem reakcji jest protonowanie atomu azotu, przez co atom węgla grupy nitrylowej staje się podatny na nukleofilowy atak cząsteczki wody. Następnie dochodzi do odszczepienia protonu i utworzenia nietrwałej hydroksyiminy, która w procesie tautomerii ulega przekształceniu w amid. Hydroliza amidu biegnie wg uprzednio poznanego schematu.
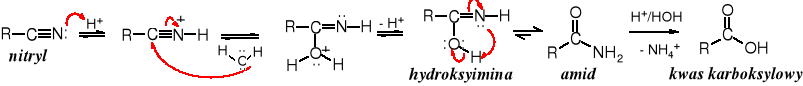
Kataliza zasadowa
Reakcję zapoczątkowuje nukleofilowy atak anionu hydroksylowego na nitrylowy atom węgla, po czym po przeniesieniu protonu z cząsteczki wody do atomu azotu tworzy się hydroksyimina, która przekształca się w tautomeryczny amid. Dalszym etapem jest hydroliza amidu do soli karboksylanowej, a z niej po zakwaszeniu powstaje kwas.
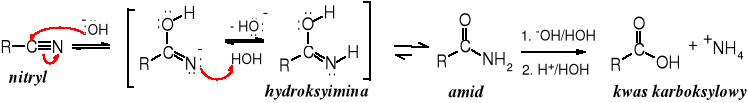
Hydroliza nitryli jest dobrą metodą otrzymywania kwasów karboksylowych, oczywiście nie tych, które poprzez amidy stanowiły substraty w syntezie nitryli. Synteza nowych kwasów polega na przeprowadzeniu halogenku alkilu w nitryl, a następnie jego hydrolizie do kwasu karboksylowego (zawierającego jeden atom węgla więcej niż wyjściowy halogenek); można też otrzymywać kwasy dikarboksylowe wychodząc z dihalogenku.
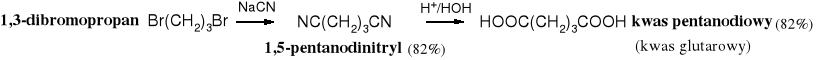
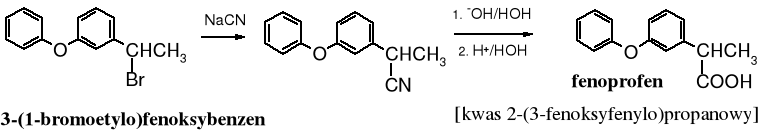
Nitryl stanowi produkt pośredni w produkcji fenoprofenu, leku o aktywności przeciwzapalnej i przeciwbólowej. Ma podobne działanie do ibuprofenu.
19.6.2 Redukcja
W wyniku redukcji nitryli, np. za pomocą tetrahydroglinianu litu otrzymuje się aminy pierwszorzędowe. Jest to bardzo wydajna i dogodna metoda otrzymywania amin, a substratami w niej mogą być zarówno kwasy karboksylowe (amidy), jak i halogenki alkilowe.
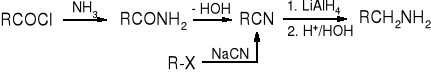
Ponieważ te same aminy powstają w reakcji bezpośredniej redukcji nitryli, jest to raczej metoda przekształcania halogenków alkilowych w aminy zawierające jeden atom węgla więcej niż związki wyjściowe. Substratami w tym sposobie syntezy amin mogą być także nitryle otrzymywane w reakcji Sandmeyera.

Nitryle można również redukować do aldehydów, wymaga to jednak stosowania mniej aktywnych wodorków; najczęściej używa się poznanego już wcześniej wodorku diizobutyloglinowego (DIBAH). Jest on rozbudowany przestrzennie, dlatego reakcja zatrzymuje się po addycji do grupy nitrylowej jednego anionu wodorkowego i dużej grupy organicznej.
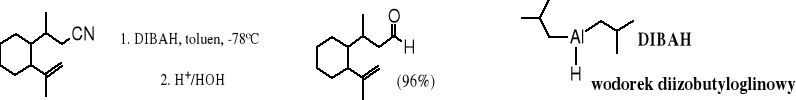
3-metylo-4-(2-izopropenylo 3-metylo-4-(2-izopropenylo-
cykloheksylo)butanonitryl cykloheksylo)butanal
W reakcjach z użyciem wodorków czynnikiem redukującym jest anion wodorkowy.
19.6.3 Reakcja z odczynnikami metaloorganicznymi
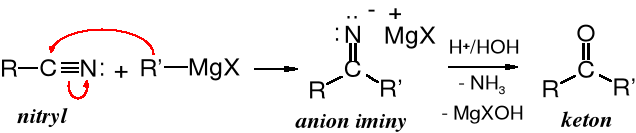
W reakcji nitryli ze związkami Grignarda reszta organiczna tego odczynnika przyłącza się do dodatnio naładowanego atomu węgla grupy nitrylowej, powstaje przejściowo anion iminy, z którego po hydrolizie tworzy się keton. W odróżnieniu od reakcji z estrami, bezwodnikami czy halogenkami kwasowymi addycja zatrzymuje się na etapie iminy, czyli po przyłączeniu jednego mola związku Grignarda na 1 mol nitrylu.
Mechanizm
Przykład: Z benzylonitrylu w reakcji z bromkiem etylomagnezowym powstaje propiofenon.
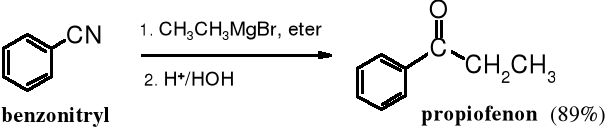
Delikatne zakwaszenie produktu addycji nitrylu do związku Grignarda (anionu iminy) umożliwia otrzymanie iminy.
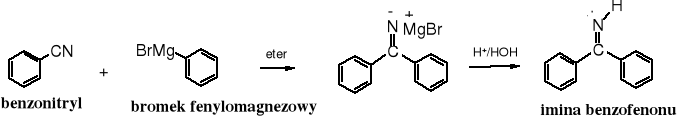
19.6.4 Reakcja Rittera
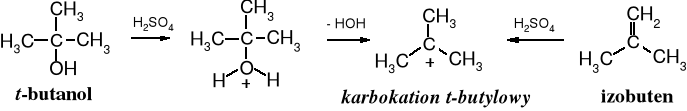
Alkohole 3o i alkeny tworzące stabilne karbokationy w reakcji z nitrylami zostają przekształcane w aminy. Jest to metoda otrzymywania 1o amin zawierających grupę -NH2 przy 3o atomie węgla, np. t-butyloaminy. Tego typu aminy trudno jest uzyskać na innej drodze.
W pierwszym etapie reakcji powstaje karbokation.
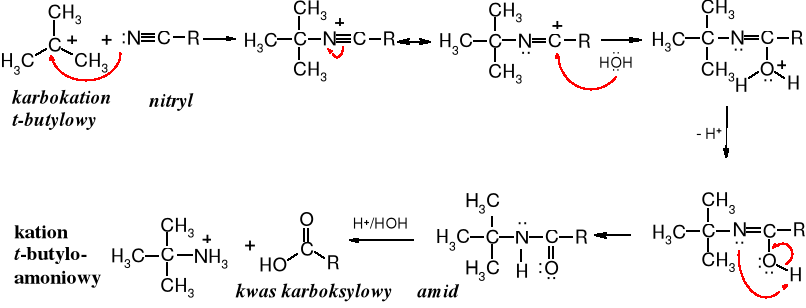
Karbokation reaguje z nitrylem, a produkt addycji po hydratacji i kolejnych etapach zostaje przekształcony w amid zawierający ugrupowanie t-butylowe; z niego po hydrolizie tworzy się t-butyloamina.
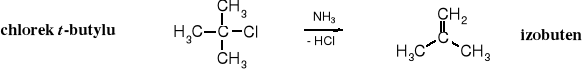
Jest to jeden z najlepszych sposobów otrzymywania t-butyloaminy, jako że aminoliza chlorku t-butylu zawodzi, ponieważ 3o halogenki alkilowe w środowisku zasadowym ulegają eliminacji do alkenów.
1
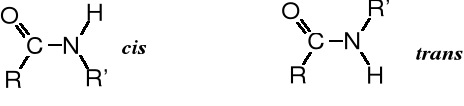

Wyszukiwarka
Podobne podstrony:
18 19
18,19,20
ściąga pytanie 1,2,5,6,8,18,19,25,28
18 19
siatkówka, 18,19-PS-Doskonalenie zagrywki rotacyjnej tenisowej, KONSPEKT LEKCJI: 10
06jfmt 18 19
18 19
18 (19)
dodawanie (16-17-18-19), matematyka
W -- Amidy i nitryle, podstawy chemii organicznej
excercise2, nader 16, 17, 18, 19
18 19 407 pol ed02 2005
page 18 19
Dom Nocy 09 Przeznaczona rozdział 18 19 TŁUMACZENIE OFICJALNE
18-19, wojtek studia, Automatyka, studia 2010, obrona inz, Pytania na obrone, brak tematu , dyplomo
18 19 307 POL ED02 2001
Ćwiczenie 18 & 19 Procesory Sygnalowe
Rys (5 18 i 5 19)
więcej podobnych podstron