POTENCJOMETRIA
Karol Fugas
Studia zaoczne gr 2b
Potencjometria- instrumentalna metoda analityczna, wykorzystująca zależność pomiędzy potencjałem odpowiedniego półogniwa a aktywnością jonów lub cząsteczek w roztworze, w warunkach bezprądowych. Rolę takiego półogniwa spełniają najczęściej elektrody jonoselektywne. W rzeczywistych pomiarach stosuje się ogniwo (układ) zbudowany z dwóch półogniw (elektrod) tj. elektrody porównawczej i elektrody wskaźnikowej.
Elektrody dzielimy na:
a) elektrody n-tego rodzaju (I, II i III)
b)elektrody redoks
c)elektrody jonoselektywne
Parametry elektrod jonoselektywnych:
-zakres pomiarowy i nachylenie krzywej kalibracyjnej- zakres pomiarowy odpowiada prostoliniowemu odcinkowi krzywej kalibracyjnej
-zakres użyteczny pH- potencjał elektrody jest niezależny od stężenia jonów wodorowych
-selektywność elektrod- potencjał elektrody zależy od aktywności jonu głównego, oraz od obecności innych jonów
-czas odpowiedzi elektrody- czas ustalenia się potencjału równowagowego
-czas życia elektrody- czas poprawnego działania
-oporność wewnętrzna elektrod- pozwala ocenić i przewidzieć trudności pomiarowe
ROZTWÓR I
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ROZTWÓR II
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ŚLEPA PRÓBA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wnioski
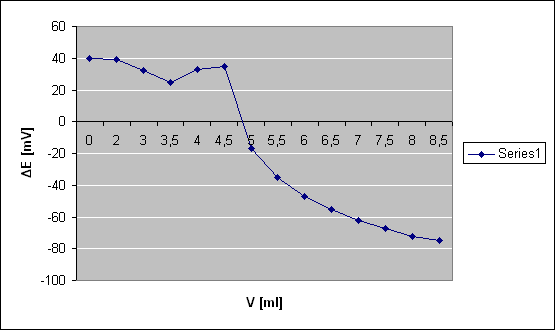
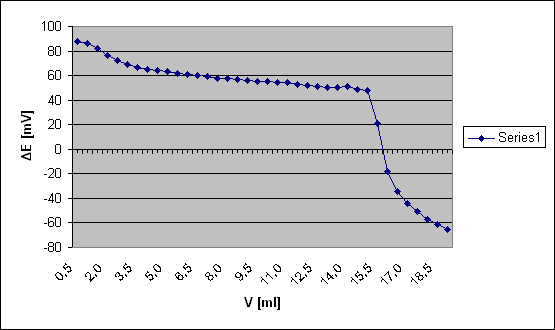
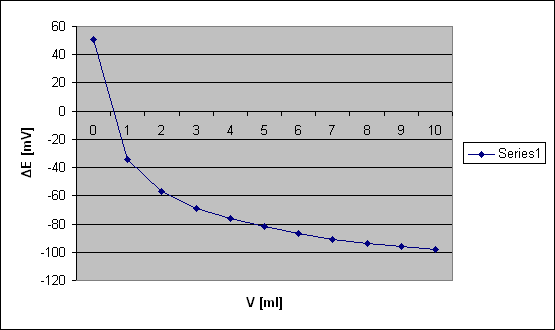
W roztworze w którym było 10ml roztworu wzorcowego Al3+ załamanie się krzywej nastąpiło dość szybko, bo przy V=5 [ml], podczas gdy przy roztworze wzorcowym równym 15ml załamanie nastąpiło dopiero przy V=15,5 [ml]. Z kolei przy ślepej próbie (bez roztworu wzorcowego) załamanie nastąpiło od razu po rozpoczęciu miareczkowanie, bo przy V=1 [ml].
Wyszukiwarka
Podobne podstrony:
potencjometria popr, analiza instrumentalna
PRZYGOTOWANIE PRBEK DO ANALIZY2, WIMiC, instrumentalne
SPEKTOFOTOMETRIA KLASYCZNA, WIMiC, instrumentalne
T I C ?NA Sem4 Optional Lab1 TSU Instructor1
Lab1 Instrukcja (2)
lab1 Instrukcja id 750240 Nieznany
INSTRUKCJE, lab1, Wykorzystanie interfejsu graficznego
Instrukcja Lab1(1)
Lab1 Instrukcja 4
Lab1 Instrukcja
Lab1 Instrukcja 2 id 258957 Nieznany
Sprawozdania z analizy instrumentalnej, MP, Miareczkowanie potencjometryczne
Lab1 instrukcja2010
sieci LAB1, Informatyka, Informatyka - UJK, Sieci komputerowe, Instrukcje
lab1 instrukcja
Instrukcja lab1
Potencjometria zad, Technologia chemiczna, 5 semestr, analiza instrumentalna, notatki
MANGAN I ŻELAZO-AZOTANY-POTENCJOMETRIA-HAŁAS-CHZT-SURFAKTANTY, ANALITYCZNE METODY INSTRUMENTALNE
więcej podobnych podstron