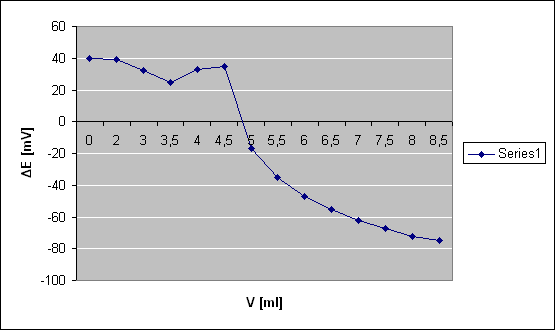
V [ml]
ΔΕ [mV]
ΔV
ΔΕ/ΔV
0
40
2
39
2
19,5
3
32
1
32
3,5
25
0,5
50
4
33
0,5
66
4,5
35
0,5
70
5
-17
0,5
-34
5,5
-35
0,5
-70
6
-47
0,5
-94
6,5
-55
0,5
-110
7
-62
0,5
-124
7,5
-67
0,5
-134
8
-72
0,5
-144
8,5
-75
0,5
-150
POTENCJOMETRIA
Karol Fugas
Studia zaoczne gr 2b
Potencjometria- instrumentalna metoda analityczna, wykorzystująca zależność pomiędzy potencjałem odpowiedniego półogniwa a aktywnością jonów lub cząsteczek w roztworze, w warunkach bezprądowych. Rolę takiego półogniwa spełniają najczęściej elektrody jonoselektywne. W rzeczywistych pomiarach stosuje się ogniwo (układ) zbudowany z dwóch półogniw (elektrod) tj. elektrody porównawczej i elektrody wskaźnikowej.
Elektrody dzielimy na:
a) elektrody n-tego rodzaju (I, II i III)
b)elektrody redoks
c)elektrody jonoselektywne
Parametry elektrod jonoselektywnych:
-zakres pomiarowy i nachylenie krzywej kalibracyjnej- zakres pomiarowy odpowiada prostoliniowemu odcinkowi krzywej kalibracyjnej
-zakres użyteczny pH- potencjał elektrody jest niezależny od stężenia jonów wodorowych
-selektywność elektrod- potencjał elektrody zależy od aktywności jonu głównego, oraz od obecności innych jonów
-czas odpowiedzi elektrody- czas ustalenia się potencjału równowagowego
-czas życia elektrody- czas poprawnego działania
-oporność wewnętrzna elektrod- pozwala ocenić i przewidzieć trudności pomiarowe
ROZTWÓR I
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ROZTWÓR II
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ŚLEPA PRÓBA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wnioski
W roztworze w którym było 10ml roztworu wzorcowego Al3+ załamanie się krzywej nastąpiło dość szybko, bo przy V=5 [ml], podczas gdy przy roztworze wzorcowym równym 15ml załamanie nastąpiło dopiero przy V=15,5 [ml]. Z kolei przy ślepej próbie (bez roztworu wzorcowego) załamanie nastąpiło od razu po rozpoczęciu miareczkowanie, bo przy V=1 [ml].