CZĘŚĆ 1
prawo zachowania masy i stałości składu,
wyprowadzanie wzorów chemicznych,
stężenie procentowe,
rozpuszczalność substancji,
masa molowa, cząsteczkowa,
obliczenia stechiometryczne,
skład procentowy związku chemicznego.
Objętość alkoholu wypełniającego termometr wynosi 0,5 cm3. O ile wzrosłaby masa tego termometru, gdyby wypełniono go rtęcią? Gęstość alkoholu wynosi 0,8 cm3, a gęstość rtęci 13,59 cm3.
Do wyprodukowania brązu, tzn. stopu miedzi i cyny, użyto 400 kg cyny i 1600 kg miedzi. Oblicz skład tego stopu w procentach masowych.
Mosiądz, tzn. stop miedzi z cynkiem i ołowiem, zawiera 15% masowych cynku i 2% ołowiu. Ile miedzi, cynku i ołowiu potrzeba do wyprodukowania 1 tony tego stopu?
Z 43,4 g tlenku rtęci (II) można otrzymać 2,24 dm3 tlenu. Ilość wydzielanego tlenu jest wprost proporcjonalna do ilości rozłożonego tlenku, np. z 86,8 g tlenku rtęci (II) można otrzymać 4,48 dm3 tlenu w tych samych warunkach. Z jakiej ilości tlenku rtęci można otrzymać:
1,12 dm3 tlenu,
1,6 g tlenu?
Gęstość tlenu wynosi 1,43 g/dm3.
Podczas całkowitego spalania pewnego związku chemicznego węgla z wodorem (węglowodorem) na jedną cząsteczkę tego związku przypada pięć dwuatomowych cząsteczek tlenu. W produktach reakcji na trzy cząsteczki dwutlenku węgla (tlenek węgla IV) przypadają cztery cząsteczki wody. Ustal wzór sumaryczny węglowodoru i zapisz równanie opisanej reakcji.
Oblicz x, y, z w następujących równaniach:
2 CxHy + 7 O2 → 4 CO2 + 6 H2O
Px + 6 Hy → 4 PH3
2 NyOx + 4 Hz → N2 + 4 H2O
CXHYOz + 6 O2 → 6 CO2 + 6 H2O
2 C2Hy + 5 O2 → 4 CxOz + 6 H2O
Stosunek masowy węgla do wodoru i do tlenu w związku chemicznym wynosi 12:2:16. Ustala wzór tego związku, jeśli masa cząsteczkowa wynosi 60u.
O ile jednostek masa cząsteczkowa O3 (ozonu) jest większa od masy cząsteczkowej H2O?
Ile razy masa atomowa siarki jest większa od masy atomowej tlenu?
Z ilu atomów składa się cząsteczka fosforu o masie cząsteczkowej 124u?
W cząsteczce jednego z tlenków azotu na 28u azotu przypada 48u tlenu. Ustal wzór tego tlenu i podaj jego nazwę.
Masa próbki pewnego metalu o objętości 20 cm3 wynosi 54 g. Oblicz masę beli o długości 5 m i przekroju 100 cm2 wykonanej z tego metalu.
Stop do lutowania zawiera 40% masowych ołowiu i 60% cyny. Ile cyny i ile ołowiu trzeba stopić i zmieszać, aby otrzymać 200 g tego stopu?
Tlen zmieszany z wodorem w stosunku objętościowym 1:2 nosi nazwę „mieszaniny piorunującej”. Oblicz masę 90 cm3 tej mieszaniny. Gęstość tlenu wynosi 1,43 g/dm3, a gęstość wodoru 0,0898 g/dm3.
Przyjmij, że powietrze zawiera około 20% objętościowych tlenu i 80% azotu i oblicz masę 100 dm3 powietrza oraz jego gęstość. Gęstość tlenu wynosi 1,43 g/dm3, a azotu 1,25 g/dm3.
W celu ustalenia wzoru sumarycznego tlenku żelaza przeprowadzono doświadczenie i stwierdzono, że w tym tlenku stosunku liczby atomów żelaza do liczby atomów tlenu wynosi 1:1,5. Ustal wzór sumaryczny tego tlenku.
W związku chemicznym NaxSyOz stosunek x:y=1:1, a x:z=2:3. Ustal wzór sumaryczny tego związku.
Oblicz wartości indeksów stechiometrycznych x:
N2Ox (masa cząsteczkowa 108u),
P2Ox (masa cząsteczkowa 110u),
C2Hx (masa cząsteczkowa 30u),
H4PxO7 (masa cząsteczkowa 178u).
Ile atomów wodoru i ile atomów tlenu wchodzi w skład czteroatomowej cząsteczki o masie cząsteczkowej 23u?
Oblicz skład procentowy tlenku siarki (wyrażonej w procentach masowych) w których stosunek masowy siarki do tlenu wynosi 2:3.
Stężenie procentowe nasyconego roztworu pewnej substancji w wodzie wynosi 20%. Oblicz rozpuszczalność tej substancji w wodzie w tych samych warunkach.
w celu ochrony przez korozją blachę żelazną pokrywa się obustronnie warstwą cynku. Oblicz zużycie cynku na 1 tonę żelaza przy produkcji takiej blachy przy założeniu, że grubość warstwy cynku wynosi 0,05 mm, a grubość blachy przed ocynkowaniem 1mm. Gęstość żelaza wynosi 7,86 g/cm3, a gęstość cynku 7,14 g/cm3.
Jakiej objętości pojemnik jest potrzebny do przewiezienia 5 ton rozdrobnionej siarki o gęstości 2 g/cm3.
Przyjmując, że samolot wykonany jest całkowicie z magnalu, stopu glinu z magnezem o gęstości 2,55 g/cm3, oblicz ile razy wzrosłaby jego masa, gdyby wykonany był z żelaza. Gęstość żelaza wynosi 7,86 g/cm3.
Mieszanina zawiera 50% objętościowych azotu i 50% objętościowych tlenu. Oblicz skład tej mieszaniny w procentach masowych. Gęstość azotu wynosi 1,25 g/dm3, a gęstość tlenu 1,43 g/dm3.
W związku chemicznym Al.xSiyOz stosunek x:z=1:2,5, a x:y=2:1. Ustał wzór sumaryczny tego związku chemicznego.
Z czteroatomowej cząsteczce fosforu powstaje w reakcji z tlenem cząsteczka tlenku złożona z czterech atomów fosforu i dziesięciu atomów tlenu. Zapisz równanie opisanej reakcji.
Ile procent masowych tlenu i ile siarki zawiera:
trójtlenek siarki (tlenek siarki VI),
dwutlenek siarki (tlenek siarki IV).
Oblicz skład procentowy (w procentach masowych) związku chemicznego zawierającego żelazo, węgiel i tlen w stosunku masowym 14:3:12.
Ile wody trzeba odparować z 300 g 5 - procentowego roztworu soli, aby otrzymać roztwór 15 - procentowy?
Spirytus salicylowy jest 2 - procentowym roztworem kwasu salicylowego w alkoholu.
Ile g alkoholu i ile g kwasu zawiera 100 g spirytusu salicylowego?
Jaka objętość alkoholu o gęstości 0,79 g/cm3 jest potrzebna do otrzymania 100 g spirytusu salicylowego?
Ile g i ile cm3 alkoholu oraz ile g kwasu zawiera 200 cm3 spirytusu salicylowego o gęstości 0,8 g/cm3?
Ile gramów octu 10 - procentowego i ile gramów wody potrzeba do przygotowania 500 g octu 8 - procentowego?
24,54 dm3 gazowego chlorowodoru, odmierzonego w temp. O0C i pod ciśnieniem 1013 hPa, rozpuszczono w wodzie o otrzymano 200 g 20% roztworu. Oblicz gęstość gazowego chlorowodoru.
Ile gramów cukru znajduje się w 82 g roztworu nasyconego w temp. 600 C, jeśli rozpuszczalność cukru w tej temp. Wynosi 310 g/100 g wody? Oblicz stężenie procentowe tego roztworu.
w roztworze na jedną cząsteczkę cukru przypada 171 cząsteczek wody. Oblicz stężenie procentowe tego roztworu, jeśli wiesz, że cukrem rozpuszczalnym w wodzie była sacharoza o wzorze C12H22O11.
Masa bransolety wynosi 115,8 g, a jej objętość 6 cm3. Wykorzystując powyższe dane ustal, czy bransoleta wykonana jest ze złota, czy z pozłacanego srebra. Gęstość złota wynosi 19,3 g/cm3.
Dla ilu uczniów wystarczyłoby tlenu, gdyby przebywali w klasie o wymiarach 10m

5 m
3 m przez 6 godzin, a klasa nie byłaby wietrzona i nie następowałaby wymiana gazów z otoczeniem? Człowiek zużywa 0,2 m3 tlenu w ciągu godziny. Przyjmij, że powietrze zawiera 20% objętości tlenu.
Siarkowodór, związek chemiczny siarki z wodorem, jest w zwykłych warunkach gazem o zapachu zgniłych jaj, a jego gęstość wynosi 1,54 g/dm3. Jest on silną trucizną. Natychmiastową śmierć, wskutek porażenia ośrodka oddechowego, można wywołać oddychaniem zanieczyszczonym powietrzem, zawierającym 0,1% objętościowych tego gazu. Ile gramów siarkowodoru znajduje się w 1 m3 takiego powietrza?
Cząsteczka związku chemicznego węgla, wodoru i tlenu zawiera 1 atom tlenu. W reakcji spalania tego związku na jedną jego cząsteczkę przypadają trzy dwuatomowe cząsteczki tlenu. W produktach spalania na dwie cząsteczki dwutlenku węgla przypadają trzy cząsteczki wody. Ustal wzór i zapisz równanie reakcji spalania tego związku.
Masa klucza żelaznego wynosi 24 g, a masa jednego atomu żelaza 9,3

10-23 g. Jaka długo należałoby liczyć atomy zawarte w tym kluczu z prędkością 10 atomów na sekundę?
O ile jest większa masa klucza o objętości 3 cm3 wykonanego z żelaza od masy klucza o takiej samej objętości zrobionego z duraluminium, tzn. stopu glinu z miedzią i krzemem o gęstości 2,8 g/cm3? Gęstość żelaza wynosi 7,86 g/cm3.
W butli stalowej o pojemności 40 dm3 pod ciśnieniem 150 atm. Znajduje się 5 kg wodoru. Jaką objętość zajęłaby ta ilość wodoru pod ciśnieniem normalnym w temperaturze 20˚C? Gęstość wodoru w tych warunkach wynosi 0,0898 g/dm3.
Masa powłoki balonu o objętości 500 m3 wraz z gondolą wynosi 150 kg. Jaka może być największa masa ładunku balonu wypełnionego wodorem, a jaka wypełnionego helem? Gęstość wodoru wynosi 0,0898 g/dm3, gęstość helu - 0,1787 g/dm3, gęstość powietrza - 1,29 g/dm3.
Do wyprodukowania 1 tony brązu glinowego, czyli stopu miedzi z glinem, zużyto 20 kg glinu. Oblicz w procentach masowych skład tego stopu.
Oblicz objętość balonu wypełnionego wodorem, którego masa byłaby równa masie balonu o objętości 50 m3 wypełnionego w tych samych warunkach helem. Gęstość wodoru wynosi 0,0898 g/dm3, a gęstość helu 0,1787 g/dm3.
Podczas spalania pewnego węglowodoru (związku chemicznego węgla z wodorem) na dwie cząsteczki tego związku przypada trzynaście dwuatomowych cząsteczek tlenu. W produktach reakcji na cztery cząsteczki dwutlenku węgla przypada pięć cząsteczek wody. Ustal wzór tego węglowodoru i zapisz równanie opisanej reakcji.
W jakim stosunku masowym reaguje węgiel z tlenem tworząc dwutlenek węgla?
Pewien związek chemiczny, o masie cząsteczkowej 180u, ogrzany rozpada się na węgiel i wodę. W produktach reakcji na jeden atom węgla przypada jedna cząsteczka wody. Ustal wzór tego związku chemicznego i zapisz równanie reakcji jego rozpadu.
Ile gramów soli trzeba rozpuścić w 200 g 2 - procentowego roztworu, by otrzymać roztwór 8 - procentowy?
Jaką objętość gazowego amoniaku o gęstości 0,76 g/dm3 należy rozpuścić w wodzie, aby otrzymać 500 g 10 - procentowy roztworu?
Po odparowaniu wody z 94 g roztworu nasyconego w temp. 200 C otrzymano 44 g saletry sodowej.
Oblicz stężenie procentowe nasyconego roztworu saletry w tej temp.
Oblicz rozpuszczalność saletry w wodzie w tej temp.
Cząsteczka pewnego związku chemicznego węgla, wodoru i tlenu zawiera 1 atom węgla. W reakcji spalania tego związku na jego dwie cząsteczki przypadają trzy dwuatomowe cząsteczki tlenu. W produktach reakcji na jedną cząsteczkę dwutlenku węgla przypadają dwie cząsteczki wody. Ustal wzór tego związku chemicznego i zapisz równanie opisanej reakcji.
Człowiek może wytrzymać przez 60 minut stężenie amoniaku w powietrzu wynoszące 200 - 350 mg/m3 bez poważnego zatrucia, ale z podrażnieniem gardła. Stężenie 1,2 g/m3 powoduje podrażnienie oczu. Wdychanie w ciągu 30 - 60 minut powierza zawierającego 1,5 - 2,7 g amoniaku w 1 m3 powietrza wywołuje śmierć. Stężenie amoniaku większe od 3,5 g/m3 powoduje bardzo szybką śmierć.
Na skutek awarii do zamkniętego pomieszczenia o wymiarach 20 m ![]()
12,5 m ![]()
4 m przeniknęło 5 m3 amoniaku, który w zwykłych warunkach jest gazem o gęstości 0,76 g/dm3. Które z zagrożeń wystąpiło w tym pomieszczeniu?
Średnica atomu żelaza wynosi 0,25 nanometra (1 nanometr = 10-9 m). Ile atomów żelaza należałoby ustawić w szeregu o długości 1 mm? Jak długo trwałoby ich ustawianie z szybkością 10 atomów na sekundę?
W pewnym związku chemicznym na 12 jednostek masowych węgla przypadają 64 jednostki masowe siarki. Ustal wzór tego związku chemicznego.
Jakie pierwiastki zaznaczono symbolem E w następujących związkach:
EO2 (masa cząsteczkowa 44u),
E2S3 (masa cząsteczkowa 208 u),
H2EO4 (masa cząsteczkowa 98u).
Zawartość tlenu w tlenku pewnego dwuwartościowego pierwiastka wynosi 53,33% masowych. Oblicz masę atomową pierwiastka. Który to pierwiastek? Zapisz równanie reakcji syntezy omawianego tlenku.
Ile gramów wody należy dodać do 100 g 30 - procentowego roztworu nadtlenku wodoru (perhydrolu), aby otrzymać 3 - procentowy roztwór tej substancji, tzw. wodę utlenioną?
Rozpuszczalność soli kuchennej w wodzie w temp. 100˚C wynosi około 40 g soli na 100 g wody. Oblicz stężenie procentowe nasyconego roztworu soli kuchennej w wodzie w temp. 100˚C.
Oblicz, ile cząsteczek wody przypada na jedną cząsteczkę glukozy w roztworze 50 - procentowym. Masa cząsteczkowa glukozy wynosi 180u.
Tlenek o wzorze N2O5 wprowadzono do wody w takiej ilości, że na jedną cząsteczkę N2O5 przypadały 64 cząsteczki wody. Oblicz stężenie procentowe otrzymanego roztworu kwasu azotowego (V).
Uzupełnij równania:
SO2 + ..... → H2SO3,
N2O5 + ..... → HNO3,
SO3 + ..... → H2SO4,
SO3 + ..... → H+ + SO42-.
Jaką objętość wody i jaką objętość 30 - procentowego kwasu solnego o gęstości 1,15 g/cm3 należy zmieszać, aby otrzymać 500 g 10 - procentowego roztworu?
Tlenki siarki (VI) zmieszano z wodą w takim stosunku, że na cząsteczkę tlenku przypadło 50 cząsteczek wody. Oblicz stężenie procentowe otrzymanego roztworu kwasu siarkowego (VI).
Ustal, jakie substancje kryją się pod literami A, B, C, D i E. Ułóż równania podanych reakcji chemicznych.
Oblicz, ile gramów wodorotlenku sodu należy rozpuścić w 100 g wody, aby otrzymać roztwór 20%?
Tlenek jednego jednowartościowego pierwiastka reaguje a wodą i daje związek, którego wodny roztwór barwi fenoloftaleinę na malinowo. Masa cząsteczkowa tego tlenku wynosi 62u. Podaj jego wzór i nazwę.
Oblicz objętość i masę tlenu zawartego w klasie o wymiarach 10 m

5 m
3 m. Przyjmij, że powietrze zawiera 20% objętościowych tlenu.
Jednym z gazów zanieczyszczających powietrze i wywołujących zjawisko tzw. kwaśnych deszczów jest tlenek siarki (IV). Jest on również niebezpieczny dla człowieka. Przykre objawy drapania w nosie i kaszlu powoduje oddychanie powietrzem zawierającym w 1 m3 58,6 mg tego gazu. Jaki procent objętości stanowi tlenek siarki (IV) w tym powietrzu? Gęstość tlenku siarki (IV) wynosi 2,93 g/dm3.
W reakcji redukcji pewnego tlenku miedzi wodorem otrzymuje się miedź i wodę w stosunku masowym 32:9. Napisz równanie omawianej reakcji.
W pewnym związku chemicznym, na 12 jednostek masowych węgla przypadają dwie jednostki masowe wodoru i 16 jednostek masowych tlenu. Ustal wzór tego związku chemicznego, jeżeli jego masa cząsteczkowa wynosi 180u.
Ile gramów soli trzeba rozpuścić w 200 g wody, aby otrzymać roztwór 10%?
Ile gramów 10 - procentowego roztworu soli i ile gramów 50 - procentowego roztworu soli należy zmieszać, aby otrzymać 1000 g 40 - procentowego roztworu?
Po zmieszaniu glukozy (C6H12O6) z wodą otrzymano roztwór 25 - procentowy. Oblicz, ile cząsteczek wody przypada na jedną cząsteczkę glukozy w tym roztworze.
W 10 - procentowym roztworze substancji X w wodzie stosunek liczby cząsteczek substancji rozpuszczonej do liczby cząsteczek rozpuszczalnika wynosi 4:73. Oblicz masę cząsteczkową substancji X.
Rozpuszczono w wodzie tyle chlorowodoru, że na 9 cząsteczek tego związku przypadały 73 cząsteczki wody. Oblicz stężenie procentowe otrzymanego kwasu solnego.
Uzupełnij równania reakcji chemicznej:
..... + H2O → Ca(OH)2,
BaO + H2O → .....,
CaO + ..... → Ca2+ + OH-,
..... + H2O → Ba2+ + OH-,
..... + ..... → Sr(OH)2,
SrO + H2O → ..... + ..... .
W reakcji redukcji pewien tlenek miedzi reaguje z wodorem w stosunku masowym 72:1. Ustal, który to tlenek, napisz równanie omawianej reakcji.
Ile gramów 40 - procentowego roztworu kwasu należy dodać do 150 g 10 - procentowego roztworu tego kwasu, aby otrzymać roztwór 20 - procentowy?
Po odparowaniu do sucha 50 g nasyconego e temp. 10˚C wodnego roztworu saletry sodowej otrzymano 22,3 g tej substancji chemicznej. Oblicz rozpuszczalność saletry sodowej w wodzie w tej temperaturze.
Odczytaj z wykresu zależności rozpuszczalności saletry potasowej od temperatury, jaka jest rozpuszczalność tego związku chemicznego w wodzie w temp. 20˚C i w temp. 65˚C. Oblicz, ile gramów saletry potasowej można rozpuścić w 200 g wody w temp. 20˚C, a ile w temp. 65˚C.
Odczytaj z wykresu, jaka jest rozpuszczalność saletry potasowej w temp. 5˚C i 80˚C. Następnie oblicz, ile gramów saletry wykrystalizuje po oziębieniu do temp. 5˚C 540 g jej roztworu nasyconego w temp. 80˚C.
Ile gramów saletry potasowej należy dodać do 240 g roztworu nasyconego w temp. 5˚C, aby roztwór był nasycony po ogrzaniu do temp. 80˚C?
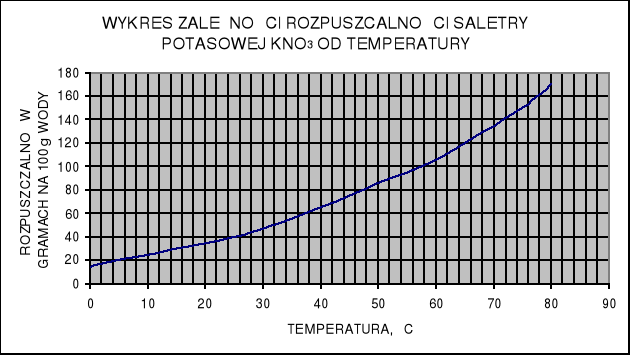
Posługując się wykresem rozpuszczalności saletry potasowej, oblicz ile wody należy dodać do 620 g roztworu saletry, nasyconego w temp. 35˚C, aby po oziębieniu do temp. 10˚C był nasycony, a cała ilość saletry znajdowała się w roztworze.
WYKRES ZALEŻNOŚCI ROZPUSZCZALNOŚCI SALETRY POTASOWEJ KNO3 OD TEMPERATURY
Ile cząstek wody przypada na jedną cząsteczkę dwutlenku węgla w roztworze 1 - procentowym?
Uzupełnij równania:
..... + ..... → H+ + PO43-,
..... + H2O → H3PO4,
H2CO3 → CO2 + ..... ,
..... + H2O → H+ + Cr O42-.
W 10 - procentowym roztworze kwasu na jedną cząsteczkę tego kwasu przypada 31 cząsteczek wody. Oblicz masę cząsteczkową tego kwasu.
Do wody wprowadzono tyle sodu, że na jeden atom tego metalu przypadało 21 cząsteczek wody. Oblicz stężenie procentowe powstałego po reakcji roztworu wodorotlenku sodu.
Jaka objętość 20% roztworu wodorotlenku sodu o gęstości 1,22 g/cm3 zawiera 10 g substancji rozpuszczonej?
Ile gramów roztworu 20% i ile gramów roztworu 60% należy zmieszać, aby otrzymać 500 g roztworu 30%?
Ustal, jakie substancje kryją się pod literami A, B, C, D, E, F i G wiedząc, że substancja B jest gazem o ostrej woni zepsutych jaj, którego roztwór wodny ma odczyn kwaśny, podobnie jak odczyn roztworu substancji G. Ułóż równania reakcji zaznaczonych na chemografie.
W 380 g wody rozpuszczono 20 g kwasu siarkowego (VI). Oblicz stężenie procentowe otrzymanego roztworu.
W reakcji redukcji pewnego tlenku żelaza wodorem otrzymuje się żelazo i wodę w stosunku masowym 56:27. Ustal wzór tego tlenku. Napisz równanie tej reakcji.
Ile gramów i ile cm3 dwutlenku węgla zawiera 1 dm3 wody mineralnej „Kryniczanka”? Jej gęstość wynosi około 1 g/cm3 i zawiera ona 0,66% masowych dwutlenku węgla. Gęstość dwutlenku węgla wynosi 1,96 g/dm3.
Samooczyszczenie powietrza może zachodzić m. in., w atmosferze, wskutek reakcji chemicznych między substancjami, których produkty nie są toksyczne. Uzupełnij równania reakcji tego typu. Produktami są gazy, składniki czystego powietrza oraz pierwiastek chemiczny, ciało stałe barwy żółtej.
H2S + SO2 → ..... + ..... ,
NO + CO → ….. + ….. ,
NO2 + CO → ..... + ..... ,
CO + O2 → ..... .
Do tlenku o wzorze P4O10 dodano tyle wody, że na jedną cząsteczkę tego tlenku przypadły 62 cząsteczki wody. Oblicz stężenie procentowe otrzymanego roztworu kwasu fosforowego (V).
Oblicz stężenie procentowe roztworu kwasu siarkowego (VI) o gęstości 1,2 g/cm3, który w 100 cm3 zawiera 33,6 g kwasu.
Oblicz, ile cm3 wody należy dodać do 1 g wodorotlenku wapnia, aby otrzymać 0,15 - procentowy roztwór wodny tego związku (wodę wapienną).
Zmieszano roztwór wodorotlenku potasu z kwasem solnym w takim stosunku, że na jeden jon potasu przypadały dwa jony chlorkowe. Jaki jest odczyn powstałej mieszaniny?
Związek chemiczny o masie cząsteczkowej 200u zawiera 20% wapnia i 80% bromu. Ustal wzór tego związku chemicznego i podaj jego nazwę.
Roztwór kwasu azotowego (V), w którym na jeden jon azotanowy (V) przypadało 40 cząsteczek wody, zobojętniono wodorotlenkiem wapnia. Podaj nazwę otrzymanej soli i oblicz stężenie jej roztworu.
W jednym dm3 roztworu kwasu siarkowego (VI) jest tyle samo jonów siarczanowych (VI), ile jonów potasowych jest w 1 dm3 roztworu wodorotlenku potasu. W jakim stosunku objętościowym należy zmieszać te roztwory, aby otrzymać roztwór obojętny?
Rozwiąż chemigraf. Małymi literami oznaczono: azot, fosfor, siarkę, tlen i wodór, a dużymi literami związki chemiczne. Ustal symbole i wzory oznaczone małymi i dużymi literami. Ułóż równania reakcji.
Pierwiastek E tworzy kwas o wzorze ogólnym H2EOx i masie cząsteczkowej 62u, w którym stosunek masowy tlenu do wodoru wynosi 24:1. Ustal wzór kwasu.
W roztworze kwasu siarkowego (VI) na jeden jon wodorowy przypada 7 cząsteczek wody. Jakie jest stężenie procentowe roztworu tego kwasu?
Do zobojętnienia 80 g wodorotlenku sodu potrzeba 98 g kwasu siarkowego (VI). Ile gramów i ile cm3 20 - procentowego roztworu kwasu o gęstości 1,14 g/cm3 potrzeba do zobojętnienia 40 g wodorotlenku sodu?
W roztworze wykryto następujące jony: Fe3+, Na+, Mg2+, NH4+, Al3+, H+, Cl-, NO3-, SO42-. Jakie substancje (podaj wzory i nazwy) mogły być rozpuszczone w wodzie w celu uzyskania tego roztworu? Podaj możliwe warianty.
W 1 dm3 roztworu kwasu siarkowego (VI) jest dwa razy więcej jonów wodorowych niż jonów wodorotlenowych w 1 dm3 roztworu wodorotlenku sodu. W jakim stosunku objętościowym należy zmieszać te roztwory, aby otrzymać roztwór obojętny?
W wodzie wapiennej na jeden jon wodorotlenkowy przypada 1200 cząsteczek wody. Oblicz stężenie procentowe wodorotlenku wapnia w wodzie wapiennej.
Tlenek pewnego pięciowartościowego pierwiastka E w wyniku reakcji z wodą daje kwas o wzorze ogólnym HEOx i o masie cząsteczkowej 63u. Ułóż równanie reakcji tego tlenku z wodą.
Tlenek sodu zmieszano z wodą w takim stosunku, że na jedną cząsteczkę tego tlenku przypadało 41 cząsteczek wody. Oblicz stężenie procentowe powstałego wodorotlenku sodu.
Zmieszano 217,1 g roztworu wodorotlenku baru i 109,8 g roztworu kwasu siarkowego (VI). Substancje przereagowały całkowicie. Powstały osad odsączono, jego masa wynosiła 23,3 g. Oblicz masę wody w przesączu.
Podczas rozkładu siarczanu (IV) sodu otrzymano 62 g tlenku sodu i 64 g tlenku siarki (IV). Oblicz stosunek masowy sodu do siarki i do tlenu w siarczanie (IV) sodu wiedząc, że w tlenku sodu stosunek masowy sodu do tlenu wynosi 23:8, a w tlenku siarki (IV) stosunek masowy siarki do tlenu wynosi 1:1.
Do kwasu solnego, w którym na jeden jon wodorowy przypadają 374 cząsteczki wody, dodano tyle cynku, że metal i kwas przereagowały całkowicie. Oblicz stężenie procentowe powstałego roztworu soli.
Z 10 g czystego węglanu wapnia, w reakcji z kwasem solnym można otrzymać 2,24 dm3 dwutlenku węgla. Z 11 g wapienia w reakcji z kwasem solnym uzyskano 2,24 dm3 dwutlenku węgla. Ile procent masowych czystego węglanu wapnia zawierał badany wapień?
Ile fosforu w przeliczeniu na zawartość w procentach masowych P2O5 zawiera nawóz fosforowy, tzw. percypitat - CaHPO4·2H2O?
Ustal, jakie substancje oznaczono w chemigrafie literami. Ułóż pełne równania podanych reakcji.
Podczas suczej destylacji 2 ton węgla kamiennego, zawierającego około 85% masowych pierwiastka węgla, otrzymano 1,6 tony koksu, który zawiera 95% masowych pierwiastka węgla. Ile węgla wystąpiło w związkach będących składnikami pozostałych produktów procesu suchej destylacji, w gazie węglowym, smole węglowej i wodzie pogazowej?
Ile cząsteczek wody trzeba dodać na każdy jon miedzi do krystalicznego siarczanu (VI) miedzi (II) - CuSO4·5H2O, aby otrzymać 10 - procentowy roztwór siarczanu (VI) miedzi (II)?
W miejsce kropek wpisz wzory odpowiednich substancji. Napisz równania reakcji.
Toksyczność związku baru rośnie wraz u ich rozpuszczalnością w wodzie. Praktycznie nierozpuszczalny siarczan (Vi) baru nie jest toksyczny. Dobrze rozpuszczalne sole baru, np. chlorek i azotan (V) są silnymi truciznami. Dlaczego węglan baru, mimo jego słabej rozpuszczalności w wodzie, jest silną trucizną? Zatrucie solami baru następuje najczęściej drogą pokarmową.
Oblicz masę 6 moli azotu cząsteczkowego.
Obliczyć, jaką liczbę moli stanowi 14,8 g wodorotlenku wapnia.
Oblicz, ile gramów glinu znajduje się w 3,06 g tlenku glinu.
Oblicz, w ilu gramach wody znajduje się 6 g wodoru.
Oblicz, w ilu molach kwasu siarkowego (VI) znajduje się 32 g tlenu.
Oblicz, jaką liczbę moli stanowi:
3,2 g tlenu cząsteczkowego,
144 g węgla,
6,4 g miedzi.
Oblicz masę:
3 moli siarki,
0,1 mola chlorku sodu,
0,5 mola magnezu,
0,2 mola wodoru cząsteczkowego.
Ile moli wapnia i ile moli chloru zawierają 3 mole chlorku wapnia?
Ile moli glinu i ile moli siarki zawiera 0,6 mola siarczku glinu?
Obliczyć, ile gramów węgla znajduje się w 220 g dwutlenku węgla.
Obliczyć, w ilu gramach tlenku siarki (VI) znajduje się 0,16 g tlenu.
Obliczyć, ile gramów sodu znajduje się w 0,4 mola tlenku sodu.
Obliczyć, ile gramów fosforu znajduje się w 6 molach kwasu fosforowego (V).
Obliczyć, w ilu molach wodorotlenku baru znajduje się 27,4 g baru.
Obliczyć, w ilu molach tlenku ołowiu (IV) znajduje się 160 g tlenu.
Ile moli atomów wodoru znajduje się w 19,6 g kwasu siarkowego (VI)?
Ile moli siarki znajduje się w 75 g siarczku glinu?
Oblicz masę mieszaniny zawierającej 1 mol tlenu cząsteczkowego i 4 mole azotu cząsteczkowego. Jaki jest stosunek masowy składników tej mieszaniny?
Obliczyć stosunek molowy składników mieszaniny zawierającej 4 g wodoru i 32 g tlenu.
Obliczyć stosunek molowy składników mieszaniny zawierającej 1,12 g żelaza i 0,32 g siarki.
Czy 1 g tlenku żelaza (II) zawiera tyle samo żelaza, co 1 g tlenku żelaza?
Czy 0,5 mola dwutlenku węgla jest więcej węgla niż w 12 g tlenku węgla (II)?
W ilu gramach tlenku sodu znajduje się taka sama ilość sodu, co w 20 g wodorotlenku sodu?
W ilu molach tlenku węgla (IV) znajduje się tyle samo tlenu, co w 14 g tlenku węgla (II)?
W ilu gramach tlenku sodu zawarta jest taka sama liczba moli atomów tlenu jaka znajduje się w 18,8 g tlenku potasu?
W ilu molach tlenku azotu (III) zawarta jest taka sama liczba moli atomów tlenu jaka zawarta jest w 6 molach tlenku azotu (V)?
W zamian za pewną przysługę bogaty maharadża pozwolił wybrać swemu słudze pomiędzy 1 kg złota, a ilością złota, jaką można otrzymać z 2 kg chlorku złota (III). Co powinien wybrać ten człowiek chcą otrzymać możliwie najwięcej złota?
Oblicz skład procentowy węglanu wapnia wiedząc, że stosunek masowy wapnia do węgla i do tlenu wynosi 10:3:12.
Minerał zawiera 90% siarczku żelaza (II). Obliczyć, w jakiej ilości tego minerału będzie zawarte 21 g żelaza.
Mieszanina zawiera FeO i Fe2O3 w stosunku masowym 1:1. Ile procent żelaza zawiera ta mieszanina?
Obliczyć masową zawartość procentową siarki w mieszaninie zawierającej FeS i Fe2S3:
w stosunku masowym 1:3,
w stosunku molowym 1:3.
Badając skład powietrza, przykryto ogrzewane opiłki żelaza dwulitrowym kloszem, Obliczyć, o ile w przybliżeniu zwiększył się ciężar opiłek. 1 dm3 tlenu waży 1,43 g.
W wyniku redukcji tlenku miedzi (II) wodorem otrzymano 0,9 g wody i 3,2 g miedzi. Oblicz:
ile tlenku miedzi uległo redukcji,
ile wodoru wzięło udział w tej reakcji.
Ile gramów wody powstało przy wybuchu mieszaniny 2 g wodoru i 12 g tlenu?
Ile siarczku żelaza (II) powinno się otrzymać, jeśli użyje się do reakcji 4 g siarki i 14 g żelaza? Jaka ilość żelaza nie weźmie udziału w reakcji?
Podczas analizy tlenku rtęci (II) otrzymano 12,5 g rtęci i 1 g tlenu. Podaj wzór cząsteczki tlenku rtęci (II).
Oblicz, w jakim stosunku masowym łączy się ołów z tlenem w PbO.
Oblicz skład procentowy tlenku glinu. (Wyrażony w procentach masowych).
Ile gramów chloru zawiera 1 kg chlorku sodu i 1 kg chlorku potasu?
W jakiej ilości tlenku żelaza (II) zawarte jest 2,8 g żelaza?
Ile tlenu należy użyć do spalania 2 g siarki?
W jakim stosunku masowym łączy się węgiel z tlenem w CO2 i CO?
Ile krzemu zawarte jest w 1 tonie piasku zawierającego 90% krzemionki?
Oblicz ilość chloru i wodoru konieczne do otrzymania 1 tony 37% roztworu kwasu solnego.
Ile kwasu azotowego (V) 60% i ile wody należy użyć do przyrządzenia 100 g roztworu 10%?
Oblicz masowy skład procentowy azotanu (V) wapnia.
Ile gramów tlenku rtęci (II), należy podać analizie, aby otrzymać 8 g tlenu?
Ile gramów wodorotlenku sodu znajduje się w 50 cm3 20% roztworu tej zasady, jeśli jego gęstość wynosi 1,22 g/cm3?
Jakie jest stężenie procentowe roztworu zasady potasowej, jeśli na 1 kation potasu przypada 108 cząsteczek wody?
W roztworze wodorotlenku wapnia na 1 jon wapnia przypada 312 cząsteczek wody. Oblicz stężenie procentowe wody.
W cząsteczce jednego z tlenków azotu na 28u azotu przypada 80u tlenu. Jaki jest wzór tego tlenu?
Na jak długo wystarczy tlenu w klasie w wymiarach 10 m

6 m
3 m, w której uczy się 30 uczniów? Człowiek zużywa 0,2 m2 tlenu w ciągu godziny.
Masa cząsteczkowa siedmioatomowej cząsteczki tlenku pewnego niemetalu wynosi 108u. Łączna masa zawartego w niej tlenu wynosi 80u. Ustal wzór sumaryczny tego tlenku.
Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 40u. Ustal masę atomową metalu i jego nazwę.
Jakie jest stężenie procentowe roztworu cukru zwanego glukozą, o wzorze C6H12O6, w którym na jedną cząsteczkę cukru przypada 20 cząsteczek wody?
Ile gramów wody należy odparować z 220 g 15% roztworu saletry potasowej, aby otrzymać roztwór 30%?
Rozwiąż chemigraf i wykonaj polecenie:
ustal, jakie substancje kryją się pod literami: X, Y, Z, W, U,
określ wartościowość siarki w związkach Z i Y,
ułóż równania reakcji podanych w chemigrafie.
W 10% roztworze pewnego kwasu jednowodorowego na 2 kationy wodorowe przypadały 63 cząsteczki wody. Ustal masę cząsteczkową tego kwasu i podaj jego nazwę.
10 g tlenku rtęci (II) umieszczono w otwartej probówce i ogrzewano palnikiem. Ogrzewanie przerwano przed zakończeniem reakcji i stwierdzono, że masa substancji w probówce wynosi 9,5 g. Obliczyć, ile gramów tlenku rtęci (II) uległo rozkładowi.
Ze 150 kg solanki odparowano 60 kg wody i otrzymano roztwór o zawartości 5% soli. Oblicz procent zawartości soli w roztworze przed odparowaniem.
Do roztworu wodnego soli kuchennej o stężeniu 10% dodano 0,5 kg soli i otrzymano roztwór o stężeniu 15%. Ile w tym roztworze będzie kilogramów soli, a ile kilogramów wody?
Na podstawie składu elementarnego wyprowadzić wzory substancji:
68,4% Cr i 31,6% O,
52% Cr i 48% O,
43,4% Na, 11,3% C i 45,3% O.
Pewna substancja zawiera, w przeliczeniu na tlenki 40% MgO i 60% SiO2. Wyprowadzić wzór elementarny substancji.
Stosunek masowy pierwiastków w glukozie jest następujący: C:H:O = 6:1:8. Masa cząsteczkowa glukozy wynosi 180u. Wyznaczyć jej wzór.
Ile procent tlenku wapnia CaO znajduje się w węglanie wapnia CaCO3?
Dane są: fosfor, tlenek miedzi (II), azotan (V) baru, tlen, woda, kwas siarkowy (VI), wodorotlenek sodu. Należy otrzymać: kwas fosforowy (V), wodorotlenek miedzi (II), kwas azotowy (V), siarczan (VI) miedzi (II), fosforan (V) sodu, azotan (V) miedzi (II). Napisz równania odpowiednich reakcji.
Złotnik, aby zbadać, czy korona ważąca 7,465 kg została wykonana z czystego złota, bez domieszki srebra, zanurzył ją do wody. Okazało się, że straciła ona pozornie na wadze 467 g. (Złoto traci w wodzie pozornie na wadze 0,052 swego ciężaru, a srebro 0,095). Oblicz, ile srebra, a ile złota było w tej koronie.
W magazynie przedsiębiorstwa znajduje się złom żelazny zawierający 2% krzemu i surówka zawierająca 6% krzemu. Zgodnie z wymaganiami technicznymi należy przygotować 100 kg mieszanki zawierającej średnio 3,2% krzemu. Ile należy wziąć złomu, a ile surówki?
Jeden zbiornik zawiera roztwór spirytusu i wody w stosunku 2:3, drugi w stosunku 3:7. Ile kilogramów roztworu należy wziąć z każdego zbiornika, aby otrzymać 12 kg roztworu, w którym stosunek masowy spirytusu do wody wynosi 3:5?
W jakim stosunku masowym należy zmieszać 12,5 i 30 - procentowe roztwory, aby otrzymać 2 kg 20 - procentowego roztworu?
Ile gramów 35 - procentowego roztworu należy dodać do 300 g 10% roztworu, aby otrzymać 17 - procentowy roztwór?
Zmieszano 120 g 15% roztworu kwasu solnego i 60 g 18% roztworu tego kwasu. Obliczyć stężenie procentowe otrzymanego roztworu.
Złotnik miał dwa stopy złota ze srebrem. W pierwszym stopie stosunek masy złota do srebra wynosił 2:3, a drugi 3:7. ile musi wziąć każdego z tych stopów, aby otrzymać 8 kg nowego stopu, w którym stosunek masy złota do masy srebra wynosiłby 5:11?
Obliczyć, ile gramów azotanu (V) potasu wykrystalizuje, jeśli 500 g nasyconego w temp. 333 K roztworu ochłodzimy do 293 K.
Rozpuszczalność w 333 K = 108 g/100 g H2O.
Rozpuszczalność w 293 K = 33 g/100 g H2O.
Obliczyć rozpuszczalność, jeżeli stężenie nasyconego roztworu wynosi 10%.
Obliczyć stężenie procentowe nasyconego roztworu, jeśli rozpuszczalność wynosi 20 g.
Stopiono dwie bryłki złota próby 0,840 i 0,750 i w ten sposób otrzymano bryłkę stopu o masie 3,762 kg z zawartością 752,4 g miedzi. Ile ważyła każda bryłka?
Jubiler ma 2 kawałki stopu złota. W jednym jest 48 g złota i 2 g miedzi, w drugim 36 g złota i 60 g miedzi. Ile trzeba wziąć z każdego kawałka stopu, aby otrzymać 39 g złota próby 0,750?
Napisz równania reakcji, za pomocą których można dokonać następujących przemian:
CZĘŚĆ 2
zakres materiału części 1,
objętość molowa,
węglowodory.
Ułóż podane jony zgodnie ze wzrastającą liczbą zawartych w nich elektronów:
24 Cr3+, 53 I-, 30 Zn2+, 37 Rb+, 26 Fe3+, 17 Cl-, 31 Ga3+.
Jaki kation powstaje na skutek oddania trzech elektronów przez atom i zawiera tyle samo elektronów co anion fluoru?
W wyniku przyłączenia 2 atomów bromu do cząsteczki węglowodoru, która zawiera 4 atomy węgla, masa powstałego związku zwiększyła się o 285,7% w stosunku do masy związku wyjściowego. Jaki jest wzór cząsteczki tego węglowodoru?
Roztwór kwasu siarkowego (VI), w którym na 1 jon siarczanowy (VI) przypadało 35 cząsteczek wody, zobojętniono roztworem zasady sodowej, w którym na 1 jon przypadało 17 cząsteczek wody. Oblicz stężenie procentowe powstałego roztworu soli.
Jaka jest masa cząsteczkowa kwasu, który w reakcji z tlenem sodu daje sól o masie cząsteczkowej 164u, a w reakcji z wodorotlenkiem magnezu - sól o masie cząsteczkowej 262u?
Oblicz, jaki jest skład procentowy (masowy) amalgamatu sodu (stop sodu z rtęcią), jeśli wiadomo, że po wprowadzeniu do wody 18,4 g amalgamatu otrzymano gaz, który w warunkach normalnych zajął objętość 2,24 dm3.
Gazowy produkt spalania węglowodoru wprowadzono do wody wapiennej. Strącony osad wysuszono i zważono. Masa otrzymanego osadu wyniosła 25 g. Stosunek masowy węgla i wodoru w tym węglowodorze wynosi 9:2. Oblicz, ile gramów węglowodoru spalono.
Do 0,15 g wapienia dodano 0,03 dm3 kwasu solnego, zawierającego 1 mol chlorowodoru w 1 dm3. Otrzymano 0,028 dm3 dwutlenku węgla odmierzonego w warunkach normalnych. Czy użyta ilość kwasu jest wystarczająca do całkowitego rozpuszczenia wapienia niezależnie od jego składu? Ile procent czystego węglanu wapnia zawiera badany wapień?
W cząsteczce węglowodoru na jeden atom węgla przypadają dwa atomy wodoru, a jego masa cząsteczkowa wynosi 42u. Ustal wzór sumaryczny i strukturalny tego węglowodoru.
Eten i acetylen po przyłączeniu wodoru przechodzą w etan. W reakcji mieszaniny etenu i acetylenu z wodorem na 3 cząsteczki powstałego etanu przypadały 4 cząsteczki przyłączonego wodoru. Jaki był stosunek liczby cząsteczek etenu do liczby cząsteczek acetylenu w mieszaninie przed reakcją?
W wyniku spalania benzyny, która była mieszaniną heptanu i oktanu, otrzymano mieszaninę, w której na 22 cząsteczki dwutlenku węgla przypada 25 cząsteczek wody. Ile cząsteczek heptanu przypadało na cząsteczkę oktanu w tej benzynie?
W naczyniu znajdują się stężone roztwory następujących substancji: amoniaku, chlorku wapnia, chlorowodoru, kwasu azotowego (V), siarczanu (VI) magnezu, wodorotlenku magnezu. Ustal, jaka substancja znajduje się w każdym naczyniu, jeśli wiadomo, że:
Roztwór z naczynia 1 ma odczyn obojętny, a po dodaniu do niego kilku kropli roztworu IV obserwuje się zmętnienie.
Po zbliżeniu wylotów naczyń II i V pojawiają się białe dymy chlorku amonu, roztwór z naczynia II ma odczyn kwaśny, a roztwór z naczynia V - odczyn zasadowy.
Roztwór z naczynia III reaguje z miedzią, a jednym z produktów reakcji jest brunatny trujący gaz.
Roztwór z naczynia VI barwi wyciąg z czerwonej kapusty na zielono, a fenoloftaleinę na malinowo.
Roztwór z naczynia IV mętnieje również po dodaniu kilku kropli azotanu (V) baru.
W zamkniętym naczyniu zmieszano 0,01 mola cząsteczek chloru z dwoma gazami: A i B. Gaz A otrzymano w wyniku reakcji 0,11 mola cynku z rozcieńczonym kwasem siarkowym (VI). Gaz B - w wyniku całkowitego rozłożenia 0,1 mola tlenku rtęci (II). Spowodowano wybuch mieszaniny gazów. W wyniku reakcji powstały dwie substancje, które są roztworem kwasu.
Ile gramów roztworu kwasu otrzymano?
Jaki kwas powstał?
Oblicz stężenie procentowe tlenu rozpuszczonego w wodzie deszczowej wiedząc, że dm3 tej wody zawiera 50 mg rozpuszczonego tlenu. Gęstość wody deszczowej należy przyjąć za równą 1 g/cm3.
Obliczyć stężenie procentowe nadtlenku wodoru (H2O2) w wodnym roztworze o gęstości 1,02 g/cm3 wiedząc, że dm3 takiego roztworu zawiera 61,2 g H2O2.
5 g tlenku ołowiu (II) ogrzewano w strumieniu wodoru. Po przerwaniu ogrzewania pozostały tlenek i wytworzony ołów ważyły 4,7 g. Ile wody powstało w tym doświadczeniu?
Ile gramów siarczku żelaza (II) otrzymano, jeżeli użyjemy do reakcji 10,5 g żelaza i 7 g siarki?
Ile miedzi i ile dwutlenku węgla otrzymamy, jeżeli użyjemy 1,2 g węgla do redukcji 28,8 g tlenku miedzi (I)?
Oblicz stężenie procentowe wodorotlenku sodu w roztworze otrzymanym po wprowadzeniu 2 g tlenku sodu do 12 g wody.
Ile cząsteczek wody przypada na każdą cząsteczkę wodorotlenku sodu w roztworze otrzymanym przez działanie 2,3 g sodu na 5,4 g wody?
Ułóż równania reakcji podanych tlenków z wodą lub zaznaczyć, że reakcja nie zachodzi:
CO2, CO, N2O5, SO3, NO, P2O5, CaO, K2O,
SO2, SiO2, Na2O, MgO, Fe2O3, N2O3.
Ile moli kwasu borowego (H3BO3) znajduje się w 0,5 dm3 roztworu, który w 200 cm3 zawiera 6,2 g kwasy borowego?
Oblicz stężenie procentowe roztworu kwasu fosforowego (V) otrzymanego po rozpuszczeniu 10 g tlenku fosforu (V) w 100 cm3 wody?
Ile gramów wodorotlenku sodu potrzeba do zobojętnienia 400 g 5% roztworu kwasu solnego?
Obliczyć rzeczywisty wzór sumaryczny węglowodoru o masie cząsteczkowej 30u, jeżeli w reakcji spalania 1,5 g tego związku otrzymano 4,4 g dwutlenku węgla oraz parę wodną.
Do spalania 1 mola metanu zużyto 1,25 mola tlenu. Otrzymano mieszaninę CO, CO2, H2, H2O (para). Obliczyć, ile moli każdego z tych gazów zawierała mieszanina.
Oblicz, ile atomów żelaza znajduje się w 10 g żelaza.
Oblicz, ile atomów wodoru zawartych jest w 5 molach amoniaku.
Oblicz, ile moli żelaza znajduje się w 32 g tlenku żelaza (III).
Tlenek pewnego czterowartościowego pierwiastka zawiera 13,4% tlenu. Jaki to pierwiastek?
Analiza próbki zanieczyszczonego chlorku sodu wykazała, że zawiera on 55% chloru. Ile procent zanieczyszczeń zawierała próbka? (Zanieczyszczenia nie zawierają sodu i chloru).
Ile gramów siarki potrzeba do otrzymania 100 g siarki glinu z glinu i siarki?
Ile moli dwutlenku węgla powstanie z reakcji 10 g tlenku żelaza (III) z węglem?
Czy 20 g tlenu wystarczy do całkowitego spalania 5 g węgla, jeżeli produktem reakcji jest dwutlenek węgla?
Ile gramów tlenku wapnia powstanie w reakcji 1 g wapnia z tlenem?
W reakcji redukcji tlenku bizmutu (III) węglem otrzymano bizmut i dwutlenek węgla. Obliczyć, ile moli bizmutu powstało w tej reakcji, jeżeli równocześnie otrzymano 7,5 mola dwutlenku węgla.
Obliczyć, ile gramów ołowiu powstało w reakcji tlenku ołowiu (IV) za pomocą wodoru, jeżeli równocześnie otrzymano 3 g wody.
Ułożyć równanie reakcji otrzymania węgliku glinu z glinu i węgla. Obliczyć, ile moli glinu potrzeba do otrzymania 54 g węgliku glinu.
Ile gramów tlenku fosforu (V) powstanie z utleniania 0,1 mola fosforu?
Czy 2 g tlenu wystarczą do utlenienia 1,8 g magnezu?
Ile dm3 tlenku siarki (IV) odmierzonych w warunkach normalnych potrzeba do otrzymania 10 g kwasu siarkowego (VI)?
Ile moli kwasu fosforowego (V) można otrzymać z 14,2 g tlenku fosforu (V)?
Czy 100 kg tlenku siarki (VI) wystarczy do otrzymania 1,2 mola kwasu siarkowego(VI)?
Obliczyć rzeczywisty wzór sumaryczny węglowodoru, który jest w warunkach normalnych gazem o gęstości 2,59 g/ dm3 i zawiera 82,8% węgla.
10 cm3 pewnego węglowodoru spalano zużywając 35 cm3 tlenu. Po skropleniu powstającej pary wodnej powstało 30 cm3 gazu, którego objętość nie uległa zmianie po przepuszczeniu przez wodny roztwór wodorotlenku sodu. Objętości mierzono w temperaturze 295 K pod normalnym ciśnieniem. Ustalić wzór sumaryczny węglowodoru.
Obliczyć, w jakim stosunku molowym zmieszano eten i propan, jeżeli do całkowitego spalenia 7 dm3 tej mieszaniny zużyto 32 dm3 tlenu otrzymując dwutlenek węgla i parę wodną. Podane objętości odnoszą się do identycznych warunków ciśnienia i temperatury.
150 cm3 mieszaniny etanu i etenu przepuszczono przez wodny roztwór bromu. Objętość gazu zmniejszyła się do 45 cm3. Objętości mierzono w tych samych warunkach ciśnienia i temperatury. Obliczyć procentowy skład objętościowy początkowej mieszaniny.
Do dwóch roztworów zawierających po 5 g bromu wprowadzono: do pierwszego 0,5 dm3 etenu, a drugiego 0,5 dm3 acetylenu. Czy w obu roztworach nastąpiło odbarwienie?
Ile gramów węgliku wapnia potrzeba do otrzymania 8 dm3 acetylenu?
Ustalić wzór sumaryczny związku węgla z wodorem, jeśli 1 objętość tego gazu reaguje z 2 objętościami tlenu dając objętość dwutlenku węgla i 2 objętości pary wodnej. Wszystkie objętości zmierzono w tych samych warunkach ciśnienia i temperatury.
Ile dm3 tlenu przereaguje z 15 dm3 wodoru tworząc wodę, jeżeli objętości odniesiemy do warunków normalnych?
Ile gramów wodoru przereaguje z 6 dm3 tlenu?
Ile moli tlenu przereaguje z 35 dm3 wodoru?
Podczas reakcji 2 objętości pewnego gazu z 4 objętościami wodoru otrzymano 1 objętość azotu i 4 objętości pary wodnej. Jaki jest wzór chemiczny badanego gazy?
Tlen występuje w pewnych warunkach w postaci odmiany alotropowej zwanej ozonem. Odmiany alotropowe różnią się od siebie liczbą atomów w cząsteczce. Obliczyć, z ilu atomów tlenu składa się cząsteczka ozonu, jeżeli gęstość ozonu w warunkach normalnych wynosi 2,14 g/dm3.
Obliczyć, z ilu atomów składa się cząsteczka fosforu w stanie pary, jeżeli reaguje on z tlenem w stosunku objętościowym 1:5, a produktem reakcji jest tlenek fosforu (V).
Ile dm3 dwutlenku węgla otrzymamy z rozkładu 12 g węglanu wapnia?
Ile dm3 tlenku węgla (II) należy utlenić, aby otrzymać 13,2 g tlenku węgla (IV)?
Obliczyć objętość tlenu potrzebną do spalenia 25 dm3 pewnego gazu wiedząc, że 2 objętości tego gazu reagują w tych samych warunkach ciśnienia i temperatury z 13 objętościami tlenu.
Obliczyć, w jakim stosunku molowym zmieszano tlenek azotu (I) z tlenkiem azotu (III), jeżeli 11 dm3 mieszaniny tych gazów reaguje w tych samych warunkach ciśnienia i temperatury z 27 dm3 wodoru dając azot i parę wodną.
40 cm3 pewnego węglowodoru spalono zużywając 180 cm3 tlenu. Po skropleniu powstającej pary wodnej pozostało 120 cm3gazu, który podczas przepuszczania przez wodny roztwór wodorotlenku potasu zostało całkowicie pochłonięty. Objętości mierzono w tych samych warunkach ciśnienia i temperatury. Ustalić wzór sumaryczny węglowodoru.
Obliczyć procentowy skład masowy i procentowy skład objętościowy mieszaniny etylenu i acetylenu, jeżeli do spalenia 4 dm3 tej mieszaniny zużyto 11 dm3 tlenu otrzymując dwutlenek węgla i parę wodną.
Siarczek pewnego jednowartościowego metalu zawiera 20% siarki. Jaki to pierwiastek?
4 g tlenku rtęci (II) poddano rozkładowi ogrzewając w otwartym naczyniu. Masa substancji w naczyniu po przerwaniu ogrzewania wynosiła 3,78 g . ile procent tlenku rtęci (II) zawierała mieszanina poreakcyjna?
Obliczyć procentowy skład masowy mieszaniny tlenku azotu (II) i tlenku azotu (V), jeżeli 7,5 objętości mieszaniny tych gazów reaguje w tych samych warunkach ciśnienia i temperatury z 21,5 objętościami wodoru dając azot i parę wodną.
Po eksplozji 35 cm3 mieszaniny wodoru z tlenem pozostało 5 cm3 wodoru. Obliczyć, jaki procent objętościowy tlenu zawierała mieszanina gazów przed reakcją?
Ile cząsteczek wody przypada na każdą cząsteczkę kwasu siarkowego (IV) w roztworze otrzymanym po rozpuszczeniu 5 dm3 tlenku siarki (IV) w 84 cm3 wody?
Ile procent zanieczyszczeń zawiera sól kuchenna, jeżeli zawiera 33,4% Na?
Ile gramów dwuwodnego chloranu (V) wapnia - Ca(CiO3)2·H2O należy rozpuścić w 100 g wody, aby otrzymać 10% roztwór chloranu (V) wapnia?
Azotan (V) wapnia ulega podczas ogrzewania rozkładowi na tlenek wapnia, tlenek azotu (IV) i tlen. Ogrzewano w otwartej probówce 10 g azotanu (V) wapnia i po pewnym czasie stwierdzono, że masa substancji w probówce wynosi 6,71 g. Obliczyć:
Ile gramów tlenku wapnia zawierała substancja w probówce po doświadczeniu?
Ile gramów tlenu wydzieliło się w doświadczeniu?
Ile procent tlenku żelaza (III) i ile procent tlenku krzemu (IV) zawiera ruda o zawartości 56% żelaza i 7% krzemu?
Tak zwane szkło zwykłe zawiera 13% tlenku sodu, 11,7% tlenku wapnia i 75,3% tlenku krzemu (IV). Ustalić wzór tlenkowy szkła.
5,9 g stopu miedzi z glinem poddano działaniu kwasu solnego. Wydzielający się gaz zajął objętość 3,36 dm3. Obliczyć, ile moli miedzi przypada na 1 mol glinu w tym stopie.
W pewnym tlenku miedzi stosunek masowy miedzi do tlenu wynosi 8:1. ustal wzór tego tlenku.
Pewien tlenek fosforu zawiera 56,36% masowych fosforu i 43,64% masowych tlenu. Ustal wzór sumaryczny tego tlenku.
Która para tlenków w reakcji z wodą tworzy substancje zmieniające barwę lakmusu z niebieskiej na różową:
Ag2O i Al2O3,
CO i NO,
Na2O i K2O,
P2O5 i SO3.
Jest gazem palnym, produkt jego spalania odbarwia zabarwiony fenoloftaleiną roztwór wodorotlenku sodu. Gazem tym jest:
tlen,
azot,
wodór,
tlenek węgla (II).
Z rozcieńczonym kwasem solnym nie będzie reagować:
Cu, c) Al,
Fe, d) Zn.
Do 180 cm3 tlenku wodoru wrzucono 10 g sodu. Oblicz stężenie procentowe powstałego związku.
Badana substancja:
w roztworze wodnym wykazuje odczyn zasadowy,
podczas prażenia w temperaturze około 453 K ulega rozkładowi, wydzielając m. in. Dwutlenek węgla i parę wodną,
pozostałość stała po prażeniu reaguje z kwasem solnym wydzielając również dwutlenek węgla,
barwi płomień palnika na kolor żółty.
Substancją tą jest:
NH4HCO3,
Na2CO3,
NaOH,
NaHCO3.
Która z poniżej wymienionych reakcji zajdzie w probówce z siarczanem (VI) sodu, do której wlejemy kwas solny:
Na2SO4 + 2HCl → 2 NaH + Cl2SO4,
Na2SO4 + HCl → NaCl + H2O + SO3,
Na2SO4 + 2HCl → 2 NaCl + H2SO4,
żadna z wymienionych reakcji, ponieważ kwas solny jest kwasem lotnym.
Aby ustalić, w którym naczyniu znajduje się rozcieńczony kwas siarkowy (VI), a w którym kwas siarkowy (IV) należy:
dodać do nich wskaźnika uniwersalnego,
ogrzać do wrzenia, a dopiero potem dodać wskaźnik,
dodać do nich fenoloftaleiny,
dodać do nich wodorotlenku sodu.
W reakcji cynku z kwasem siarkowym (VI) udział biorą:
atomy cynku z cząsteczkami wodoru,
tylko atomy cynku z kationami wodoru,
tylko atomy cynku z anionami reszty kwasowej,
tylko kationy cynku z cząsteczkami kwasu.
Jakie jony pozostaną w roztworze po zmieszaniu 10 g 16% roztworu chlorku sodu z 10 g 1% roztworu azotanu (V) srebra:
tylko NO3-,
Na+, NO3-,
Ag+, Ci-, Na+,
Na+, Cl-, NO3-.
Zmiana zabarwienia papierka kobaltowego świadczy o:
zmianie odczynu,
zmianie temperatury,
zmianie wilgotności,
obecności cząstek koloidalnych w roztworze.
CZĘŚĆ 3
zakres materiału części 1 i 2,
alkohole,
kwasy organiczne,
estry.
Oblicz masę cząsteczkową alkoholu jednowodorotlenowego wiedząc, że z 5 g alkoholu sód wypiera 934 cm3 wodoru.
Ile gramów octanu miedzi (II) należy poddać elektrolizie, aby otrzymać 2,53 g miedzi?
Doświadczalnie stwierdzono, że przepuszczenie 1,3 g acetylenu przez wodę bromową zawierającej 16 g bromu powoduje jej odbarwienie. Czy odbarwieniu ulegnie 250 g 20 - procentowej wody bromowej, jeśli wprowadzimy do niej 5,6 dm3 acetylenu o gęstości 1,16 g/dm3?
Przyjmij, że stearyna składa się wyłącznie z kwasu stearynowego, a parafina z węglowodoru o roztworze C18H38, a następnie obliczono, czy większe jest zużycie tlenu na jednostkę masy podczas spalania świecy stearynowej, czy parafiny?
Do krystalicznego, uwodnionego siarczanu (VI) żelaza (II) dodano tyle wody, że na każdy jon żelaza przypadało 69 cząsteczek wody. Po rozpuszczeniu tego związku otrzymano roztwór 10 - procentowy siarczanu (VI) żelaza (II). Oblicz, ile cząsteczek wody przypada na jeden jon żelaza w krysztale uwodnionego siarczanu (VI) żelaza (II).
Wprowadzenie każdej cząsteczki glikolu etylenowego na 52 cząsteczki wody powoduje obniżenie temperatury krzepnięcia powstałego roztworu o około 2˚C. Oblicz stężenie procentowe glikolu w roztworze stosowanym w chłodnicach samochodowych, który zamarzałby e temp. -10˚C. Roztwór glikolu w wodzie to płyn do chłodnic typu „borygo”.
Pochodne pewnego węglowodoru mają masy cząsteczkowe: alkohol 60u, kwas karboksylowy 74u. Jaki to węglowodór?
Oblicz masę cząsteczkową estru, który powstał w reakcji alkoholu o masie cząsteczkowej 60u i kwasu o masie również równej 60u. Kwas i alkohol zawierają po jednej grupie funkcyjnej w cząsteczce.
W wyniku spalania mieszaniny metanolu i etanolu w produktach reakcji na 8 cząsteczek dwutlenku węgla przypada 13 cząsteczek wody. Jaki był stosunek liczby cząsteczek metanolu do liczby cząsteczek etanolu w spalanej mieszaniny?
Ustal, jakie substancje kryją się pod literami A, B, C, D, E, F i G, jeśli uwzględnisz, że C i E to mydła rozpuszczalne w wodzie, G jest mydłem nierozpuszczalnym w wodzie, roztwory zaś wodne A, D, F mają odczyn zasadowy.
Na skutek awarii w jednym z zakładów przemysłowych, środowisko zostało skażone silną trucizną - węglanem baru. Do odkażenia terenu użyto siarczanu (VI) amonu. Wiedząc, że siarczan (VI) amonu bardzo dobrze rozpuszcza się w wodzie, a węglan baru jest 10 razy lepiej rozpuszczalny niż nietoksyczny siarczan (VI) baru, uzasadnij celowość użycia siarczanu (VI) amonu do odkażenia terenu.
Dwa związki organiczne, z których jeden jest kwasem, a drugi alkoholem, mają masy cząsteczkowe równe 60u każdy. Podaj ich wzory sumaryczne i strukturalne oraz nazwy.
Do tlenku miedzi (II) dodano taką ilość kwasu octowego, że po ogrzaniu obydwie substancje przereagowały całkowicie. Oblicz stężenie powstałego roztworu, jeśli wiadomo, że w roztworze kwasu na jego jedną cząsteczkę przypadało 45 cząsteczek wody.
Przedstaw wzory strukturalne i nazwy estrów o wzorze sumarycznym:
C3H6O2,
C4H8O2,
C5H10O2.
Podaj przynajmniej po dwa przykłady.
W wyniku wytrząsania kwasu nienasyconego z wodą bromową powstał związek, którego masa cząsteczkowa jest o 160u większa od masy kwasu. Ile wiązań podwójnych występuje w cząsteczce tego kwasu?
Mydło tzw. twarde jest mieszaniną soli sodowych wyższych kwasów tłuszczowych. Masa cząsteczkowa jednej z tych soli wynosi 306u. Oblicz masę cząsteczkową kwasu, którego to jest sól.
Zmieszano 113,3 g roztworu chlorku baru i 110 g roztworu kwasu siarkowego (VI). Roztwory przereagowały całkowicie. Otrzymany osad odsączono, przemyto i osuszono. Jego masa wynosiła 23,3 g. Przesącz zawiera 7,3 g substancji rozpuszczonej. Jaka to substancja? Jakie jest jej stężenie w przesączu?
Ułóż równania reakcji, za pomocą których można dokonać następujących przemian (w równaniach nie należy stosować wzorów sumarycznych):
metan → chlorek metylu → metanol,
etan → bromek etylu → etanol → eten,
eten → etanol → chlorek etylu → etanol,
etanol → eten → dichloroetan → glikol,
eten → dibromoetan → glikol.
Ile gramów chlorku metylu można otrzymać ze 100 g metanolu, jeżeli wydajność reakcji wynosi 70%?
Ile cząsteczek metanolu przypada na jedną cząsteczkę metanolanu sodu w roztworze otrzymanym po reakcji 2,3 g sodu z 32 g metanolu?
Ułóż równania reakcji, w miejsce liter wstaw wzory odpowiednich substancji:
Na kwas octowy podziałano alkoholem etylowym zawierającym nuklid tlenu 18O. Który z produktów reakcji: estry czy woda będą zawierały ten izotop?
Napisz równania reakcji wyrażone schematem:
octan sodu → kwas octowy → octan etylu
Narysuj wzory strukturalne wszystkich alkoholi o wzorze C4H10O.
Ile moli wodoru potrzeba do utwardzenia 1 mola trójoleinianu gliceryny?
Ułożyć równania kolejnych reakcji, które należy przeprowadzić, aby otrzymać:
mrówczan metylu, mając do dyspozycji metan i dowolne odczynniki nieorganiczne,
eten, mając do dyspozycji octan etylu i dowolne odczynniki nieorganiczne,
octan etylu, mając do dyspozycji etan i dowolne odczynniki nieorganiczne,
glikol, mając do dyspozycji octan etylu i dowolne odczynniki nieorganiczne.
Obliczyć gęstość 10% wodnego roztworu kwasu octowego, jeśli 1 dm3 tego roztworu zawiera 1,68 mola kwasu.
Ustalić wzór hydratu octanu sodu zawierającego 39,7% wody. Obliczyć, ile gramów hydratu należy rozpuścić w 100 g wody, aby otrzymać 7,21% roztwór octanu sodu.
Do roztworu zawierającego 3 mole kwasu palmitynowego dodano 1 mol wodorotlenku wapnia, a następnie 1,5 mola węglanu sodu. Osad odsączono. Co zawierał przesącz i jaki był jego odczyn?
Napisz w formie cząsteczkowej i jonowej równania reakcji zachodzące pomiędzy podanymi substancjami w roztworach wodnych:
CH3COOH + NaOH →
HCOOH + Ca →
(CH3COO)2Ba + Na2CO3 →
CH3COOH + NH3 →
CH3COOAg + HCl →
(CH3COO)2Ba + H2SO4 →
Jaka reakcja zajdzie podczas ogrzewania mrówczanu sodu z dużym nadmiarem stężonego kwasu siarkowego (VI)? Ułóż równanie.
W jaki sposób można otrzymać mrówczan sodu, mając do dyspozycji metan i dowolne odczynniki nieorganiczne?
Narysuj wzory strukturalne dwóch estrów i kwasu o wzorze C3H6O2.
Wpisać w miejsce liter A, B, C wzory odpowiednich związków, a następnie napisać równania:
Ile gramów kwasu octowego i ile gramów etanolu należy użyć w celu otrzymania 10 g octanu etylu, jeśli wydajność reakcji przy mieszaniu substratów w stosunku mol na mol wynosi 60%?
Ułóż równania reakcji przedstawionych schematem:
Ułóż równania reakcji hydrolizy i określ odczyn roztworu:
metanolanu potasu,
etanolanu wapnia.
Ułóż równania hydrolizy mrówczanu metylu, octanu etylu, trójpalmitynianu gliceryny.
Ułóż równania reakcji, za pomocą których można dokonać następujących przemian:
octan sodu → kwas octowy → octan etylu,
palmitynian etylu → kwas palmitynowy → palmitynian gliceryny.
Pewien ester poddano hydrolizie i otrzymano kwas A i Alkohol B. Ogrzewano kwas A ze stężonym kwasem siarkowym (VI) i otrzymano tlenek węgla (II). Alkohol B przepuszczono przez ogrzany tlenek glinu i otrzymano propen. Jaki ester poddano hydrolizie?
Ułóż równania reakcji wyrażone schematem:
Ułożyć równanie reakcji hydrolizy i podać odczyn roztworu:
mrówczanu potasu,
octanu baru.
Ułożyć równania reakcji hydrolizy i podać odczyn roztworu:
metanol, mając do dyspozycji metan i dowolne odczynniki nieorganiczne,
eten, mając do dyspozycji etan i dowolne odczynniki nieorganiczne,
glikol, mając do dyspozycji eten i dowolne odczynniki nieorganiczne,
glikol, mając do dyspozycji etanol i dowolne odczynniki nieorganiczne,
glikol, mając do dyspozycji etan i dowolne odczynniki nieorganiczne.
W wyniku hydrolizy pewnego estru o masie równej 116 g/mol otrzymano alkohol A i kwas B. Ustal wzór tego estru wiedząc, że alkohol można utlenić do kwasu B.
Czy mydło będzie się pienić w rozcieńczonym roztworze:
kwasu solnego,
wodorotlenku sodu?
Odpowiedź uzasadnij.
Oblicz, ile m3 etylenu odmierzonego w warunkach normalnych należy użyć w celu otrzymania 1 tony glikolu etylenowego, jeśli wydajność całej syntezy wynosi 80%?
Ze 120 dm3 stechiometrycznej mieszaniny CO i H2, odmierzonej w normalnych warunkach otrzymano, po przepuszczeniu jej przez katalizator, 48 g metanolu. Oblicz wydajność tej syntezy.
W wyniku spalenia mieszaniny metanolu i etanolu otrzymano dwutlenek węgla i wodę. Oblicz, jaki jest stosunek liczby cząsteczek etanolu do liczby cząsteczek metanolu w mieszaninie, jeśli na trzy cząsteczki dwutlenku węgla w produktach reakcji przypadało 5 cząsteczek wody.
W wyniku spalenia 9 g substancji organicznej otrzymano 13,2 g dwutlenku węgla i 5,4 g wody. Wyznacz skład procentowy spalanej substancji.
Związek organiczny o składzie: 52,17% masowych węgla, 13,05% wodoru oraz 34,78% tlenu zawiera 1 atom tlenu w cząsteczce. Ustal wzór cząsteczki tego związki.
CZĘŚĆ 4
zakres materiału części 1, 2 i 3,
tłuszcze,
białka,
cukry,
stężenie molowe.
Ile procent masowych azotu zawiera saletra amonowa zawierająca 80% czystego azotanu (V) amonu?
Ile cząsteczek wody przypada na jedną cząsteczkę etanolu w 46 - procentowym roztworze?
Masy cząsteczkowe octanów trzech metali wynoszą odpowiednio: pierwszego - 82u, drugiego - 142u, trzeciego - 174u. Oblicz masy atomowe tych metali i na tej podstawie dokonaj ich identyfikacji.
Jaką objętość etylenu otrzymamy w wyniku przeprowadzonej a wydajnością 62,5% depolimeryzacji 100 g polietylenu? Gęstość etylenu wynosi około 1,25 g/dm3.
Przyjmując, że białko o masie cząsteczkowej 10734u powstaje jedynie z aminokwasu zwanego glicyną CH2(NH2)COOH, oblicz, z ilu cząsteczek glicyny powstała cząsteczka tego białka.
Tlenek żelaza (III) zawiera 70% masowych żelaza. Żelazo otrzymujemy w ten sposób, że tlenek żelaza (III) mieszamy z węglem w stosunku masowym 8:1 i ogrzewamy do wysokiej temperatury. Oblicz. Ile należy zużyć rudy i koksu, aby otrzymać 1 tonę surówki zawierającej 95% masowych żelaza przy założeniu, że ruda żelaza - hematyt - jest czystym tlenkiem żelaza (III), a koks zawiera 90% masowych węgla.
Krew zdrowego człowieka zawiera do 0,1% glukozy. Ile glukozy zawiera krew człowieka ważącego 70 kg? Krew stanowi około 7% wagi ciała.
W skład cząsteczki związku będącego jednym ze składników tłuszczu wchodzi 71,25% masowych węgla, 18,75% wodoru i 10% tlenu. Masa cząsteczkowa tego związku wynosi 960u. Ustal wzór sumaryczny tego związku.
W 10 - procentowym roztworze siarczanu (VI) pewnego metalu na jeden jon metalu przypada 100 cząsteczek wody. Oblicz wartościowość metalu w tym siarczanie. Masa atomowa metalu wynosi 56u.
Do kwasu solnego, w którym na 4 jony wodorowe przypada 109 cząsteczek wody, dodano tyle węglanu wapnia, że obie substancje przereagowały całkowicie. Oblicz stężenie procentowe otrzymanego roztworu.
Masa cząsteczkowa trzech związków organicznych: alkoholu, kwasu i estru są równe i wynoszą 74u każda. Podaj wzory sumaryczne i kreskowe oraz nazwy tych związków.
Sól kwasu tlenowego zawiera 40% masowych miedzi i 20% siarki, jej masa cząsteczkowa wynosi 160u. Ustal wzór tej soli.
Pary octanu etylu zmieszane z powietrzem w stosunku objętościowym 1:8 tworząc mieszaninę wybuchową. Oblicz skład tej mieszaniny w procentach objętościowych.
Masa cząsteczkowa stearynianu pewnego dwuwartościowego metalu wynosi 606u. Na podstawie obliczonej masy atomowej ustal, który to metal.
W pomieszczeniach o wymiarach 4 m

5 m
3 m odparowało 2,94 kg metanolu. Czy istnieje niebezpieczeństwo wybuchu par metanolu zmieszanych z powietrzem w tym pomieszczeniu? Właściwości wybuchowe ma mieszanina zawierająca w powietrzu 3,5% objętościowych par metanolu, których gęstość wynosi 1,4 g/dm3.
Tlenek miedzi (II) zmieszano z węglem w stosunku masowym 40:3. Cała ilość tlenku została zredukowana do miedzi. Czy drugim produktem tej reakcji był tlenek węgla (II), czy tlenek węgla (IV)?
Na każdy jon miedzi w uwodnionym siarczanie (VI) miedzi (II) - CuSO4·5H2O dodano 75 cząsteczek wody. Oblicz stężenie procentowe otrzymanego roztworu.
W 1 dm3 roztworu wodorotlenku sodu znajduje się tyle jonów Na+, ile cząsteczek kwasu znajduje się w 1 dm3 roztworu kwasu. 3 dm3 roztworu wodorotlenku zobojętnia 1 dm3 roztworu kwasu. Ile atomów wodoru zawiera cząsteczka tego kwasu?
Hemoglobina, białko, z którego pomocą tlen jest przenoszony z płuc do tkanek ciała, zawiera 0,355% masowych żelaza. Oblicz masę cząsteczkową hemoglobiny, jeśli jej cząsteczka zawiera jeden atom żelaza.
W reakcji hydrolizy tłuszczu otrzymano 128 g kwasu palmitynowego i 71 g kwasu stearynowego. Ustal wzór tego tłuszczu.
Jakie musi być stężenie procentowe roztworu glukozy, aby mol glukozy przypadał na mol wody?
Przedstaw równania 10 reakcji chemicznych, w których przynajmniej jeden produkt występuje w zwykłych warunkach w stanie gazowym. Substraty reakcji należy dobrać spośród następujących substancji: (C2H4)n, CaCO3, CaC2, CH3COOH, H2O, Mg, H2SO3, C6H12O6, NH4Cl.
Do mieszaniny zasady wapniowej z wodą, w której na 1 jon wapnia przypada 37 cząsteczek wody, dodano tyle kwasu octowego, że przereagował on całkowicie z zasadą. Następnie z otrzymanego roztworu odparowano ⅓ liczby cząsteczek wody przypadających na 1 jon wapnia. Oblicz z dokładnością do setnych części:
stężenie procentowe roztworu po zmieszaniu zasady z kwasem,
stężenie procentowe roztworu po odparowaniu wody.
Ustal wzory substancji A, B, C, D, E i ułóż równania reakcji podanych w chemografie:
Skład powietrza zmienia się w miarę wzrostu wysokości nad Ziemią. Którego składnika ubywa: azotu czy tlenu? Odpowiedź uzasadnij.
Ustal, jaki trójwartościowy pierwiastek tworzy z tlenem związek o masie cząsteczkowej 4,47 razy większej niż masa cząsteczkowa związku tego pierwiastka z wodorem.
Pierwiastki A i B tworzą związek o wzorze A4B3 i masie cząsteczkowej 144u, zawierający 75% pierwiastka A. Podaj wzór tego związku.
W 2 - procentowym roztworze pewnego wodorku HE na dwie jego części molowe przypada 441 części molowych wody. Podaj wzór tego wodorku.
Oblicz, ile gramów wody należy dodać do 100 g roztworu saletry sodowej, nasyconego w temp. 60˚C, aby po oziębieniu do temp. 20˚C sól rozpuściła się całkowicie i utworzyła roztwór nasycony. Rozpuszczalność saletry w temp. 60˚C wynosi 122 g, a w temp. 20˚C - 89 g.
Oblicz, ile centymetrów sześciennych 30% perhydrolu musisz dolać do posiadanych 50 g 3% wody utlenionej, aby uzyskać 12 - procentową wodę utlenioną (gęstość obu roztworów = 1 g/cm3).
Do 10 cm3 znajdującego się w cylindrze miarowym roztworu kwasu solnego o stężeniu 35% dodano wody do poziomu 150 cm3. oblicz stężenie procentowe uzyskanego w ten sposób kwasu. Gęstość roztworu 35% wynosi 1,17 g/cm3.
Oblicz, laką objętość wody i jaką objętość 36% stężonego kwasu solnego o gęstości 1,18 g/cm3 należy zmieszać, aby otrzymać 0,25 dm3 tego kwasu o stężeniu 5% i gęstości 1,024 g/cm3.
Ustal wzór sumaryczny monocukru o masie cząsteczkowej 150u, zawierającego 40% masowych węgla i 6,67% wodoru.
W reakcji estryfikacji kwasu propionowego otrzymano ester o masie cząsteczkowej 102u. Oblicz masę cząsteczkową alkoholu użytego w tej reakcji.
W wyniku reakcji 3,7 g kwasu CxH2x+1COOH z cynkiem otrzymano 0,56 dm3 wodoru. Ustal wzór tego kwasu. Gęstość wodoru wynosi 0,089 g/dm3.
Ustal równania następujących przemian:
Do każdego z równań (A, B, C, D) wybierz odpowiednie określenie:
twardnienie wapna gaszonego,
prażenie skały wapiennej,
gaszenie wapna palonego,
wiązanie zaprawy przez piasek.
Ustal liczbę grup wodorotlenowych zawartych a alkoholu o masie cząsteczkowej 92u, w którym stosunek masowy C:H:O = 4,5:1:6.
Pierwiastki X i Y należą do tego samego okresu i tworzą ze sobą związek XY, w którym Y stanowi 67,3% masowych. Pierwiastek X gwałtownie reaguje z wodą, wydzielając wodór. Tlenek pierwiastka X zawiera 17% tlenu. Podaj wzór związku XY.
Kawałek jednego z litowców o masie 0,78 g wrzucono do wody. Wydzielający się gaz zebrano w cylindrze miarowym. Zajął on objętość 0,22 dm3. Który z litowców użyto do doświadczenia? Gęstość wodoru = 0,089 g/dm3.
W pewnych warunkach temperatury i ciśnienia azot łączy się z wodorem tak, że powstaje 80% stechiometrycznej ilości amoniaku. Oblicz, ile gramów amoniaku powstanie w tych warunkach w reakcji azotu z wodorem otrzymanym w wyniku elektrolizy 72 g wody.
Do 66,3 g roztworu chlorku sodu dolano 132,4 g roztworu azotanu (V) srebra (I), w wyniku czego nastąpiło całkowite przereagowanie obu substancji. Masa powstałego osadu po jego odsączeniu i osuszeniu wyniosła 28,7 g. Oblicz stężenie procentowe drugiego produktu reakcji w pozostałym przesączu, wiedząc, że masa tego produktu wynosi 17 g.
Oblicz, ile gramów roztworu azotanu (V) srebra (I) o stężeniu 20% trzeba dodać do 166 g 10 - procentowego roztworu jodku potasu, aby nastąpiło całkowite strącenie osadu.
Oblicz, ile procent zanieczyszczeń zawiera krzemionka, jeśli zawartość procentowa krzemu wynosi 42%, a zanieczyszczenia nie zawierają krzemu.
W jakim stosunku masowym należy zmieszać 20 - procentowy roztwór kwasu solnego z 5 - procentowym roztworem togo kwasu, aby otrzymać roztwór 15%?
W temp. 293 K do 200 g wody wsypano 220 g azotanu (V) sodu. Jaka masa tej substancji rozpuści się, a jaka pozostanie nie rozpuszczona, jeśli stężenie nasyconego roztworu azotanu (V) sodu w tej temp. Wynosi 47%?
Zmieszano dwa roztwory wodorotlenku sodu: 200 g roztworu sporządzonego przez rozpuszczenie 50 g stałego wodorotlenku sodu w wodzie oraz 1 dm3 roztworu o gęstości 1,22 g/cm3, w którym 970 g stanowiła woda. Odlicz:
Stężenie procentowe wyjściowych roztworów.
Stężenie procentowe roztworu powstałego zmieszanie roztworów wyjściowych.
Ile wody należy dodać do powstałego roztworu, aby jego stężenie osiągnęło wartość 10%?
Ile stałego wodorotlenku sodu należy rozpuścić w otrzymanym roztworze, aby jego stężenie osiągnęło wartość 30%?
Płytkę miedzianą o masie 10 g zanurzono w wodnym roztworze azotanu (V) srebra (I). Po pewnym czasie płytkę wyjęto, dokładnie oczyszczono z osadu srebra, osuszono i zważono. Masa płytki wynosiła 8,4 g. Oblicz liczbę moli i masę wydzielanego srebra.
który z dwóch roztworów o tych samych stężeniach jest bardziej zasadowy: roztwór Na2CO3 czy roztwór NaHCO3? Odpowiedź uzasadnij odpowiednimi równaniami chemicznymi.
Roztwór kwasu siarkowego (VI , w którym na 1 jon siarczanowy (VI) przypada 609 cząsteczek wody, zobojętniono roztworem wodorotlenku sodu, w którym na 1 jon sodu przypada 85 cząsteczek wody. Oblicz stężenie procentowe otrzymanego roztworu.
Zmieszano 150 g 5% roztworu wodorotlenku sodu z 200 g 3% roztworu kwasu octowego. Oblicz liczbę moli, gramów i pojedynczych cząsteczek powstałego produktu. Podaj jego nazwę i narysuj wzór kreskowy.
6,2 g wapna palonego poddano działaniu 400 g 6,3% roztworu kwasu azotowego (V). Nie przereagowany kwas zobojętniono za pomocą 200 cm3 4% roztworu wodorotlenku sodu o gęstości 1,05 g/cm3. oblicz, ile procent tlenku wapnia zawierało wzięte do reakcji wapno palone.
500 g roztworu azotanu (V) ołowiu (II), nasyconego w temp. 90˚C, oziębiono do temp. 40˚C. Oblicz ilość substancji wykrystalizowanej oraz stężenie procentowe roztworu nad osadem. Rozpuszczalność soli w temp. 90˚C = 125 g, a w temp. 40˚C = 70 g.
Rozwiąż chemograf. Ustal, jakie substancje kryją się pod literami: X, Y, Z, W. Zapisz równania reakcji.
Próbkę mieszaniny chlorku azotanu (V) sodu o masie 20,2 g rozpuszczono w wodzie, a na otrzymano roztwór podziałano 5% roztworem azotanu (V) srebra (I), w ilości wystarczającej do całkowitego wytrącenia osadu, którego masa wyniosła 28,7 g. Oblicz zawartość chlorku sodu w mieszaninie oraz masę roztworu azotanu (V) srebra (I) użytą do reakcji strącenia.
Całkowitemu spaleniu poddano po dwa mole: metanu, etanu, etylenu i acetylenu, a produkty reakcji przepuszczono przez osobne naczynie z wodą wapienną. Jaka liczba moli osadu powstała w każdym z tych naczyń i w których przypadkach była ona jednakowa?
Pogrupuj podane niżej substancje według odczynu, jaki będzie wykazywał ich roztwór: siarczan (VI) amonu, chlorek wapnia, kwas octowy, węglan potasu, bromek sodu, siarczek sodu, siarczan (VI) glinu, octan sodu, siarczan (VI) potasu, wodorotlenek baru, amoniak, etanol, palmitynian potasu. Odpowiedź uzasadnij odpowiednimi równaniami.
Ile gramów sacharozy należy poddać hydrolizie, aby otrzymać 5 g fruktozy przyjmując, że wydajność reakcji wynosi 80%.
Ułóż równanie reakcji węgliku glinu z kwasem solnym i oblicz, ile gramów węgliku glinu i ile dm3 2 - molowego kwasu solnego potrzeba do otrzymania 1 mola metanu.
Ile gramów etanolanu sodu znajduje się w 0,2 dm3 0,1 - molowego roztworu?
Oblicz stężenie molowe 6% roztworu glukozy. Gęstość roztworu 1,02 g/cm3.
Oblicz stężenie procentowe 0,8 - molowego roztworu sacharozy. Gęstość roztworu 1,1 g/cm3.
Do jakiej objętości wody należy wlać 100 cm3 0,5 - molowego kwasu solnego, aby otrzymać roztwór 0,1 - molowy?
Oblicz, ile moli substancji znajduje się w 0,6 dm3 roztworu 2 - molowego.
W jakiej objętości 0,5 - molowego roztworu znajdują się 2 mole substancji?
W 150 cm3 roztworu znajduje się 50 g chlorku wapnia. Oblicz stężenie molowe roztworu.
Oblicz stężenie molowe roztworu otrzymanego po rozpuszczeniu 234 g siarczku sodu w 6 dm3 wody, jeśli gęstość tego roztworu wynosi 1,04 g/cm3.
Ile gramów chlorku sodu otrzymamy po odparowaniu do sucha 100 cm3 0,5 - molowego roztworu?
W jakiej objętości 0,25 - molowego roztworu wodorotlenku sodu znajduje się 10 g wodorotlenku sodu?
Oblicz stężenie molowe 20% roztworu bromku sodu o gęstości 1,17 g/cm3.
Oblicz stężenie procentowe 5,02 - molowego roztworu chlorku wapnia o gęstości 1,4 g/cm3.
Oblicz stężenie molowe nasyconego roztworu azotanu (V) potasu o gęstości 1,16 g/cm3, jeżeli rozpuszczalność wynosi 32 g.
W jakiej objętości 2,5 - molowego bromku wapnia znajduje się 5 g tej soli?
Do 0,5 dm3 0,1 - molowego roztworu dolano 0,2 dm3 wody. Oblicz stężenie molowe otrzymanego roztworu.
Ile wody należy dolać do 100 cm3 0,5 - molowego roztworu, aby otrzymać roztwór 0,25 - molowy?
Zmieszano dwa roztwory: 200 cm3 0,5 - molowego roztworu oraz 400 cm3 1 - molowego roztworu. Oblicz stężenie molowe otrzymanego roztworu.
ODPOWIEDZI
ODPOWIEDZI DO ZADAŃ Z CZĘŚCI 1 |
|
Nr zad. |
ODPOWIEDŹ |
1.1. |
o 6,395 g |
1.2. |
20% Sn, 80% Cu |
1.3. |
masa Zn = 150 kg, masa Cu = 830 kg, masa Pb = 20 kg |
1.4. |
a) 21,7 g HgO; b) 21,7 g HgO |
1.5. |
C3H3 |
1.6. |
- |
1.7. |
C2H4O2 |
1.8. |
o 30u |
1.9. |
2 razy |
1.10. |
P4 |
1.11. |
N2O3 - tlenek azotu (III) |
1.12. |
135 kg |
1.13. |
masa Sn = 120 g, masa Pb = 80 g |
1.14. |
0,048 g |
1.15. |
masa powietrza = 128,6 g; gęstość powietrza = 1,286 g/dm3 |
1.16. |
Fe2O3 |
1.17. |
Na2S2O3 |
1.18. |
a) x = 5; b) x = 3; c) x = 6; d) x = 2 |
1.19. |
2 atomy wodoru, 2 atomy tlenu |
1.20. |
40% S, 60% O |
1.21. |
25 g |
1.22. |
90,839 kg |
1.23. |
2,5 m3 |
1.24. |
3 razy |
1.25. |
46,6% azotu, 53,4% tlenu |
1.26. |
Al2SiO5 |
1.27. |
- |
1.28. |
a) 40% S, 60% O; b) 50% S, 50% O |
1.29. |
48,27% Fe, 10,3% C, 41,38% O |
1.30. |
200 g wody |
1.31. |
a) 2 g kwasu salicylowego, 98 g alkoholu; b) 124 cm3; c) 3,2 g kwasu, 156,8 g alkoholu, |
1.32. |
400 g octu, 100 g wody |
1.33. |
1,63 g/dm3 |
1.34. |
62 g cukru, Cp = 75,6% |
1.35. |
Cp = 10% |
1.36. |
Bransoleta wykonana jest ze złota; dAu = 19,3 g/cm3 |
1.37. |
25 uczniów |
1.38. |
1,54 g siarkowodoru |
1.39. |
C2H6O |
1.40. |
2,6·1022 sekund |
1.41. |
o 15,18 g |
1.42. |
55,6 m3 |
1.43. |
masa ładunku balonu wypełnionego wodorem = 450 kg; masa ładunku balonu wypełnionego helem = 405,65 kg |
1.44. |
2% Al, 98% Cu |
1.45. |
99,5 m3 |
1.46. |
C4H10 |
1.47. |
mc : mo = 3 : 8 |
1.48. |
C6H12O6 |
1.49. |
13 g soli |
1.50. |
65,79 dm3 |
1.51. |
a) Cp = 46,8%; b) 88 g |
1.52. |
CH4O |
1.53. |
Bardzo szybka śmierć, stężenie amoniaku 3,8 g/m3 powietrza |
1.54. |
4·106 atomów, 4·105 sekund |
1.55. |
CS2 |
1.56. |
a) CO2; b) Fe2S3; c) H2SO4 |
1.57. |
azot, masa atomowa = 14u |
1.58. |
900 g H2O |
1.59. |
Cp= 28,57% |
1.60. |
10 cząsteczek wody |
1.61. |
Cp = 10% |
1.62. |
- |
1.63. |
145 cm3 kwasu i 333,3 cm3 H2O |
1.64. |
Cp = 10% |
1.65. |
A - tlen, B - sód, C - tlenek sodu, D - woda, E - wodór |
1.66. |
25 g NaOH |
1.67. |
Na2O - tlenek sodu |
1.68. |
objętość tlenu = 30 m3, masa tlenu = 42,9 kg |
1.69. |
0,002% SO2 w powietrzu |
1.70. |
CuO + H2 → Cu + H2O |
1.71. |
C6H12O6 |
1.72. |
22,2 g soli |
1.73. |
750 g roztworu 50%, 250 g 10% roztworu |
1.74. |
30 cząsteczek wody |
1.75. |
36,5u |
1.76. |
Cp = 20% |
1.77. |
- |
1.78. |
Cu2O |
1.79. |
75 g roztworu 40% |
1.80. |
80,5 g saletry |
1.81. |
20°C - 35 g / 100 g H2O → 70 g saletry 65°C - 120 g / 100 g H2O → 240 g saletry |
1.82. |
5°C - 20 g / 100 g H2O 80°C - 170 g / 100 g H2O wykrystalizuje 300 g saletry |
1.83. |
300 g saletry |
1.84. |
480 g H2O |
1.85. |
242 cząsteczki H2O |
1.86. |
- |
1.87. |
62u |
1.88. |
Cp = 10% |
1.89. |
41 cm3 |
1.90. |
125 g roztworu 60% i 375 g roztworu 20% |
1.91. |
A - wodór, B - siarkowodór, C - fosfor, D - tlen, E - tlenek fosforu (V), F - tlenek siarki (IV), G - kwas siarkowy (IV) |
1.92. |
Cp = 5% |
1.93. |
Fe2O3 + 3H2 → 2Fe + 3H2O |
1.94. |
0,66 g CO2 zajmującego objętość 337 cm3 |
1.95. |
|
1.96. |
Cp = 28% |
1.97. |
Cp = 28% |
1.98. |
666 cm3 H2O |
1.99. |
Odczyn kwaśny |
1.100. |
CaBr2 |
1.101. |
azotan (V) wapnia, Cp = 10% |
1.102. |
objętość H2SO2 : objętości KOH = 1 : 2 |
1.103. |
A - H2S, B - NH3, C - SO2, D - NO, E - P2O5 a - S, b - H2, d - O2, e - P, f - N2 |
1.104. |
H2CO3 |
1.105. |
Cp - 28% |
1.106. |
245 g roztworu H2SO4, co stanowi 213 cm3 |
1.107. |
- |
1.108. |
Objętość H2SO4 ; objętości NaOH = 1 : 2 |
1.109. |
Cp = 0,17% |
1.110. |
N2O5 + H2O → 2HNO3 |
1.111. |
Cp = 10% |
1.112. |
303,6 g H2O |
1.113. |
mNa : ms : mO = 23 : 16 : 24 |
1.114. |
Cp = 1% |
1.115. |
90,9% czystego CaCO3 |
1.116. |
41,3% P2O5 |
1.117. |
A - O2, B - Cu, C - H2, D - Cu2O, E - Cl2, F - CuCl2 |
1.118. |
0,18 tony |
1.119. |
75 cząsteczek H2O |
1.120. |
- |
1.121. |
BaCO3 + 2HCl → BaCl2 + H2O + CO2 |
1.122. |
168 g |
1.123. |
0,2 mola |
1.124. |
1,62 g Al |
1.125. |
54 g H2O |
1.126. |
0,5 mola H2SO4 |
1.127. |
|
1.128. |
a) 96 g S; b) 5,85 g Na Cl; c) 12 g Mg; d) 0,4 g H2 |
1.129. |
3 mole Ca, 6 moli Cl |
1.130. |
1,2 mola Al; 1,8 mola S |
1.131. |
60 g C |
1.132. |
0,27 g SO3 |
1.133. |
18,4 g Na |
1.134. |
186 g P |
1.135. |
0,2 mola Ba (OH)2 |
1.136. |
w 5 molach PbO2 |
1.137. |
0,4 mola atomów wodoru |
1.138. |
1,5 mola S |
1.139. |
masa mieszaniny = 144 g, masa O2 : masy N2 = 2 : 7 |
1.140. |
nH2 : nO2 = 2 : 1 |
1.141. |
nFe : nS = 2 : 1 |
1.142. |
1 g FeO zawiera więcej Fe, niż 1 g Fe2O3; różnica = 0,08 g |
1.143. |
0,5 mola CO2 zawiera o 0,9 g więcej C, niż 12 g CO |
1.144. |
w 15,5 g Na2O |
1.145. |
w 0,25 mola CO2 |
1.146. |
w 12,4 g Na2O |
1.147. |
w 10 molach N2O3 |
1.148. |
masa złota w 2 kg AuCl3 wynosi 1298 g |
1.149. |
40% Ca, 12% C, 48% O |
1.150. |
w 36,7 g minerału |
1.151. |
73,9% Fe |
1.152. |
a) 43,7% S, b) 45% S |
1.153. |
o 0,572 g |
1.154. |
4 g CuO; 0,1 g H2 |
1.155. |
13,5 g H2O |
1.156. |
11 g FeS |
1.157. |
HgO |
1.158. |
mPb : mO = 207 : 16 |
1.159. |
52,94% Al; 47,06 O |
1.160. |
606,8 g chloru w 1 kg NaCl; 476,5 g chloru w 1 kg KCl |
1.161. |
w 3,6 g FeO |
1.162. |
2 g tlenu |
1.163. |
w CO2 - mC : mO = 3 : 8 w CO - mC : mO = 3 : 4 |
1.164. |
420 g Si |
1.165. |
10,14 kg H2 i 359,86 kg Cl2 |
1.166. |
16,67 g 60% roztworu HNO3; 83,33 g H2O |
1.167. |
24,39% Ca; 17,07% N; 58,54% O |
1.168. |
108,5 g HgO |
1.169. |
12,2 g NaOH |
1.170. |
CP = 2,8% |
1.171. |
CP = 1,3% |
1.172. |
N2O5 |
1.173. |
Na 6 godzin |
1.174. |
N2O5 |
1.175. |
m = 24u, magnez |
1.176. |
CP = 33,3% |
1.177. |
110 g H2O |
1.178. |
X - tlen, W - woda, Y - SO2, Z - SO3, U - H2SO4 |
1.179. |
m = 63u, kwas azotowy (V) |
1.180. |
6,78 g HgO |
1.181. |
CP = 3% |
1.182. |
msoli = 1,35 kg, mH2O = 7,65 kg |
1.183. |
a) Cr2O3, b) CrO3, c) Na2CO3 |
1.184. |
MgSiO3 |
1.185. |
C6H12O6 |
1.186. |
56% CaO |
1.187. |
- |
1.188. |
1833 g Ag, 5632 g Au |
1.189. |
30 kg surówki, 70 kg słomu |
1.190. |
z pierwszego zbiornika - 9 kg, z drugiego - 3 kg |
1.191. |
Należy zmieszać 857 g 30% roztworu i 1143 g 12,5% roztworu, czyli w stosunku 3 : 4 |
1.192. |
116,6 g roztworu 35% |
1.193. |
CP = 16% |
1.194. |
1 kg pierwszego stopu i 7 kg drugiego stopu |
1.195. |
180,3 g KNO3 |
1.196. |
11,1 g |
1.197. |
CP = 16,6% |
1.198. |
masa bryłki o próbie 0,840 = 2090g masa bryłki o próbie 0,750 = 1672g |
1.199. |
25 g pierwszego stopu i 14 g stopu drugiego |
1.200. |
- |
ODPOWIEDZI DO ZADAŃ Z CZĘŚCI 2 |
|
Nr zad. |
ODPOWIEDŹ |
2.1. |
Cl-, Cr3+, Fe3+, Zn2+, Ga3+, Rb+, I- |
2.2. |
Al3+ |
2.3. |
C4H8 |
2.4. |
Cp = 10% |
2.5. |
mkwasu = 98u |
2.6. |
25% Na, 75% Hg |
2.7. |
3,67 g węglowodoru |
2.8. |
ilość kwasu jest wystarczająca; wapień zawiera 83,3% CaCo3 |
2.9. |
C3H6
H H ׀ ׀ H - C = C - C - H ׀ H |
2.10. |
C2H4 : C2H2 = 2 : 1 |
2.11. |
2 cząsteczki heptanu na 1 cząsteczkę oktanu |
2.12. |
naczynie I - CuCl2, naczynie II - HCl, naczynie III - HNO3, naczynie IV - MgSO4, naczynie V - NH3, naczynie VI - NaOH |
2.13. |
a) 2,53 g roztworu kwasu, b) kwas solny |
2.14. |
CP = 0,005% |
2.15. |
CP = 6% |
2.16. |
0,3375 g wody |
2.17. |
16,5 g FeS |
2.18. |
25,6 g Cu, 4,4 g CO2 |
2.19. |
CP = 18,43% |
2.20. |
2 cząsteczki wody na każdą cząsteczkę NaOH |
2.21. |
- |
2.22. |
0,25 mola H3BO3 |
2.23. |
CP = 12,5% |
2.24. |
21,9 g NaOH |
2.25. |
C2H6 |
2.26. |
- |
2.27. |
1,075ּ1023 atomów Fe |
2.28. |
90,3 ּ1023 atomów H |
2.29. |
0,4 mola Fe |
2.30. |
m = 206,8u; ołów |
2.31. |
9,4% zanieczyszczeń |
2.32. |
64 g S |
2.33. |
0,094 mola CO2 |
2.34. |
tak |
2.35. |
1,4 g CaO |
2.36. |
10 moli Bi |
2.37. |
17,25 g Pb |
2.38. |
1,5 mola Al. |
2.39. |
7,1 g P2O5 |
2.40. |
tak |
2.41. |
2,29 dm3 SO2 |
2.42. |
200 moli H3PO4 |
2.43. |
tak |
2.44. |
C4H10 |
2.45. |
C3H8 |
2.46. |
nC2H6 : nC3H8 = 2 : 5 |
2.47. |
30% obj. C2H6, 70% obj. C2H4 |
2.48. |
odbarwi się drugi roztwór |
2.49. |
22,8 g CaC2 |
2.50. |
CH4 |
2.51. |
7,5 dm3 tlenu |
2.52. |
1,07 g wodoru |
2.53. |
0,78 mola tlenu |
2.54. |
NO2 |
2.55. |
O3 |
2.56. |
cztery atomy |
2.57. |
2,7 dm3 CO2 |
2.58. |
6,72 dm3CO |
2.59. |
162,5 dm3 tlenu |
2.60. |
nN2O : nN2O3 = 3 : 8 |
2.61. |
C3H6 |
2.62. |
mC2H4 : mC2H2 = 51,8% : 48,2% VC2H4 : VC2H2 = 50% : 50% |
2.63. |
Miedź |
2.64. |
27% HgO w mieszaninie poreakcyjnej |
2.65. |
24% masowych NO i 76% masowych N2O5 |
2.66. |
28,57% obj. tlenu |
2.67. |
na 1 cząsteczkę kwasu przypada 20 cząsteczek wody |
2.68. |
15% zanieczyszczeń |
2.69. |
13,29 g Ca(ClO3)2ּ2H2O |
2.70. |
a) 1,7 g CaO, b) 0,487 g O2 |
2.71. |
80% Fe2O3 i 15% SiO2 |
2.72. |
Na2OּCaOּ6SiO2 |
2.73. |
na 1 mol Al przypada 0,5 mola Cu |
2.74. |
Cu2O |
2.75. |
P2O3 |
2.76. |
d |
2.77. |
d |
2.78. |
a |
2.79. |
CP = 9,17% |
2.80. |
d |
2.81. |
c |
2.82. |
b |
2.83. |
b |
2.84. |
d |
2.85. |
c |
ODPOWIEDZI DO ZADAŃ Z CZĘŚCI 3 |
|
Nr zad. |
ODPOWIEDŹ |
3.1. |
60u |
3.2. |
7,19 g (CH3COO)2Cu |
3.3. |
woda bromowa ulegnie odbarwieniu, zostanie 2,496 g C2H2 |
3.4. |
większe zużycie tlenu jest podczas spalania świecy parafinowej |
3.5. |
7 cząsteczek wody na 1 jon Fe2+; FeSO4ּ7H2O |
3.6. |
CP = 24,9% |
3.7. |
C3H8 |
3.8. |
masa cząsteczkowa estru = 102u |
3.9. |
CH3OH : C2H5OH = 2 : 3 |
3.10. |
A - KOH, B - C17H35COOH, C - C17H35COOH, D - NaOH, E - C17H35COONa, F - Ca(OH)2, G - (C17H35COO)2Ca |
3.11. |
- |
3.12. |
CH3COOH - kwas octowy, C3H7OH - propanol |
3.13. |
CP = 10% |
3.14. |
- |
3.15. |
jedno wiązanie podwójne |
3.16. |
284u |
3.17. |
chlorowodór, CP = 3,65% |
3.18. |
- |
3.19. |
110,5 g CH3Cl |
3.20. |
na 1 cząsteczkę CH3Ona przypada 9 cząsteczek CH3OH |
3.21. |
A - C2H6, B - C2H5Br, C - C2H5OH |
3.22. |
- |
3.23. |
- |
3.24. |
- |
3.25. |
3 mole wodoru |
3.26. |
- |
3.27. |
1,008 g/cm3 |
3.28. |
CH3COONaּ3H2O; 13,6 g hydratu |
3.29. |
odczyn zasadowy |
3.30. |
- |
3.31. |
- |
3.32. |
- |
3.33. |
- |
3.34. |
|
3.35. |
8,7 g C2H5OH; 11,36 g CH3COOH |
3.36. |
|
3.37. |
- |
3.38. |
- |
3.39. |
- |
3.40. |
A - HCOOH, B - C3H7OH, ester - HCOOC3H7 |
3.41. |
|
3.42. |
|
3.43. |
- |
3.44. |
C2H5COOC3H7 |
3.45. |
|
3.46. |
451,6 m3 etylenu |
3.47. |
Wydajność 84% |
3.48. |
C2H5OH : CH3OH = 1 : 1 |
3.49. |
40% C, 6,7% H, 53, 3% O |
3.50. |
C2H6O |
ODPOWIEDZI DO ZADAŃ Z CZĘŚCI 4 |
|
Nr zad. |
ODPOWIEDŹ |
4.1. |
28% masowych azotu |
4.2. |
3 cząsteczki wody na 1 cząsteczkę etanolu |
4.3. |
a) mNa = 23u, b) mMg = 24u, c) mFe = 56u |
4.4. |
50 dm3 C2H4 |
4.5. |
Ze 188 cząsteczek glicyny |
4.6. |
1357 kg rudy i 188,5 kg koksu |
4.7. |
4,9 g glukozy |
4.8. |
C57H180O6 |
4.9. |
Metal jest trójwartościowy |
4.10. |
CP = 10% |
4.11. |
C4H9OH - butanol, C2H5COOH - kwas propionowy, CH3COOCH3 - octan metylu lub HCOOC2H5 - mrówczan etylu |
4.12. |
CuSO4 |
4.13. |
11,1% obj. estru i 88,9% obj. powietrza |
4.14. |
m = 40u → wapń |
4.15. |
3,5% obj. metanolu, istnieje możliwość wybuchu |
4.16. |
CO2 |
4.17. |
CP = 10% |
4.18. |
3 atomy wodoru |
4.19. |
15775u |
4.20. |
H O ׀ ׀׀ H - C - O - C - C15H31
O ׀׀ H - C - O - C - C15H31
O ׀׀ H - C - O - C - C15H31 ׀ H
|
4.21. |
CP = 90,9% |
4.22. |
- |
4.23. |
a) CP = 18,37%, b) CP = 25,24% |
4.24. |
A - C2H5OH, B - CH3COOH, C - O2, D - CO2, E - CH3COONa |
4.25. |
ubywa tlenu, jego gęstość jest większa od gęstości azotu |
4.26. |
azot |
4.27. |
Al4C3 |
4.28. |
HBr |
4.29. |
16,8 g wody |
4.30. |
25 cm3 30% perhydrolu |
4.31. |
CP = 2,7% |
4.32. |
220,45 cm3 wody, 30,13 cm3 kwasu solnego |
4.33. |
C5H10O5 - pentoza |
4.34. |
mC2H5OH = 46u |
4.35. |
C2H5COOH |
4.36. |
a) C, b) A, c) B, d) D |
4.37. |
3 grupy OH |
4.38. |
mK = 39u, KBr |
4.39. |
MK = 39,8 g, potas |
4.40. |
36,24 g NH3 |
4.41. |
CP = 10% |
4.42. |
dodać 85 g 20% roztworu AgNO3 |
4.43. |
10% zanieczyszczeń |
4.44. |
2 : 1 |
4.45. |
rozpuści się 177 g NaNO3, 43 g pozostaną nie rozpuszczone |
4.46. |
|
4.47. |
5,4 g Ag, co stanowi 0,05 mola |
4.48. |
Na2CO3 bardziej zasadowy |
4.49. |
CP = 1% |
4.50. |
8,2 g CH3COONa, co stanowi 0,1 mola, co stanowi 6,02∙1023 cząsteczek |
4.51. |
wapno palone zawierało 85,8% CaO |
4.52. |
wykrystalizuje 122,26 g Pb(NO3)2, CP = 41,2% |
4.53. |
Y - H2O, X - O2, Z - Ca(OH)2, W - CaO |
4.54. |
w mieszaninie jest 11,7 g NaCl, użyto 680 g 5% roztworu AgNO3 |
4.55. |
naczynie z metanem - 2 mole CaCO3 pozostałe naczynia po 4 mole CaCO3 |
4.56. |
zasadowy odczyn mają roztwory: K2CO3, Na2S, CH3COONa, Ba(OH)2, NH3, C15H31COOK kwaśny odczyn mają roztwory: (NH4)2SO4, CH3COOH, Al2(SO4)3 obojętny odczyn mają roztwory: CaCl2, NaBr, K2SO4, C2H5OH |
4.57. |
11,875 g sacharozy - C12H22O11 |
4.58. |
48 g Al4C3 i 2 dm3 2 - molowego kwasu solnego |
4.59. |
1,36 g C2H5Ona |
4.60. |
Cm = 0,306 mol/dm3 |
4.61. |
CP = 24,87% |
4.62. |
do 400 cm3 wody |
4.63. |
1,2 mola substancji |
4.64. |
w 4 dm3 roztworu |
4.65. |
Cm = 3 mol/dm3 |
4.66. |
Cm = 0,5 mol/dm3 |
4.67. |
2,925 g NaCl |
4.68. |
w 1 dm3 |
4.69. |
Cm = 2,27 mol/dm3 |
4.70. |
CP = 39,8% |
4.71. |
Cm = 2,78 mol/dm3 |
4.72. |
w 10 cm3 roztworu |
4.73. |
Cm = 0,07 mol/dm3 |
4.74. |
dodać 100 cm3 wody |
4.75. |
Cm = 0,83 mol/dm3 |
BIBLIOGRAFIA
Zadania od łatwych do trudnych - Krzysztof M. Pazdro, Maria Koszmider
Zbiór zadań dla szkół średnich - Andrzej Reych
Zadania dla uczestników konkursów chemicznych - Anna Rygielska
Zbiór zadań z chemii dla liceum ogólnokształcącego - Krzysztof Pazdro
Chemia z zadaniami dla uczniów szkół podstawowych - A.Reych
Chemia z zadaniami dla uczniów kl.7 i 8 - K. Pazdro, M. Kaszmider
Chemia - zbiór zadań - 7/8 - Bożena Kałuża, Andrzej Reych
Chemia w pytaniach, zadaniach i odpowiedziach dla uczniów szkół podstawowych - Bożena Kałuża, Andrzej Reych
Konkursy matematyczne - wybór zadań Krystyna Dworecka, Zbigniew Kochanowski.
ZESTAW ZADAŃ Z CHEMII - OPRACOWAŁA mgr JOLANTA TURNIAK
- 17 -
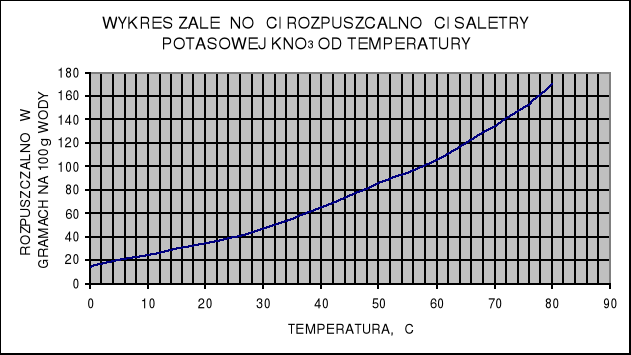
a
b
+
d
e
f
A
B
C
D
E
+
d
+
a
+
+
b
+
H2O
H2O
+
d
+
A
B
C
D
E
F
H2O
CuO
HCl
+
+
+
+
+
S
O2
P
........
O2
.........
O2
H2O
........
MgO
........
H2O
........
NaOH
........
........
........
H2O
Na2O
........
Na2O
H2
S
X
Y
W
Z
U
+
+
+
+
X
V2O5 (katalizator)
Na
+ H2O
?
Na2SO3
?
+ H2O
?
+ O2
S
+
H2O
G
F
E
D
C
B
+
+
+
A
+
D
+
H2O
CH3COOC2H5
B
H2O
Br2
A
C
KOH
CH3COOH
KOH
C
CH4
Cl2
B
A
Na
B
A
B
Br2
KOH
CH3-CH2-OH
A
B
Br2
NaOH
CH2 − CH2
OH OH
CH2 = CH2
H2O
potas
A
B
H2O
A
KOH
H2O
+
A
CH3COOH
HCOOCH3
B
C
A
Br2
CH3COOC2H5
B
D
+
C
A
H2O
CH3COOC2H5
B
D
E
+
H2O
NaOH
+
+
+
+
H2O
+
H2O
C
+
B
D
CaCO3
CaO
Ca(OH)2
CaCO3
CaSiO3
C
A
H2
+
+
+
H2
+
W
Ca
Y
X
Z
Y
Z
Z
+
H3PO4
G
D
S
+
+
+
+
H2O
F
E
C
B
A
NaOH
D
D
+
+
+
+
NaOH
E
C
B
A
+
Wyszukiwarka
Podobne podstrony:
8. Indukcja elektromagnetyczna. Prad przemienny, budownictwo PG, fizyka, zadania, zbior zadan
więcej podobnych podstron