Podaj liczbę protonów i elektronów w jonie ![]()
![]()
Rozwiązania testów matury próbnej w roku szkolnym 2005/2006
POZIOM PODSTAWOWY
Informacja do zadania 1,2
W jednym z najtrwalszych szeregów promieniotwórczych występują między innymi trzy izotopy polonu, których okresy półtrwania podano w nawiasach:218Po (3,1 minuty); 214Po (1,6ּ10-4 sekundy) i 210Po (138,4 dnia)
Zadanie 1
Podaj liczbę masową najtrwalszego izotopu polonu wybranego spośród wymienionych powyżej
O trwałości wymienionych nuklidów świadczą ich okresy połowicznego rozpadu τ (tau). Największą wartość okresu połowicznego rozpadu posiada nuklid (izotop) 210Po, liczba masowa tego nuklidu równa się 210.
Zadanie 2
Podaj symbol. Liczbę masową i liczbę atomową izotopu, który powstał z izotopu 218Po po emisji cząstki α.
Symbol powstałego izotopu: Pb
Liczba masowa powstałego izotopu: 214
Liczba atomowa powstałego izotopu 82
Zadanie 3
Podaj liczbę protonów i elektronów w jonie ![]()
![]()
Liczba protonów: 26
Liczba elektronów: 23
Zadanie 4
Korzystając z tabeli elektroujemności, oblicz różnicę elektroujemności miedzy atomami fosforu i wodoru, a następnie na tej podstawie określ rodzaj wiązania pomiędzy atomami wodoru i fosforu występujących w związku o wzorze PH3.
Różnica elektroujemności: elektroujemność fosforu wynosi 2,1, tyle samo wynosi elektroujemność wodoru. Tak więc różnica elektroujemności równa się zero a tym samym wiązanie jest wiązaniem atomowym lub inaczej kowalentnym (kowalencyjnym)
Różnica elektroujemności : równa się zero
Rodzaj wiązania: kowalencyjne
Zadania 5
Oblicz zawartość procentową ( w procentach masowych) bromu w bromku wapnia.
Obliczenia:
Obliczenie masy molowej CaBr2
- 1 mola wapnia - 40 g
- 2 mole bromu -160 g
Masa molowa - 200 ![]()
Masa molowa bromku wapnia, czyli 200g stanowi 100%
Zawartość wapnia, czyli 40g stanowi x%
X= ![]()
Odpowiedź: Zawartość procentowa wapnia w bromku wapnia wynosi 20% (masowych)
Uwaga: Procent masowy oznacza procentowy udział masy wapnia w masie molowej chlorku wapnia
Informacje do zadań 6. i 7.
W tabeli przestawiono rozpuszczalność dwóch soli w zależności od temperatury
Temperatura, K |
273 |
293 |
313 |
333 |
353 |
RKCl, g/100gwody |
28 |
34 |
40 |
46 |
51 |
|
14 |
32 |
63 |
109 |
170 |
Zadanie 6
Uzupełnij kolejne zdania I, II, III, i IV, posługując się określeniami z poniższego zbioru: KCl, KNO3, nasycony, nienasycony, ochłodzić, ogrzać, dodać sól.
Solą lepiej rozpuszczalną w wodzie, w temperaturze 293 K jest - KCl
Rozpuszczając 60 g KNO3 w 100 g wody w temperaturze 313 K otrzymamy roztwór nienasycony
W celu przeprowadzenia nasyconego roztworu KNO3 w roztwór nienasycony tej soli należy go ogrzać
Aby wytrącić osad KCl z nasyconego roztworu tej soli należy ten roztwór ochłodzić
Zadanie 7
Narysuj wykres zależności rozpuszczalności KCl w wodzie od temperatury i odczytaj wartość rozpuszczalności w temperaturze 303K.
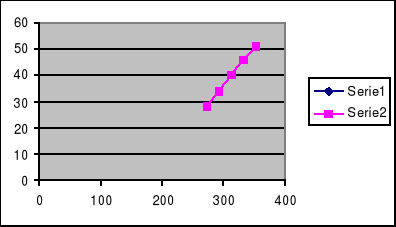
Rozpuszczalność KCl w wodzie w temperaturze 303 K wynosi 37 g
Zadanie 8
A/ Korzystając z tablicy rozpuszczalności, zamieszczonej w dołączonej karcie wybranych tablic chemicznych podaj wzór sumaryczny związku chemicznego, którego wodny roztwór może być użyty do rozróżnienia roztworów KCl i KNO3 na drodze reakcji strącania osadów.
Kationem, który umożliwi rozróżnienie anionu chlorkowego i azotanowego może być przykładowo kation srebra (strąca serowaty osad chlorku srebra) lub kation ołowiu(II). Oczywiście wybieramy azotany (V) wymienionych kationów ponieważ te sole są rozpuszczalne w wodzie.
Wzór sumaryczny : to np. AgNO3 lub Pb(NO3)2
Zadanie 9
Podaj w jakiej kolejności i przy wyborze jakich metod wydzielisz chlorek sodu i piasek z mieszaniny piasku i wodnego roztworu chlorku sodu
Najpierw wydzielam: piasek. który tworzy osad w mieszaninie z wodą
Następnie wydzielam, przez odparowanie wodą i pozostaje chlorek sodu
Zastosowane metody: piasek na drodze sączenia zaś chlorek sodu jako pozostałość po odparowaniu z roztworu wody.
Zadanie 10
Badając wpływ różnych czynników na szybkość reakcji chemicznej przeprowadzono w tych samych warunkach ciśnienia i temperatury dwa doświadczenia.
Doświadczenie I: Do 10 cm3 kwasu solnego o stężeniu 20% dodano 1 gram wiórków magnezu
Doświadczenie II: Do 10 cm3 kwasu solnego o stężeniu 5% dodano 1 gram ewiórków magnezowych.
Podaj numer doświadczenia, w którym reakcja przebiegała szybciej i wskaż czynnik, który to spowodował.
Numer doświadczenia: Reakcja przebiegała szybciej w doświadczeniu nr 1
Czynnik: Szybszy przebieg reakcji był spowodowany większym stężeniem roztworu kwasu solnego.
Zadanie 11
Metodą bilansu elektronowego dobierz współczynniki stechiometryczne w równaniu reakcji:
......NH3 + .....O2 → ......N2 + ......H2O
Bilans elektronowy: 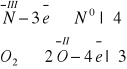
4NH3 + 3O2 → 2N2 + 6H2O
Zadanie 12
Wskaż substancję pełniącą role utleniacz i reduktora w procesie opisanym równaniem
Zn + S → ZnS
Utleniacz: Role utleniacza pełni siarka, która się zredukowała do jonu siarczkowego S2-
Reduktor: Reduktorem jest cynk, który się utlenił do jonu Zn2+
Zadanie 13
Poniżej podano wybrane metody otrzymywania soli
kwas + wodorotlenek
kwas + tlenek metalu
kwas + metal
tlenek niemetalu + wodorotlenek
Spośród podanych wyżej metod wybierz dwie, które można zastosować do otrzymania siarczku potasu. Napisz w formie cząsteczkowej równania reakcji ilustrujące wybrane metody:
Równanie 1: H2S + 2KOH → K2S + 2H2O
Równanie 2: H2S + K2O → K2S + H2O
Równanie 3: H2S + 2K → K2S + H2
UWAGA: metoda podana pod numerem cztery jest właściwa jedynie dla kwasów tlenowych (zawierających w cząsteczkach tlen !)
Informacja do zadań 14 i 15
Ze względu na trudności techniczne podaję opis rysunku: czteru ptrobówki z wodą do których wprowadzono kolejno: I - tlenek węgla(II); II - tlenek siarki(IV); III - tlenek krzemu(IV); IV - tlenek sodu.
Do każdej z probówek zanurzono papierek uniwersalny.
Zadanie 14
Podaj numery probówek, w których papierek uniwersalny zmienił zabarwienie.
Zmiana barwy nastąpiła w probówkach II oraz IV.
Zadanie 15
Podaj numer probówki, w której otrzymano roztwór o odczynie kwasowym
Odczyn kwasowy ( barwa czerwona wystąpiła w probówce II
Zadanie 16
Uzupełnij poniższe zdanie wstawiając w miejsce kropek znak: „<” lub „>”.
Roztwory o odczynie kwasowym mają pH <7
Zadanie 17
W miejsce kropek wstaw wzory brakujących reagentów i współczynniki stechiometryczne
4Al + 3O2 → 2Al2O3
2 K + 2H2O → 2KOH + H2
SO3 + H2O → H2SO4
Zadanie 18
Wybierz i zakwalifikuj do odpowiednich grup substancje o wzorach sumarycznych: HCl, HNO2, H2S, HNO3, Zn(OH)2, HBr, H2SO4, KOH, Ba(OH)2,
kwasy beztlenowe: HCl, H2S, HBr
mocne kwasy tlenowe: HNO3, H2SO4
wodorotlenki rozpuszczalne w wodzie: ( wodorotlenki rozpuszczalne inaczej zasad , tworzą litowce i niektóre berylowce): KOH, Ba(OH)2
Zadanie 19
Przeprowadzono kilka doświadczeń z użyciem bezbarwnego gazu. Stwierdzono, że gaz ten:
jest palny
nie odbarwia wody bromowej
w wyniku spalenie w tlenie daje tylko jeden produkt
Wskaż gaz, który użyto w doświadczeniu:
Chlor - odpada, gdyż jest gazem barwnym i jako fluorowiec aktywniejszy od bromu odbarwia wodę bromową
Metan - odpada, gdyż wprawdzie jako alkan nie odbarwia wody bromowej i spala się jednak w wyniku spalenia daje dwa produkty (dwutlenek węgla i parę wodną)
Acetylen - jest alkinem więc odbarwia wodę bromową i spala się dają dwa produkty
Wodór - jest gazem spełniającym wszystkie wymienione warunki
Zadanie 20
Spośród podanych poniżej substancji wybierz tę, którą można zastosować do wykrycia tlenku węgla(IV)
woda amoniakalna - nie daje efektu
woda bromowa - stosowana do wykrywania wiązań wielokrotnych w węglowodorach nienasyconych
woda sodowa - sama jest nasyconym roztworem dwutlenku węgla
woda wapienna, czyli wodny roztwór wodorotlenku wapnia. Następuje zmętnienie wody wapiennej w wyniku utworzenia trudno rozpuszczalnego węglanu wapnia. Proces biegnie zgodnie z równaniem: Ca(OH)2+CO2→CaCO3+H2)
Zadanie 21
Tlenek węgla(IV) powstaje m.in. w reakcji fermentacji alkoholowej glukozy w obecności drożdzy oraz podczas termicznego rozkładu wapienia.
Napisz równania obu reakcji w formie cząsteczkowej
Równanie reakcji fermentacji alkoholowej glukozy:
C6H12O6 → 2C2H5OH + 2CO2
Równanie reakcji rozkładu wapienia:
CaCO3 ![]()
CaO + CO2
Informacja do zadań 22 i 23
Proces spalania pewnego węglowodoru przebiega według równania
C4H8(gaz) → 4CO2 + 4H2O(gaz)+ energia cieplna
Zadanie 22
Procesy chemiczne można między innymi zakwalifikować do poniższych grup reakcji
egzotermiczna
endotermiczna
spalania całkowitego
spalania niecałkowitego
Wskaż grupy reakcji, do których można zaliczyć proces opisany w informacji wstępnej
I i III odpowiedź prawidłowa
I i IV
II i III
II i IV
Zadanie 23.
Oblicz ile dm3 tlenu odmierzonego w warunkach normalnych należy użyć do spalenia węglowodoru C4H8 (zgodnie z równaniem reakcji podanej w informacji wstępnej), aby otrzymać 10 moli CO2
Obliczenia:
Z równania reakcji spalania (informacja) wynika, że:
6 moli tlenu czyli 6x 22,4 dm3 (objętość molowa gazów) daje 4 mole CO2
x dm3 tlenu daje 10 moli CO2
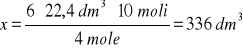
Odpowiedź: Aby otrzymać 10 moli tlenku węgla(IV) należy zużyć 336 dm3 tlenu
Zadanie 24
Narysuj wzór półstrukturalny (grupowy) jednego izomeru węglowodoru o wzorze sumarycznym C4H8 i podaj jego nazwę systematyczną
Wzór półstrukturalny: CH2=CH2-CH2-CH3 jeden z możliwych izomerów
Nazwa systematyczna: but -1-en
Uwaga - inne możliwości to but -2-en ( w wariancie izomerów geometrycznych cis- otaz trans-. Alkeny są również izomerami cyklalkanów, tak więc możliwy jest również izomer o nazwie cyklobutan
Informacja do zadań 25 - 27
Związek organiczny CH3CH2CHO ulega przemianom chemicznym opisanym za pomocą poniższego schematu
CH3CH2CHO 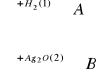
A + B![]()
Zadanie 25
Napisz równania reakcji opisane numerami 1, 2 i 3stosując wzory półstrukturalne reagentów
Równanie 1. CH3CH2CHO + H2→ CH3CH2CH2OH
Równanie 2. CH3CH2CHO + Ag2O→CH3CH2COOH + 2Ag
Równanie 3:
CH3CH2COOH + CH3CH2CH2OH ![]()
CH3CH2COOCH2CH2CH3 + H2O
Kwas siarkowy(VI) a konkretnie jony wodorowe pełnią rolę katalizatora w reakcji estryfikacji. Kwas siarkowy, dzięki właściwościom higroskopijnym wiąże produkt reakcji - wodę, powodując przesunięcie równowagi reakcji w stronę produktów (reguła przekory)
Zadanie 27
Podaj nazwę grupy związków organicznych do której należy związek wyjściowy CH3CH2CHO związek ten należy do grupy aldehydów
Zadanie 27
Wskaż prawidłowy wzór sumaryczny sacharozy
C6H12O6
C12H22O11- wzór prawidłowy, gdyż sacharoza powstaje w wyniku kondensacji heksoz (glukozy i fruktozy)
C12H24O12
C18H32O16
Zadanie 29
Spośród podanych poniżej opisów reakcji chemicznych wypisz numery tych, którym ulegają aminokwasy.
reakcje z kwasami prowadza do otrzymania soli
reakcje z wodorotlenkami prowadzą do otrzymania soli8
reakcje z wodą prowadzą do otrzymania polipeptydów
reakcje z aminokwasami prowadzą do otrzymania polipeptydów
Aminokwasy ulegają reakcjom nr I, II, III
Zadanie 30
Wskaż nazwę reakcji, która zajdzie gdy białko jaja kurzego podziałamy alkoholem etylowym
kondensacja
denaturacja, proces nieodwracalny spowodowany uszkodzeniem struktury III - rzędowej białka
Peptyzacja
Estryfikacja
Koniec wersji podstawowej, dalsze zadania to już wersja rozszerzona
Informacja do zadań 31 - 33
Atomy pierwiastka E mają w stanie podstawowym konfigurację elektronową: 1s22s22p63s23p64s23d104p4
Zadanie 31
Podaj liczbę elektronów niesparowanych (w stanie podstawowym) i liczbę elektronów walencyjnych w atomach pierwiastka E.
Liczba elektronów niesparowanych: 4p4 - cztery elektrony w trzech orbitalach p oznacza, że dwa elektrony będą niesparowane
Liczba elektronów walencyjnych: czyli elektronów znajdujących się na orbitalach o największych wartościach głównej liczby kwantowej czyli w omawianym przykładzie będzie to 4s2 i 4p4 czyli łącznie sześć elektronów walencyjnych
Zadanie 32
Odczytaj symbol pierwiastka E z układu okresowego pierwiastków i napisz wzór sumaryczny tlenku pierwiastka E na najwyższym stopniu utlenienia i wzór sumaryczny wodorku pierwiastka E
Pierwiastek E znajduje się w czwartym okresie (maksymalna wartość głównej liczby kwantowej) i grupie 16 - pierwiastek E to selen Se (można sprawdzić czy suma podanych w zapisie elektronów odpowiada liczbie atomowej selenu). Z położenia selenu wynikają jego wartościowości w połączeniach z wodorem, od którego przejmuje elektrony ponieważ jest bardziej od wodoru elektroujemny i dlatego wykazuje wartościowość -2 - wzór wodorku H2Se (analogiczny wzór ma połączenie siarki z wodorem gdyż siarka znajduje się w tej samej grupie !). Maksymalna wartościowość tlenku to VI, gdyż tyle elektronów walencyjnych posiada i oddaje je bardziej elektroujemnemu tlenowi, wzór tlenku to SeO3
Zadanie 33
Napisz jakie znaczenie można przypisać liczbie 3 w zapisie 3d10
Wartość 3 oznacza, że w atomie nastąpiło zapełnienie podpowłoki d w powłoce 3.
Zadanie 34
Pewien metal reaguje z chlorem cząsteczkowym dając sól o wzorze sumarycznym ECl3 Stwierdzono, że 2,8 g tego metalu łączy się z 0,075 mola chloru cząsteczkowego
Napisz symbol metalu jakiego użyto do reakcji. Wykonaj i zapisz niezbędne obliczenia.
Obliczenia:
Jako, że podano wartościowość metalu E, można zapisać równanie reakcji, na podstawie której będzie można dokonać obliczenia masy molowej pierwiastka E (ME) i w ten sposób dokonać jego identyfikacji: 2E + 3Cl2 → 2ECl3
Z równania reakcji wynika, że 2ME reagują z 3 molami chloru
Z treści zadania wynika, że 2,8gE reaguje z 0,075 mola chloru
![]()
Pierwiastkiem tym jest żelazo Fe
Informacje do zadań 35 - 37
W reakcji przebiegającej według równania 2 CO2(g)↔2CO(g) + O2(g) w pewnych warunkach ciśnienia i temperatury ustalił się stan równowagi. Entalpia tego procesu ∆H>0.
Zadanie 35
Napisz wyrażenie na stężeniową stałą równowagi powyższej reakcji.
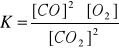
Zadanie 36
Określ, czy reakcja rozkładu tlenku węgla(IV) w tych warunkach ciśnienia i temperatury jest reakcją egzotermiczną, czy endotermiczną.
O rodzaju procesu termicznego świadczy podana wartość zmiany entalpii. Wartość dodatnia oznacza, że energia układu po reakcji jest większa niż przed reakcją a więc do jej przebiegu niezbędne jest dostarczenie energii (ciepła), tak więc reakcja rozkładu dwutlenku węgla jest reakcją endotermiczną
Zadanie 37
Podaj, jak wpływa na ilość produktów powstających w reakcji rozkładu tlenku węgla(IV) zmiana warunków prowadzenia reakcji polegająca na:
A/ zmniejszeniu objętości naczynia reakcyjnego - zmniejszenie objętości naczynia reakcyjnego oznacza sprężenie substratów reakcji czyli wzrost ciśnienia. Jako, że objętość produktów jest większa od objętości substratów zmniejszenie objętości, czyli wzrost ciśnienia powoduje przesunięcie równowagi reakcji w lewo
B/ ogrzanie zawartości naczynia reakcyjnego - ogrzanie układu sprzyja reakcji przebiegającej z pobraniem ciepła a więc w podanym przykładzie nastąpi przesunięcie równowagi reakcji w prawo.
C/ sytuacja odwrotna od podanej w punkcie A. Również przesunięcie równowagi w kierunku odwrotnym, czyli w prawo
Zadnie38
Wykorzystując dane z szeregu elektrochemicznego metali napisz schemat ogniwa, w którym elektroda cynkowa pełni role anody. Zapisz równanie reakcji zachodzącej w półogniwie cynkowym
Dobieramy drugi metal w ten sposób, że skoro cynk ma być anodą, czyli ma się utleniać, drogi metal musi wykazywać mniejszą aktywność czyli jego potencjał elektrochemiczny musi mieć wartość bardzie dodatnie. Takim metalem może być przykładowo miedź
Schemat ogniwa: Zn0 | Zn2+ || Cu2+ | Cu0
Równanie reakcji: Zn0→ Zn2+ + 2![]()
Zadanie 39
W warunkach standardowych SEM ogniwa metalicznego, w którym jednym z półogniw jest półogniwo srebrowe wynosi 1,20 V.
W szeregu elektrochemicznym metali wyszukaj drugie półogniwo (elektrodę) zastosowane w tym ogniwie i określ, czy pełni ono rolę katody czy anody.
Półogniwo (elektroda) - skoro SEM równa się 1,2 V zaś potencjał elektrochemiczny srebra wynosi + 0,8 V. Z wzoru na SEM = EK-EA, łatwo ustalić, że druga elektroda będzie miała potencjał bardziej ujemnu od srebra, a więc jego wartość będzie wynosiła - 0,4V. Z szeregu odczytujemy, że metalem tym jest kadm
Rola w ogniwie - jako, że potencjał tej elektrody jest bardziej ujemny od srebra, będzie w ogniwie pełniła rolę elektrody o znaku „-„ a tym samym będzie anodą ( kadm będzie się utleniał).
Zadanie 40
W laboratorium przeprowadzono następujące doświadczenie: Do zlewki zwierającej kilka cm3 bezbarwnej cieczy dodano kilka cm3 wodnego roztworu KMnO4 a następnie kilka cm3 wodnego roztworu Na2SO3. Zaobserwowano odbarwienie powstałego roztworu.
Napisz, czy znajdująca się w zlewce przed rozpoczęciem doświadczenia bezbarwna ciecz to była woda, wodny roztwór kwasu, czy roztwór zasady. Uzasadnij swą odpowiedź, pisząc równanie reakcji w formie skróconej jonowej. Współczynniki uzgodnij metodą bilansu elektronowego.
Bezbarwna ciecz to : kwas, gdyż tylko w środowisku kwaśnym manganian (VII) redukuje się do jonów manganu dwa.
Równanie reakcji: ![]()
Bilans elektronowy:
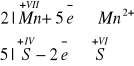
Zadanie 41
Oblicz stężenie molowe 40% roztworu NaOH o gęstości 1,43 g/cm3
Jest to typowe przeliczenie stężenia, w którym korzystamy z gotowego wzoru
![]()
gdzie: cp= 40%
d = 1,43 g/cm3 x 1000 cm3 = 1430 g/dm3
MNaOH = 40 g/mol
Wstawiając te wartości do podanego wzoru uzyskujemy szukaną wartość stężenia molowego cm = 14,3 mol/dm3
Odpowiedź: stężenie molowe roztworu wodorotlenku sodu jest równe 14,4 mol/dm3
Zadanie 42
Mając do dyspozycji potas, miedź, wodę i rozcieńczony roztwór kwasu azotowego(V) zaprojektuj trójetapowe otrzymywanie wodorotlenku miedzi(II). Napisz równania kolejnych reakcji chemicznych.
Opis słowny projektu: Na miedź działamy kwasem azotowym(V) otrzymując roztwór azotanu miedzi(II). W drugiej probówce działamy potasem na wodę otrzymując zasadę potasową. Następnie zlewamy zawartości naczyń doprowadzając do reakcji wytrącenia osadu wodorotlenku miedzi(II)
Równanie reakcji etapu I 3Cu + 8HNO3 → 3Cu(NO3)2+ 2NO + 4H2O powstaje jako produkt NO, gdyż działamy rozcieńczonym kwasem azotowym(V)
Równanie reakcji etapu II: 2K + 2H2O → 2KOH + H2
Równanie reakcji etapu III: 2KOH + Cu(NO3)2→ Cu(OH)2(↓) + 2KNO3
Zadanie 43
Przygotowano dwa wodne roztwory kwasu octowego o różnych stężeniach molowych ( w warunkach standardowych). Stężenia molowe jonów wodoru w obu roztworach były jednakowe W roztworze I stopień dysocjacji CH3COOH wynosił 1% a w roztworze II wynosił 0,1%.
Podaj, który roztwór był bardziej stężony. Odpowiedź uzasadnij.
Bardziej stężony był roztwór II, gdyż wartość stopnia dysocjacji jest odwrotnie proporcjonalna do stężenia. Większe stężenie mniejsza wartość stopnia dysocjacji.
Zadanie 44
Podaj wzór jonu pochodzącego z dysocjacji kwasu siarkowodorowego, którego stężenie w roztworze tego kwasu jest najmniejsze.
Najmniejsze będzie stężenie jonu siarczkowego S2-
Zadanie 45
Określ jaką rolę (kwasu czy zasady) pełnią jony HS- wg teorii Brönsteda - Lowry'ego w reakcji zilustrowanej równaniem: HS- + H3O+ ↔ H2S + H2O
Jony HS- będąc protonobiorcami pełnią rolę zasad
Zadanie 46
Podaj odczyn wodnych roztworów następujących soli
(Jest to pytanie o rodzaj hydrolizy soli)
Na2SO3 -odczyn zasadowy, gdyż jest to sól mocnej zasady i słabego kwasu
Na2SO4 - obojętny, gdyż nie ulega hydrolizie
NaHCO3 - słabo zasadowy, gdyż stała dysocjacji pierwszego etapu kwasu węglowego jest znacznie większa niż wartość drugiej stałej dysocjacji tego kwasu
Zadanie 47
Podaj wzór półstrukturalny (grupowy) i nazwę systematyczną alkanu zawierającego jeden IV - rzędowy atom węgla, jeden III - rzędowy atom węgla, dwa II - rzędowe atomy węgla i pięć I - rzędowych atomów węgla
CH3
|
CH3-C-CH2-CH -CH2 - CH3 2,2,3 -trimetyloheksan
| |
CH3 CH3
Zadanie 48
Poniższy schemat ilustruje trzy metody otrzymywania etanu:
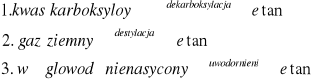
Stosując wzory półstrukturalne (grupowe) napisz równania odpowiednich reakcji chemicznych lub zaznacz, że metoda opiera się na przemianie fizycznej.
CH3-CH2-COOH → CH3-CH3 + CO2
destylacja to proces fizyczny polegający na rozdzieleniu mieszanin cieczy i gazów o różnych temperaturach wrzenia
CH2=CH2 + H2→ CH3-CH3
Zadanie 49
Glicyna jest najprostszym aminokwasem o wzorze H2N-CH2-COOH.
Napisz wzory półstrukturalne (grupowe) jonów, które tworzy glicyna w roztworach:
a) o o pH = 9 H2N-CH2-COO-
b) o pH = 3 +H3N-CH2-COOH
Zadanie 50
Zaprojektuj doświadczenie pozwalające odróżnić wodne roztwory glukozy i sacharozy. W tym celu:
wybierz potrzebne odczynniki spośród: HNO3 stęż., wodne roztwory AgNO3, CuSO4, NaOH, KMnO4
opisz słownie przebieg doświadczenia
zapisz przewidywane obserwacje
na podstawie obserwacji sformułuj wniosek pozwalający odróżnić oba roztwory
Odczynniki: CuSO4, NaOH, - w celu przeprowadzenia próby Trommera, do ewentualnego przeprowadzenia próby Tollensa brak wśród odczynników niezbędnego wodorotlenku amonu
Opis przebiegu doświadczenia - do roztworu siarczanu miedzi(II) dodać roztworu NaOH w celu wytrącenia osadu wodorotlenku miedzi(II). Zawartość probówek rozdzielić do dwóch dodając do jednej roztworu jednego a do drugiej drugiego badanego roztworu. Zawartość probówek łagodnie ogrzewać.
Obserwacje - w probówce z roztworem glukozy zawartość przyjmie ceglastą barwę właściwą dla tlenku miedzi(I), gdyż glukoza wykazuje właściwości redukujące
Wniosek - w probówce, której zawartość spowodowała wystąpienie barwy ceglastej znajdował się roztwór glukozy.
Zadanie 51
Zaznacz gwiazdką asymetryczne atomy węgla w podanym niżej wzorze cząsteczkowym oraz wyjaśnij dlaczego związek ten nie wykazuje czynności optycznej
O
||
C - OH
|
H - C٭ - OH
|
H - C٭ - OH
|
C - OH
||
O
Cząsteczka kwasu winowego (taka jest nazwa zwyczajowa związku, którego wzór podano)o podanej budowie cząsteczki nie wykazuje czynności optycznej z powodu symetrycznej budowy cząsteczki. Płaszczyznę symetrii można przeprowadzić między asymetrycznymi atomami węgla. Taka forma nosi nazwę odmiany mezo (kwas mezowinowy)
Zadanie 52
Poniżej przedstawiono fragmenty cząsteczek dwóch tworzyw sztucznych A i B
A: [-NH-(CH2)5-CO-NH-(CH2)5 - CO -]
B: [- CH2 - CHCl - CH2 - CHCl -]
Podaj wzory półstrukturalne (grupowe) substratów stosowanych do otrzymania tworzyw A i B
Substrat stosowany do otrzymania tworzywa A: NH2 - (CH2)5 - COOH
Substrat stosowany do otrzymania tworzywa B: CH2 = CHCl
9