A2 + B2 2 AB
1/ 3 |
2/ 3 |
3/ 4 |
4/ 3 |
5/ 3 |
6/ 2 |
7/ 4 |
8/ 3 |
9/ 5 |
10/4 |
11/5 |
12/ 4 |
13/ 4 |
14/ 4 |
15/ 2 |
Σ 53 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Egzamin z chemii po I roku studiów na Wydziale Lekarskim
Akademii Medycznej
......................................................................... Bydgoszcz, 11 czerwca 2004
imię i nazwisko
ZESTAW A
Roztwór zawiera 5% NaCl, 5% KCl i 5% KBr. Jakich jonów jest w tym roztworze
najwięcej przy założeniu, ze stopnie dysocjacji wymienionych soli są w tym roztworze równe 100% ? Odpowiedź uzasadnij stosownymi obliczeniami. ( 3 pkt )
(Na-23, Cl-35.5, K-39, Br-80)
Przygotowano po 10 cm3 0,1 molowych wodnych roztworów dziesięciu substancji,
zmieszano je w probówkach parami:
H2SO4 i NaOH
HNO3 i Ba(OH)2
HCl i NH3
CH3COOH i KOH
HCl i AgNO3
i do każdej z tych probówek dodano roztworu fenoloftaleiny. W której ( których ) probówkach fenoloftaleina pozostanie bezbarwna? Odpowiedź uzasadnij. ( 3 pkt )
Ile 0,05 mol/l roztworu NaOH trzeba dodać do 20 cm3 0,1 mol/l roztworu HCl aby pH otrzymanego roztworu było 2. (4 pkt)
W jakim stosunku molowym zmieszano substancję A2 z substancją B2 jeżeli do momentu ustalenia się stanu równowagi reakcji :
A2 + B2 2 AB
przereagowało 80 % związku A2 z utworzeniem produktu AB ( stała równowagi reakcji K = 16 ) ( 3 pkt )
Dla podanych układów redoks potencjały standardowe wynoszą:
MnO2 + 4H+ + 2e 2H2O + Mn2+ Eo = + 1,28 V
Cr2O72- + 14 H+ + 6e 7 H2O + 2 Cr3+ Eo = + 1,36 V
Cl2 + 2e 2Cl- Eo = + 1,36 V
MnO4- + 8H+ + 5e 4H2O + Mn2+ Eo = + 1,52 V
Na tej podstawie odpowiedz na następujące pytania :
czy w środowisku kwaśnym MnO4- może być utleniaczem jonów Cl- do Cl2 ?
czy w środowisku kwaśnym jony Cr2O72- mogą utlenić jony Cl- do Cl2 ?
czy w środowisku kwaśnym jony MnO4- mogą utlenić jony Cr3+ do Cr2O72- ?
Odpowiedzi uzasadnij. ( 3 pkt )
Żelazo występuje na Ziemi w postaci mieszaniny izotopów - głównie 54Fe(5,82%), 56Fe(91,18%), 57Fe(2,1%), 58Fe(0,28%). Które z twierdzeń można uznać za prawdziwe:
żelazo zawarte w hemoglobinie zawiera więcej lżejszych izotopów niż żelazo zawarte w glebie,
izotopy mają te same właściwości chemiczne i skład izotopowy w minerałach i organizmach żywych jest taki sam. (2 pkt)
Do 1000 cm3 obojętnego wodnego roztworu zawierającego 1 mol L-alaniny dodano 0,3 mola NaOH. Jakie będzie pH otrzymanego roztworu jeżeli L-alanina ma pK1= 2,34 i pK2= 9,87. (Zmiany objętości roztworu należy pominąć) (4 pkt)
Nazwij poniższe związki, określ rodzaj izomerii w pokazanych parach struktur a; b; c.
(3 pkt)
a)

b)
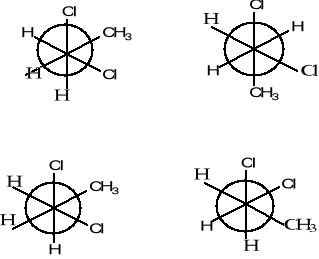
c)

9. Napisz wzory produktów łagodnego utleniania poniższych związków. (5 pkt)
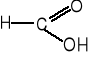
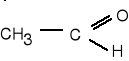
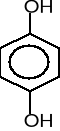
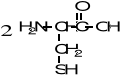
![]()
10.Uzupełnij schemat reakcji , nazwij reagenty.
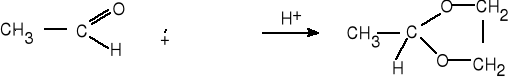
(4 pkt)
11. Podaj nazwę narysowanego niżej związku. Ile asymetrycznych atomów węgla występuje w tej cząsteczce ? Określ konfigurację absolutną C2. Czy związek może ulegać mutarotacji ?
(5 pkt)
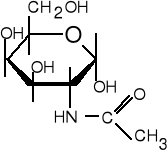
12. Ile protonów wymieni peptyd (angiotensyna) o wzorze:
H-Asp-Arg-Val-Tyr-Val-His-Pro-Phe-His-Leu-OH
gdy roztwór wodny w którym jest rozpuszczony zmieni pH z 1.5 do 11.0 ?
Czy będzie to oddawanie czy przyjmowanie H+ ? (4 pkt)
13. Cząsteczka tłuszczu ma sumaryczny wzór C57H104O6. Ile podwójnych wiązań występuje w tej cząsteczce ? Jakie znane ci kwasy tłuszczowe mogą wchodzić w skład tej cząsteczki ?
(4 pkt)
14. Przedstaw wzorami możliwości tautomerii D-mannozy w roztworach wodnych. (4 pkt)
15. Napisz schemat reakcji mocznika z bezwodnikiem octowym. Nazwij produkt reakcji. (2 pkt)
1/ 3 |
2/ 3 |
3/ 4 |
4/ 3 |
5/ 3 |
6/ 2 |
7/ 4 |
8/ 3 |
9/ 5 |
10/4 |
11/5 |
12/ 4 |
13/ 4 |
14/ 4 |
15/ 2 |
Σ 53 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Egzamin z chemii po I roku studiów na Wydziale Lekarskim
Akademii Medycznej
......................................................................... Bydgoszcz, 11 czerwca 2004
imię i nazwisko
ZESTAW B
Roztwór zawiera 5% NaBr, 5% KBr i 5% KI. Jakich jonów jest w tym roztworze
najwięcej przy założeniu, ze stopnie dysocjacji wymienionych soli są w tym roztworze równe 100% ? Odpowiedź uzasadnij stosownymi obliczeniami. ( 3 pkt )
(Na-23, Cl-35.5, K-39, Br-80)
Wskaż parę ( pary ) tlenków dające w wyniku reakcji związek, który w roztworze wodnym barwi fenoloftaleinę na różowo:
CaO i SO3
Na2O i NO
Al2O3 i SO3
K2O i CO2
Odpowiedź uzasadnij. ( 3 pkt )
Ile 0,1 mol/l roztworu HNO3 trzeba dodać do 20 cm3 0,01 mol/l roztworu KOH aby uzyskać stężenie H+ równe 4,5• 10-2 mol/l ? (4 pkt)
Kwas octowy zmieszano z alkoholem etylowym w ilościach stechiometrycznych i
prowadzono reakcję, w której wydajność po ustaleniu się stanu równowagi wynosiła
60%. Oblicz stałą równowagi tej reakcji. ( 3 pkt )
Dla podanych układów redoks potencjały standardowe wynoszą:
S + 2e S2- Eo = - 0, 51 V
Cr2O72- + 14 H+ + 6e 7 H2O + 2 Cr3+ Eo = + 1,36 V
H2O2 + 2H+ + 2e 2H2O Eo = + 1,78 V
MnO4- + 8H+ + 5e 4H2O + Mn2+ Eo = + 1,52 V
Na tej podstawie odpowiedz na następujące pytania :
czy w środowisku kwaśnym MnO4- może być utleniaczem jonów S2- do So ?
czy w środowisku kwaśnym jony Cr2O72- mogą utlenić jony Mn2+ do MnO4- ?
czy w środowisku kwaśnym jony Cr3+ mogą zredukować H2O2 ?
Odpowiedzi uzasadnij. ( 3 pkt )
Żelazo występuje na Ziemi w postaci mieszaniny izotopów - głównie 54Fe(5,82%), 56Fe(91,18%), 57Fe(2,1%), 58Fe(0,28%). Które z twierdzeń można uznać za prawdziwe:
mężczyźni mają w swojej hemoglobinie więcej lżejszych izotopów żelaza niż kobiety,
izotopy mają te same właściwości chemiczne i skład izotopowy w różnych organizmach żywych jest taki sam. (2 pkt)
Do 1000 cm3 obojętnego wodnego roztworu zawierającego 1 mol L-alaniny dodano 0,3 mola HCl. Jakie będzie pH otrzymanego roztworu jeżeli L-alanina ma pK1= 2,34 i pK2= 9,87. (Zmiany objętości roztworu należy pominąć) (4 pkt)
Nazwij poniższe związki, określ rodzaj izomerii w pokazanych parach struktur a; b; c.
(3 pkt)
a)

b)
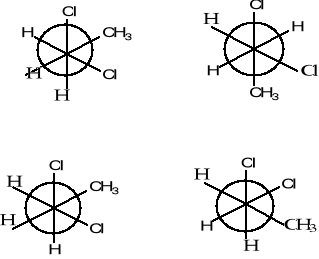
c)

9. Napisz wzory produktów łagodnego utleniania poniższych związków. (5 pkt)
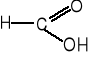
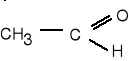
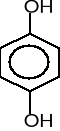
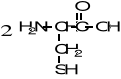
![]()
10.Uzupełnij schemat reakcji , nazwij reagenty.
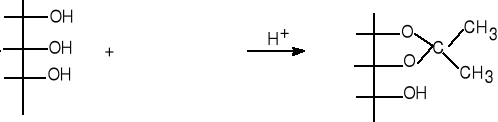
(4 pkt)
11. Podaj nazwę narysowanego niżej związku. Ile asymetrycznych atomów węgla występuje w tej cząsteczce ? Określ konfigurację absolutną C2. Czy związek może ulegać mutarotacji ?
(5 pkt)
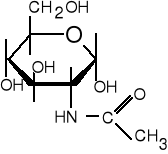
12. Ile protonów wymieni peptyd (angiotensyna) o wzorze
H-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-OH
gdy roztwór wodny w którym jest rozpuszczony zmieni pH z 11.0 do 1.5 ?
Czy będzie to oddawanie czy przyjmowanie H+ ? (4 pkt)
13. Cząsteczka tłuszczu ma sumaryczny wzór C53H100O6. Ile podwójnych wiązań występuje w tej cząsteczce ? Jakie znane ci kwasy tłuszczowe mogą wchodzić w skład tej cząsteczki ?
(4 pkt)
14. Przedstaw wzorami możliwości tautomerii D-galaktozy w roztworach wodnych. (4 pkt)
15. Napisz schemat reakcji 1-propenu z chlorowodorem w warunkach reakcji jonowej. (2 pkt)