Biochemia-nauka badająca przemiany chemiczne, energetyczne oraz mechanizmy dziedziczenia cech na poziomie żywej komórki. Przemiany anaboliczne (endoergiczne)tworzenie się drogą syntezy związków złożonych z subs. prostych, wymagają nakładu energii. Przemiany kataboliczne (egzoergiczne) rozpad zw. złożonych na bardziej proste. Zachodzą z wydzieleniem energii.
Aminokwasy zw.org., pochodne kwasów mono i di karboksylowych, amfoteryczne, optycznie czynne, zawierają 1-2 gr. aminowych. Grupa -NH2 zawsze w położeniu alfa. Posiadają węgiel asymetryczny. Należ do konformacji L. Zw. o strukturze jonowej. W roztworach występują w 3 postaciach tj. jon obojnaczy, anion, kation. Mają punkt izoelektryczny. Podział aminokwasów: 1) Am. Obojętne *Am. z rodnikiem polarnym - zawierają gr. -OH, -SH lub pierścień heterocykliczny np. Ser, Cys, Tyr. * Am. z rodnikiem niepolarnym- hydrofobowe np. Ile, Phe, Ala 2) Am. kwaśne- maja w rodniku dodatkową gr -COOH np. Asp i Glu oraz ich amidy 3) Am zasadowe- mają w rodniku dodatkową gr amidową(i gr. wiążące protony) np. Lys, Ser. Aminokwasy egzogenne- do organizmu są dostarczane razem z pożywieniem. Podział: 1) Am o łańcuchu rozgałęzionym: Val, Leu 2)Am aromatyczne: Phe, Tyr 3) pochodne kw 2- amino 3-formylopropionowego no Lys, Tre, Met. Aminokwasy białkowe mają swoje odpowiedniki w kodzie genetycznym (20 aminokwasów i 2 amidy)
Aminokwasy niebiałkowe występują w peptydach lub w formie wolnej, pełnia liczne funkcje w metabolizmie. Asymilacja amoniaku: Amoniak (jon amonowy) wytwarzany w wyniku redukcji azotanów lub bezpośrednio pobierany. Ze względu na toksyczność nie może być nagromadzany w ograniźmie. Jest ustawicznie włączany w zw. ogr. trzema sposobami: aminacja redukcyja, synteza amidów. synteza karbamoilofosforanu. Reakcje te prowadzą do powstania amoniaku.
Pierwotna synteza aminokwasów-podstawowe znaczenie ma biosynteza kwasu glutaminowego i jego amidu glutaminy.Kwas glutaminowy dostarcza grup aminowych do syntezy innych aminokwasów na drodze transaminacji. Biosynteza kwasu glutaminowego przebiega dwuetapowo 1. z kwasu alfa-ketglutarowego wiążąc się z amoniakiem dając kwas alfa-iminoglutarowy.W drugim etapie aminokwas ulega redukcji do kw. Glytarowego przy udziale dehydrogenazy glutaminianowej współdziałającej z NADH lub NADPH. Detoksykacja aminokwasów-nadmiar amoniaku jest wiązany przez gr. gamma-karboksylową kw. glutaminowego przez syntetazę glutaminy (przy udziale ATP). W nerce glutamina oddaje NH3 pod wpływem glutaminazy-powstaje glutaminian. NH3 wchodzi w cykl mocznikowy.
Cykl mocznikowy: W komórkach bakterii mechanizm cyklu przebiega z udziałem 1 mola ATP i katalizowany jest przez enzym kinaze karbaminianową.w pierwszym etapie z CO2 i NH3 powstaje kw. karbamidowy, w drugiej fazie zachodzi fosforylacja kwasu przy udziale ATP w obecności enzymu kinazy karbaminianowej dając karbamoilofosforan. U zwierzat urotelicznych reakcja przebiega w wątrobie i nerkach katalizowana przez syntetazę karbamoilofosforanaową. W kolejnej reakcji katalizowanej przez karbamoilotransferazę ornitynową rodnik karbamoilowy przenoszony jest na grupę delta-aminową ornityny dając cytrulinę. Następny etap to kondensacja cytruliny z asparaginianem (przy udziale syntetazy argininobursztynianowej).Powstaje arginobursztynian, reakcji towarzyszy rozpad ATP do AMP i PPi. Kwas arginobursztynianowy pod wpływem liazy arginobursztynianowej rozpada się na argininę i fumaran. Hydorliza argininy pod wpływem arginazy uwalnia mocznik i ornitynę.
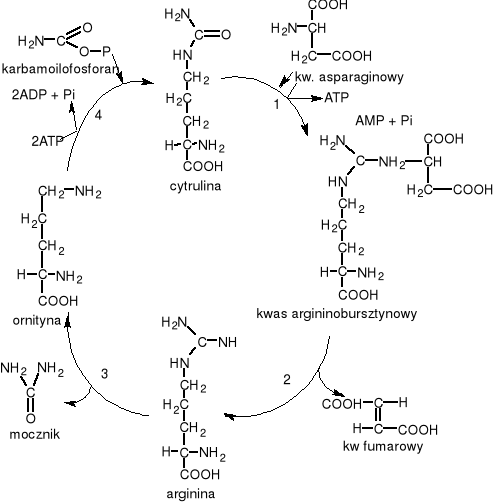
ENZYMY: 1. Syntetaza arginino-bursztynianowa 2. Liaza arginino-bursztynianowa 3. Arginaza 4. Karbamoilotransferaza ornitynowa
Bilans cyklu: 2 NH3 +CO2 +Asp + 3ATPmocznik + fumaran + 2ADP + 2Pi + AMP + PPi
Transaminacja- zasymilowany w kwas glutaminowy azot aminowy może być podczas taransaminacji zużyty do biosyntezy aminokwasów oraz zasad purynowych i pirymidynowych.Proces wymiany enzymatycznej gr. aminowej pomiędzy aminokwasy i 2-oksokwasami bez uwalniania do środowiska amoniaku nosi nazwę transaminacji.Schemat ogólny to: aminokwas A+oksokwas B=oksokwas A+aminokwas B
Reakcje transaminacji SA odwracalne,odgrywają podstawową rolę w przemianie materii,pozwalając oszczędnie gospodarować azotem i wytwarzać aminokwasy.
Deaminacja aminokwasów-usunięcie grup NH2 z aminokwasów.a)deaminacja oksydacyjna katalizowana przez dehydrogenazę współpracującą z NAD+/NADP+ (utlenienie C-alfa do gr. ketonowej)kw glutaminowy+NAD+(NADP+)kw iminoglutarowy + NADH2 (NADPH2)kw iminoglutarowy+ H2O= kw oksoglutarowy + NH3 b) 2. rodzaj(kat. Oksydaza współpracująca z FMN i FAD) aminokwas+FMNalfa-ketokwas+FMNH2
c)dekarboksylacja treoniny lub Ser(przez enzymy nie należące do oksydaz):1 etap-dehydratacja 2 etap-właściwa deaminacja
Dekarboksylacja aminokwasów:
Jest to enzymatyczne odszczepienie CO2 od związku. W wyniku tego powstaje szkielet węglowy z gr aminowąamina biogenna.
Przykłady: serotonina(5-hydroksytryptamina; neurotransmiter)-jest produktem metabolizmu Trp przez hydroksylacje Trp z udziałem hydroksylazy tryptofanowej powstaje 5-hydroksytryptofan, on z kolei ulega dekarboksylacji pod wpływem dekarboksylazy aminokw aromat. dając serotoninę etanoloaminapowstaje w wyniku dekarboksylacji seryny(skł. fosfoglicerolipidów) kw gamma-aminomasłowy(neurotransmiter)powstaje w wyniku dekarboksylacji kw. glutaminowego
PEPTYDY
Wiazania peptydowe to wiazania amidowe,powst.pomiędzy COOH jednego aminokwasu a NH2 drugiego, w których do gr karboksylowej zamiast amoniaku, zostala przylaczona jego acylowa pochodna. Reakcja tworzenia wiazania peptydowego:
Połączenie 2 lub wiecej aminokwasow wz peptydowym prowadzi do powstania PEPTYDÓW. Wyróżniamy mono, di, tripeptydy itp. Oligopeptydy to 2-10 aminokwasow, 11-100 to polipeptydy, wyższe niż 100 to białka. F-cje biol pełnią:oksytocyna,wazopresyna,cysteina,
Glutation - tripeptyd gama-glutamylo-Cys-Gly. Wystepuje tu wiazanie nietypowe grupy 5-karboksylowej kw glutaminowego. Glutation latwo ulega odwodorowaniu i jest przenośnikiem elektronow.
Tworzenie nazw am.: Łańcuch p-peptydowy ma N-koniec (NH2-) i C-koniec (-COOH). Początek łańcucha wyznacza koniec N, dlatego sekwencje łańcucha zapisuje się od grupy +H3N- a konczy na grupie - COO-.
SEKWENCJA AMINOKWASOW w bialku(zdeterminowana genetycznie): 1) wyjasnia dzialanie białka, 2) analizując sekwencje i strukture pzestrzenna można ustalic reguly skręcalności bialek, 3) pomaga wykryc choroby genetyczne, 4) dostarcza inf o historii ewolucji organizmow
BIAŁKA: BIAŁKA: I-rz: zw złożone z minimum 100 aminokwasow + dodatkowo grupa niebiałkowa. Dzielą się na proste i złożone; globularne (dobrze rozp w H2O, sa to enzymy, antygeny itp) i fibrylarne (nierozpuszczalne, strukturalne, kształt podłużny, np. keratyna, miozyna, kolagen); Szkieletem w łanc białkowym sa powtarzające się -CH-CO-NH-. Łańcuch nie jest całkowicie sztywny, a pojedyncze wiazania pozwalaja na ruch obrotowy. Hemoglobina->niedokrwistość hemolityczna-anemia; łamliwość kości-pojedyncze zmiany sekwencji aminokwasowej kolagenu tk. kostnej. Strukturę tą możemy uzyskać wydzielając ją z mat. biologicznego. Struktura wtórna białek: II-rz: sposób przestrzennego ułożenia łańcuchów polipeptydowych białek na skutek powstawania spontanicznych układów wewnątrzcząsteczkowych wiązań wodorowych. Na ogół łańcuchy polipeptydowe białek układają się w kształt α-helisy (prawoskrętna, zbudowana z L-aminokwasów, prolina nie tworzy w. wodorowych) lub β-lameli (bardziej rozciągnięte w kierunku osiowym). III-rz: układ w przestrzeni wszystkich atomów, bez uwzględniania zależności od sąsiednich cząsteczek. Wiązania dwusiarczkowe (mostki disulfidowe) należą do najsilnieszych wiązań (kowalencyjne) między resztami aminokwasów. Powstają w wyniku odwodornienia grup tiolowych -SH dwóch cystern znajdujących się w tym samym łańcuchu albo w dwóch łańcuchach polipeptydowych. Wiązania te nadają trwałość strukturze trzeciorzędowej. Odziaływania jonowe - mogą występować między grupami aminowymi lub guanidynowymi łańcuchów bocznych aminokwasów zasadowych, a grupami karboksylowymi aminokwasów kwaśnych (Asp, Glu). Tworzą domeny białkowe (2 lub kilka),czyli zwarte fragmenty tej struktury pełniące określone funkcje.Przyklady:mioglobina IV-rz: Białka jako koloidy -aminokwasy wchodzące w skład białek nadają im określony ładunek,to rozproszone cząsteczki maja charakter hydrofilowy i otaczaja się ”płaszczem wodnym” Polarne białka przyciągają się i łącza ze znaczną siłą wodę, która posiada charakter dwubiegunowy. Białka wykazują powinowactwo do wody, a wiązana woda umożliwią pęcznienie białek. Nie wszystkie białka są rozpuszczalne w wodzie, zależy ona od stosunku ilościowego gr.polarnych do apolarnych. Wysolenie białaka to proces odwracalny, polega na dodaniu do roztworu soli i jej wytrąceniu, wykorzystuje się je do oczyszczania białek jak i ich rozdziału.
Denaturacja białka -powoduje zmianę konformacji białka z zanikiem aktywności biologicznej i zmiana niektórych właściwości. Zachodzi pod wpływem wysokiej temp. Mocnych kwasów i zasad, mocznika, detergentów, niektórych związków aromatycznych, stężonych roztworów jonów metali ciężkich. Prowadzi do zerwania wz. wodorowych i innych niekowalencyjnych, tym samym do rozfałdowania łańcucha. Denaturacja tworzy szereg przemian; 1.zmniejszenie rozpuszczalności w punkcie izoelektrycznym 2.utrata aktywności biologicznej 3.zwiększenie aktywności grup chemicznych wewn. Cząsteczki, gł. grup fenolowych, tyrozyny i SH cysteiny oraz wz. S-S. 4. wzrost kata skręcenia płaszczyzny światła spolaryzowanego oraz asymetrii cząsteczek 5.wzrost podatności na hydrolizę enzymatyczną. Denaturacja to proces praktycznie nieodwracalny, odwracalny tylko w przypadku prostych białek i nazywany wówczas renaturacją. Ładunek elektryczny- obecność aminokwasów o charakterze jonowym nadaje cząsteczkom białek ładunek elektr. Który jest wypadkowa wszystkich dysocjujących grup w rodnikach. Wartość i znak ładunku zależą od pH środowiska.Dla każdego istnieje określona wartość pH przy której wszystkie ładunki się równoważą i jego ładunek sumaryczny jest równy zeru. Ta wartość nazywana jest punktem izoelektrycznym. Zawartość w białkach gr.zjonizowanych rzutuje na właściwości do których należą zmienność konformacji cząsteczek w zależności od pH oraz ruchliwości w polu elektrycznym. Ochronne działanie koloidów- koloidy hydrofilowe działają ochronnie na hydrofobowe. Dodatek koloidu hydrofilowego do hydrofobowego powoduje powstanie układu trwałego,z którego trudno wytrącić zawieszone cząsteczki hydrofobowe. Mleko to trwała emulsja kuleczek tłuszczu, co związane jest z ochronnym działaniem drobinek mleka pokrywających kuleczki tłuszczu cienką błoną. Denaturacja białka-równoznaczna z jego wytrąceniem z roztworów.Białko denaturowane może się nie wytrącić jeśli posiada ładunek elektryczny, czyli kiedy znajduje się w środowisku o pH różnym od punktu izoelektrycznego. Doprowadzenie stężonych jonów wodorowych do pH punktu izoelektr. Powoduje wytrącenie białaka. Białaka rozpuszczone w wodzie fałdują się w ściśle określone struktury z niepolarnym rdzeniem. W środowisku wodnym sterowaniem białka zajmuje się silna tendencja reszt hydrofobowych do unikania wody. Polipeptydowy łańc. fałduje się spontanicznie, tak ze jego hydrofobowe łańcuchy boczne chowają się do wnętrza cząsteczki, a naładowane łańcuchy polarne pozostają na powierzchni. Warunkiem schowania segmentu łańcucha głównego w hydrofobowym środowisku jest sparowanie wszystkich grup NH i CO przez wiązania wodorowe. To parowanie dokonuje się w helisie alfa i harmonijce beta. Sekwencja aminokwasowi białka określa jego strukturę przestrzenną. Znajomość zależności między sekwencja aminokwasowi i konformacją zawdzięczamy badaniom rybonukleazy,enzymu hydrolizującego RNA. Jest to pojedynczy łańcuch polinukleotydowy złozony ze 124 reszt aminokwasowych, zawiera 4 mostki dwusiarczkowi, które można zerwac w sposób odwracalny przez redukcję beta-merkaptoetanolem. Zdenaturowana rybonukleaza którą która uwolniono od mocznika i beta-merkaptoetanolu odzyskuje aktywność enzymatyczną. Tlen i powietrze utlenia grupy zdenaturowanego enzymu, który przybiera postać aktywna katalitycznie.
Rozplecione, częściowo sfałdowane białka w dużych stęż. mają tendencję do agregacji. In vitro renaturację zdenaturowanego białka prowadzi się zazwyczaj w roztworach rozcieńcz., by zminimalizować oddziaływania między cząsteczkami i agregację. In vivo jednak fałdowanie się białka zachodzi w „zatłoczonym” otoczeniu. Białka powstające w cytoplazmie lub retikulum cytoplazmatycznym otaczają liczne „inne cząsteczki”, które oddziałując z białkami mogą je odkształcać. Istnieje kilka klas białek obrazowo nazwanych „molekularnymi opiekunami”- chaperonami, które oddziałując z fałdującym się białkiem zapobiegają nieprawidłowym wiązaniom i eliminują błędne struktury. Chaperony wiążą się w sposób odwracalny z niepofałdowanym odcinkiem polipeptydu, który w innym wypadku mógłby służyć jako ośrodek agregacji lub błędnego fałdowania. Hydroliza ATP napędza rozplątywanie błędnie sfałdowanych stadiów pośrednich. Rosnące (nowo syntetyzowane) łańcuchy polipeptydowe (po przejściu do światła retikulum endoplazmatycznego) nie ulegają natychmiastowemu sfałdowaniu, ale wiążą się z białkami chaperonowymi , które przez kilka min. utrzymują te peptydy w stanie rozfałdowania. W nieobecności chaperonów mnogość rodzących się łańcuchów ulegałaby poplątaniu. Chaperony pomagają przy fałdowaniu przez blokowanie nieodzownych interakcji między cząsteczkami, utrzymują w jednej całości wyłaniającą się część rosnącego łańcucha, aż do ukończenia jego syntezy. Głównymi chaperonami w świetle ER jest białko wiążące BiP, będące przedstawicielem rodziny białek szoku termicznego (HSP). Wszystkie komórki reagują na wzrost temp. (szok termiczny) syntezą nowych białek należących do tej rodziny. Dotyczy to zarówno kom. prokariotycznych jak i eukariot. Podobny efekt mają inne stresy. Wspólnym mianownikiem indukcji białek szoku termicznego jest nadmiar niesfałdowanych łańcuchów polipeptydowych. Między kwasami nukleinowymi (DNA i RNA) a białkami istnieje zasadnicza różnica w sposobie wiązania innych cząsteczek. Wiązania między nićmi DNA opierają się na zjawisku komplementarności, czyli parowania nukleotydów wg ścisłej reguły. Jeśli w określonym miejscu pierwszej nici jest nukleotyd C, to na drugiej musi być w tym miejscu G, a jeśli na jednej jest A, to na drugiej musi być T. W przypadku RNA nukleotyd T jest zastępowany przez U i reguła ulega pewnemu rozluźnieniu, gdyż U może parować się nie tylko z A, ale także z G. Niemniej kolejność nukleotydów w łańcuchu pozwala jednoznacznie przewidzieć z jakim RNA lub DNA ten łańcuch może się związać. Dla krótkiej sekwencji nukleotydowej (takiej jak Si RNA) już niezgodność 1 nukleotydu zaburza, lub uniemożliwia wiązanie. Z białkami jest inaczej. Aminokwasy w odróżnieniu od nukleotydów nie tworzą stałych par ani z sobą, ani z nukleotydami, gdyż mogą oddziaływać z sobą na wiele sposobów, np. aminokwasy naładowane dodatnio i ujemnie przyciągają się wzajemnie. Aminokwasy mające boczne grupy węglowodorowe (kt. są silnie hydrofobowe) zbijają się w grupki, dla ochrony przed cząsteczkami wody. Między aminokwasami mogą też powstawać słabe wiązania wodorowe, lub b. trwałe mostki siarczkowe. Dzięki tym oddziaływ. łańcuchy aminokwasów spontanicznie zwijają się w zwarte kłębki, a kłębki z kolei mogą wiązać się ze sobą. Nie sposób tu znaleźć jednak prostej i jednoznacznej reguły wiązania. Siła wiązania zależy od stopnia ich dopasowania.
KLASYFIKACJA BIAŁEK
1.PROSTE
a)fibrylarne: skleroproteiny
b)globularne:
- właściwe: histony, albuminy, globuliny, prolaminy, gluteliny
- polipeptydy: protaminy
2.ZŁOŻONE:
fosfoproteiny, glikoproteiny, chromoproteiny, lipoproteiny, metaloproteiny, nukleoproteidy.
Do prostych są zaliczane te białka, które po hydrolizie dają wyłącznie aminokwasy, lub ich pochodne. Natomiast białka złożone składają się z cząsteczki białka prostego połączonego z inną niebiałkową cząsteczką organiczną lub nieorganiczną.
BIAŁKA PROSTE:
PROTAMINY: są zaliczane do polipeptydów. Występ. w dojrzałej spermie ryb, skład. się tylko z 8 rodzajów aminokwasów, gł. zasadowych. HISTONY: typowe białka jądra kom., które występ. w połączeniu z kw. nukleinowymi jako nukleoproteidy. Posiadają silnie zasadowy charakter, wykazują właściw. Podobne do protamin. GLOBULINY: stanowią największą i najbardziej rozpowszech. grupę białek, należą do niej > enzymów. Globuliny są nierozpuszczalne w wodzie, a rozp. w rozcieńcz. Roztworach soli i mogą być wysolone przy ich stęż. bliskich pełnego nasycenia. ALBUMINY: są rop. w wodzie i rozcieńcz. roztworach soli. Ulegają wysoleniu przy wyższych stęż. siarczanu amonu.Są szeroko rozpowszech. w cieczach ustrojowych i ziarnie zbóż. PROLAMINY: stanowią grupę białek ropuszczal. w rozcieńcz. alkoholach. Występ. tylko w nasionach traw, zawierają dużo aminokwasów dikarboksylowych i praliny, natomiast mało lizany. GLUTELINY: są ropuszczal. w rozcieńcz. kwasach i zasadach, natomiast nierozp. w roztworach soli obojętnych. Występ. w nasionach roślin jednoliściennych. Skład aminokwasowy mają podobny do prolamin. Gluteliny i prolaminy są to gł. białka zbóż,są to skład. glutenu.
SKLEROPROTEINY: duża grupa białek fibrylarnych występ. u zwierząt jako składnik tkanki łącznej i strukturalnej.Białka odporne na działanie rozpuszczalników,oraz enzymów proteolitycznych.Gł. przedstawicielami tych białek są: keratyna,kolagen,elastyna.Żelatyna jest produktem degradacji cieplnej kolagenu i nie jest białkiem naturalnym.
BIAŁKA ZŁOŻONE:
FOSFOPROTEINY: zaw. ok. 1% fosforu(kw. fosforowego) związanego estrowo z grupami alkoholowymi seryny i treoniny. Gł. przedstawicielami tej grupy są:kazeina mleka, oraz fosglityna żółtka jaja. GLIKOPROTEINY: szeroko rozpowszech. w organizmach żywych grupa białek, zaw. od ok. 4% skład. cukrowego do większych jego ilości. Skład. cukrowymi są: galaktoza, mannowa, glukozamina i jej pochodne. CHROMOPROTEINY: stanowią różnorodną grupę białek, których składnikiem niebiałkowym jest subst. barwna.Grupa ta obejmuje hemoglobiny, mioglobiny, cytochromy,niekt.białka rośliny(fikocyjaniny),pochodne karotenoidowe (rodopsyna), flawoproteiny, melanoproteiny. NUKLEOPROTEINY: grupa białek gł. zasadowych (protaminy,histony),kt. są związane w kompleksy z kw. nukleinowymi. LIPOPROTEINY: są to różne połączenia białek z tłuszczami właściwymi,fosfolipidami, kw.tłuszczowymi i cholesterolem. Stanowią gł. składnik błon kom. METALOPROTEINY: zawierają różne jony metali, związane bezpośrednio z białkiem,a należą do nich tzw. ferrodoksyny,czyli białka żelazo-siarkowe,a także ferrytyna i ceruloplazmina,kompleksy białkowo- chlorofilowe, liczne enzymy.
KIEROWANIE BIAŁEK
Komórka musi zapewnić prawidłowe posortowanie nowo tworzonych białek i skierowanie każdego z nich do właściwego miejsca, w którym mogłoby spełnić swoje f-cje.Proces ten określa się jako kierowanie białek. W kom. eukariot. Przeznaczeniem białka może być pozostanie w cytozolu, czego przykładem są enzymy biorące udział w glikolizie. Białko może być również jednak skierowane do organelli: mitochondrium, lizosomu, peroksysomu, chloroplastu, rybosomu, jądra lub wbudowane w bł. Kom., a także wydzielane z komórki. Zarówno u prokariotów jak i eukariotów białko przeznaczone do cytozolu jest syntetyzowane na wolnych rybosomach w cytozolu i bezpośrednio do cytozolu uwalniane. Jeśli jest ono przwidziane do innych miejsc przeznaczenia, to w ich transport i sortowanie włączone zostają mechanizmy kierowania białek.
BIAŁKA SEKRECYJNE
Białka przeznaczone do wydzielania z kom. eukariot. Są syntetyzowane przez rybosomy,związane z RER. W miarę wydłużania łańcucha polipeptydowego ulega on translokacji przez błonę RER do światła RER, gdzie zostaje sfałdowany, przyjmując ostateczną konformację.Następnie od RER odpączkowują pęcherzyki przenoszące dane białko do AG (=kompleks Golgiego).W aparacie tym odróżniamy stronę cis (do której podchodza pęcherzyki) i stronę trans ( z której pęcherzyki odchodzą). Tak więc pęcherzyki RER ulegają fuzji z przedziałem cis AG,uwalniając białko do światła tego przedziału. Białko przemieszcza się następnie przez kompleks Golgiego do przedziału trans, będąc po drodze modyfikowane przez dodanie reszt cukrowych (glikozylacja).W końcu z przedziału trans odpączkowują pęcherzyki przenoszące białka wydzielnicze do błony kom., którą pęcherzyki ulegają fuzji,uwalniając swą zawartość na zewnątrz komórki. Ta fuzja i uwalnianie białek poza obręb komórki, określone są jako egzocytoza.
HIPOTEZA SYGNAŁOWA
Typowe białko wydzielnicze różni się od białka cytozolowego posiadaniem przy swoim końcu N sekwencji o długości 13-35 aminokwasów o nazwie sekwencja sygnałowa,lub peptyd sygnałowy.Peptydy sygnałowe poszczególnych białek wydzielniczych różnią się sekwencją aminokwasów,ale mają pewne wspólne cechy. Jedną z nich jest zazwyczaj centralne ułożenie tej sekwencji 10-15 hydrofobowych aminokwasów.Hipoteza sygnałowa zaproponowana w początkowych okresach badań zakładała,że peptyd sygnałowy skierowuje białko do błony ER i w ten sposób umożliwia białku przejście do światła ER i dalszy eksport. Cząsteczka mRNA kodująca białko wydzielnicze wiąże się z wolnym rybosomem w cytoplazmie i rozpoczyna się synteza białka. Początkowo powstaje peptyd sygnałowy przy końcu N białka, następnie do peptydu tego wiąże się cząsteczka rozpoznająca sygnał (SRP) będąca kompleksem 7S RNA i 6 białek hamując dalszą syntezę białka. Zapobiega to przedwczesnemu uwolnieniu białka wydzielniczego do cytozolu. Następnie kompleks rybosom- mRNA-SRP wiąże się na powierzchni ER z białkowym receptorem SRP. Błona ER zawiera również białkowy receptor rybosomu związany z translokonem, kanałem białkowym umożliwiającym przejście polipeptydu. W uporządkowanej serii reakcji rybosom zostaje ściśle związany z receptorem SRP i zostaje uwolniony od peptydu sygnałowego, następuje kontynuacja translokacji,a rosnący polipeptyd przechodzi przez por wytworzony w błonie przez białkowy translokon. Zaraz po przejściu przez por peptyd sygnałowy zostaje odcięty przez peptydazę sygnałową po stronie światła ER i ulega degradacji uwalniając resztę białka do światłą ER, następnie białko zostaje transportowane przez AG na zewnątrz kom..Ponieważ przenoszenie peptydu przez błonę RER zachodzi podczas syntezy białka proces ten jest nazywany kontranslacyjny.SRP uwolniona najpierw z rybosomu, a potem ze swojego receptora jest gotowa do związania następnego peptydu sygnałowego (cykl SRP).
BIAŁKA BŁONY KOM.
Integralne białka błony kom., są również syntetyzowane przez rybosomy na powierzchni RER,ale nie przechodzą do światła,tylko zostają wbudowane w błonę RER.. Podczas transportu do aparatu Golgiego i dalej do powierzchni komórki białka te pozostają zakotwiczone w błonie, a błona ostatecznych pęcherzyków ulegająca fuzji z błoną kom.,staje się nową częścią tej ostatniej. Ta część białka, która po wbudowaniu do błony RER wystaje ku światłu RER,zostaje ostatecznie ulokowana na zewnętrznej powierzchni kom. To własnie ta część białka otrzymuje cukrowce,w procesie glikozylacji,przebiegającym w RER i aparacie Golgiego, przez cukrowce sa eksponowane na pow. kom. Przeniesienie przyszłego białka błony kom. przez błonę ER zachodzi podczas jego syntezy za pomocą mechanizmu podobnego do działającego w przypadku białek wydzielniczych. Jednakże,białko także pozostaje zakotwiczone w bł, a nie przechodzi w całości do światła RER.
BIAŁKA ER
ER zawiera wiele białek, których rola polega na kontrolowaniu prawidłowego fałdowania się rosnących peptydów i osiągnięcia ich naturalnej konformacji, niekt. z nich to chaperony.Białka rezydujące w ER, powst. na RER, przechodzą do światła,jak białka wydzielnicze i podobnie są transportowane pęcherzykami do aparatu Golgiego. Jednakże, białka te zaw. przy końcu C sygnał retencji, zbudowany z Lys- Asp- Glu- Leu (czyli KDEL). Po osiągnięciu kompleksu Golgiego, sekwencja KDEL wiąże te białka w kwaśnym środowisku światła cis Golgiego do receptorów błonowych, które innymi pęcherzykami przywracają te białka do ER.
BIAŁKA MIT. I CHLOROPLAST.
Ogromna > białek mit. I chl. Powstaje na wolnych rybosomach w cytoplazmie, zostaje uwolniona do cytozolu, a następnie importowana do organelli. Wprowadzenie białka do matriks mitochondrialnej wymaga obecności sygnału, w postaci sekwencji kierującej do tego przedziału i zachodzi najczęściej w miejscach, miejscach których zewn. I wew. Bł. Mitochondr., są w kontakcie z sobą. Proces przebiega z udziałem białek Hsp70 i Hsp60 i wymaga hydrolizy ATP, oraz obecności transbłonowego potencjału elektrochem. Wew. Bł. Mitochondr. Kierowanie białek do innych przedziałow mit. i chl. wymaga 2 sygnałów. BIAŁKA JĄDROWE
Jądro ma bł zewn i wewn przez ktorą przechodzi 3-4 tys. porów jądrowych. Każdy por stanowi kompleks poru jądrowego złożony z ponad 100 różnych białek zorganizowanych heksagonalnie, aczkolwiek małe cząsteczki mogą przechodzić przez ten por w drodze dyfuzji swobodnej to duże wchodzące do jądra wymagają sygnału lokalizacji jądrowej.Jest nim odcinek zbudowany z 4-8 aminokwasów, bogaty w dodatnio naładowane reszty lizany,oraz asparaginy i zazwyczaj prolinę. Przejście białka przez por jądrowy wymaga ATP,a białko wnika do jądra bez odcięcia sygnału kierującego.
GLIKOZYLACJA BIAŁKA
Większość białek wytw. Przez rybosomy na RER jest glikoproteinami, co oznacza, że zawierają one krótkie łańcuchy cukrowców (oligosacharydy), wiązanych kowalencyjnie z białkami w trakcie jego przechodzenia przez RER i AG. Istnieją 2 gł typy oligosacharydów związanych z białkami:
1)oligosacharydy wiązane O-glikozydowo z grupami -OH bocznych łańcuchów seryny i treoniny
2)oligosacharydy związane N- glikozydowo, przez grupy -NH2 bocznych łańcuchów asparaginy.
W miejscach, gdzie asparagina występ. w sekwencji Asn-X-Ser (lub Thr) przy czym X- jest jakimkolwiek aminokw, z wyj Pro i prawdopodobnie również Asp. Poza tym pewne białka są zakotwiczone w bł kom poprzez specyficzną strukturę zawierającą cukrowce, a więc kotwicę glikozylo-fosfatydylo-inozytolową (GPI). Synteza oligosacharydówprzyłączonych wiązaniem O- glikozydowym zachodzi przez kolejne dodawanie jednostek monosacharydowych do nowo powstającego białka w czasie gdy przechodzi ono przez kompleks Golgiego. W pierwszym etapie N- acetylogalaktozoamina jest przyłączana do odpowiednich reszt Ser lub Thr białka przez transferazę GalNAc (N- acetylogalaktozoamina).Enzym używający jako prekursora UDP- GalNAc. Następnie zostają dodane inne monosacharydy (galaktoza, N- acetyloglukozoamina (GlcNAc), kwas sialowy i fruktoza). Z użyciem odpowiednich cukrów zaaktywowanych przez nukleotydy jako prekursorów. Właściwy typ i liczba (do ok.10) dodanych monosacharydów zależą od substratu białkowego. Wszystkie oligosacharydy przyłączone wiązaniem N- oligosacharydowym mają wspólną strukturę rdzenia pięciocukrowego zbudowanego z 3 reszt mannowy i 2 reszt GlcNAc (N- acetyloglukozoaminy).
PRIONY
Choroby wywołane przez tzw priony są związane z fałdowaniem się białek. Jest to grupa ciężkich chorób degenerujących układ nerwowy.Zmiany zwyrodnieniowe mózgu wykazano u ludzi, bydła i owiec. Do grupy tej można zaliczyć chorobę: Creucfelda-Jacoba, tzw. chorobę szalonych krów, czy też chorobę kuru. Ostatnia znana jako choroba uśmiechu , ze względu na grymasy twarzy jakie wywołuje. Jak się przypuszcza była przenoszona u pewnych szczepów na Nowej Gwinei na skutek kanibalizmu. Wielkim problemem pozostaje nadal możliwość zarażenia ludzi mięsem i innymi produktami pochodzącymi od zwierząt chorych na tego typu choroby. Choroby te mogą być bowiem przenoszone przez spożycie zarażonej tkanki,lub rzadziej,jest to choroba odziedziczana. Początkowo uważano, że choroby te są wywołane przez wirusy, ponieważ są zakaźne i lata mogą minąć do chwili rozwoju choroby. Szczegółowe badania tkanek wykluczyły jednak wirusy,jako czynniki zakaźne,gdyż w oczyszczonym materiale zakaźnym mózgu nie było kw. nukleinowych, potwierdzono natomiast zdolność tych czynników do replikacji. Zaobserwowano, ze infekcja jest związana z odporną na protezę formę normalnego białka (białka pionowego- PrP),które znaleziono w mózgu.Element wywołujący chorobę nazwano prionem, białko które może wywołać infekcję, jest określane jako PrPSC, podczas gdy normalny odpowiednik PrPC, oba białka sa takimi samymi polipeptydami, kodowane są przez ten sam gen, lecz inne jest ich sfałdowanie (konformacja). Uważa się,że inna konformacja tego białka jest właśnie przyczyną choroby. Wyniki badań wskazują,że cząsteczka PrPSC w jakiś sposób zmienia PrPC (białko normalne) w formę nieprawidłową. W przypadku braku infekcji- konwersja PrPC w PrPSC jest bardzo rzadkim przypadkiem, więc spontaniczne występowanie choroby jest również bardzo rzadkie. Uważa się,że mutacje genu kodującego prawidłową cząst. PrPC mogą zwiększyć prawdopodobieństwo tej potranslacyjnej przemiany w wyniku czego występ. niekt. przypadki dziedzicznego pochodzenia choroby. Raz utworzona cząst. PrPSC wywołuje więc uwolnienie autokatalitycznej reakcji tworzenia się kolejnych takich cząsteczek.
CHEMIZM ODDYCHANIA
Bezpośrednim źródłem energii dla komórek są procesy oddechowe. Zjawisko oddychania polega gł na degradacji różnorodnych zw chem w wyniku czego uwalnia się energia chem. Część energii zawartej w subst. oddechowych przekształca się w ciepło. Oddychanie zachodzące w tkankach dobrze zaopatrzonych w tlen nazywamy tlenowym, w przeciwnym przypadku mamy do czynienia z oddychaniem beztlenowym. Istotą oddychania jest tzw. biologiczne utlenianie zw org Utlenianie to polega zwykle na odwodorowaniu substratu (SH2) i przeniesieniu wodoru na cząst akceptora. Substratem podlegającym utlenianiu biolog mogą być cukry, tłuszcze, białka, kwasy, aldehydy, zredukowane koenzymy i inne. Pierwotnymi akceptorami wodoru (lub elektronów) odszczepionych od substratów są najczęściej koenzymy oksydoreduktaz NAD, NADP, FAD, FMN. Tak więc wodór zawarty w zw org jest głównym materiałem energet kom- im więcej tego pierwiastka zawiera utleniona substancja, tym wyższy wykazuje potencjał energetyczny.
FAZY ODDYCHANIA TLENOWEGO
I FAZA KATABOLIZMU obejmuje: hydrolityczny rozkład wielkocząsteczkowych związków o dużym potencjale energet na składniki prostsze. Ta wstępna faza rozkładu cukrów złożonych, tłuszczów i białek poprzedza właściwe oddychanie komórkowe, zachodzi u zwierząt w przewodzie pokarmowym, oraz w mięśniach, wątrobie, i tk tłuszcowej (hydroliza tłuszczy),u roślin w organach zapasowych, nasionach.
Wyzwolona w toku hydrolizy wiązań estrowych i peptydowych nieznaczna ilość energii ulega rozproszeniu w postaci ciepła.
II ETAP PRZEMIAN KATABOLICZNYCH
Heksozy po uaktywnieniu zostają rozbite na 2 triozy, przekształcając się w kolejnych reakcjach w kw. pirogronowy. W warunkach beztlenowych pirogronian jest redukowany do kw mlekowego (np. u zwierząt) lub po dekarboksylacji i redukcji przemienia się w etanol (u roślin i drożdży). Przy dostatecznym zaopatrzeniu tkanek w tlen kw. pirogronowy podlega dekarboksylacji połaczonej z utlenianiem (tzw. oksydacyjnej dekarboksylacji) dając acylo-CoA. Degradację heksoz do kw pirogronowego nazywamy glikolizą. Przemiany kataboliczne kw tłuszczowych zapoczątkowane są ich aktywacją do acylo- CoA. W toku dalszych przemian enzymatycznych głównie podczas β- oksydacji ulegają one rozpadowi do acetylo- CoA (CH3-CO-CoA) wytw natomiast w rezultacie hydrolizy tłuszczów glicerol podlega wielu reakcjom oksydoredukcyjnym przemieniając się w pirogronian i w końcu w aktywny octan. W rezultacie przemian katabolicznych róznych aminokwasów (deaminacja itd.) powstają: ketokwasy, takie jak pirogronian, α- ketoglutaran (kwas 2- oksoglutarowy) i szczawiooctan. Charakterystyczną cechą 2 typu przemian jest wytw wspólnego metabolitu- acetylo- CoA. W 2 etapie wyzwala się tylko ok. 30% energii swobodnej w stosunku do całkowitej energii.
III ETAP PRZEMIAN KATABOLICZNYCH
KATABOLICZNYCH ostatnim etapie produkty etapu II a zwłaszcza acetlo- CoA zostają całkowicie utlenione do CO2 i H2O. Przemiany te obejmują reakcje cyklu Kresa, oraz egzoergiczne procesy oksydoredukcyjne, przebiegające w tzw łańcuchu oddechowym. Odłączone od metabolitów cyklu Kresa wodory zostają przeniesione na tlen atmosferyczny za pomocą składników łańcucha oddechowego. Podczas transportu atomu wodoru i elektronów przez kolejne ogniwa łańcucha oddechowego wyzwala się znaczna część energii, która jest wiązana chemicznie w ATP. Proces tez nazywamy fosforyzacją oksydacyjną. Reakcje oksydoredukcyjne łańcucha oddechowego stanowią zasadnicze źródło energii (ok. 65-70%) dla organizmu.
Glikoliza jest łańcuchem reakcji przekształcającym glukozę w pirogronian z jednoczesną produkcją ATP oraz subst do innych szlaków metab. Jest to szlak metab. czynny w prawie wszyst. org. żywych. (w org. aerobowych). Glikoliza jest etapem wstępnym do cyklu kwasu cytrynowego i łańcucha przenoszenia elektr. W warunkach aerobowych pirogronian dostaje się do mitochon., gdzie ulega całkowitemu utlenieniu do CO2 i H2O. Gdy ilość tlenu jest niewystarczająca (np. aktywnie kurczący się mięsień) pirogronian przekszt. jest w mleczan. W niektórych org. anaerobowych (drożdże) pirogr. przekszt. jest w etanol. Tworzenie się metanolu lub etanolu jest przykładem fermentacji. Również w roślinach ( bulwy ziemniaka) pirogr. przekszt. jest w kwas mlekowy. W pierwszej reakcji pod wpływem dekarboksylazy pirogronianowej (współdziałającej z difosforanem tioaminy - TPP) od cząst. kw. pirogr. odszczepiony zostaje CO2 (nieoksydacyjna dekarboksylacja) i powstaje aldehyd octowy.
Nazewnictwo i budowa monosacharydów. Cukry proste są albo aldehydami, albo ketonami, zawierającymi dwie lub więcej grup hydroksylowych. Mają one wzór ogólny (CH2O)n. Najprostsze o n=3 to ald. glicerynowy i dihydroksyaceton, inaczej nazywamy je triozami. Aldeh. glicer. Nazwano aldozą a dihydroksyaceton - ketozą. Aldeh. glic. zawiera 1 asymetryczny at. węgla. Istnieją zatem dwa izomery przestrzenne tej trójwęglowej aldozy zwane ald. D-gliceryno-wym i ald. L-glicerynowym. Litery D i L opisują konfigurację przestrzenną. Cukry o 4, 5, 6, 7-u at. węgla nazywamy tetrozami, pentozami, heksozami i heptozami. D-glukoza i D-fruktoza to dwie heksozy. Symbol „D” mówi, że bezwzględna konfiguracja at. węgla najdalszego od gr. aldehydowej lub ketonowej, a mianowicie C-5 jest taka sama jak w ald. D-glicerynowym. W r-rze nie dominują pokazane tu otwarte struktury łańcuchowe glukozy i fruktozy. Zazwyczaj łańcuchy te ulegają cyklizacji, tworząc struktury pierścieniowe. Ald. może reagować z alkoholem, tworząc hemiacetal. Gr. aldehydowa C-1 w formie łańcuchowej glukozy reaguje z gr. hydroksylową przy C-5, tworząc wewnątrzcząsteczkowy półacetal. Powstaje 6-cio członowy pierścień cukrowy zwany pirano-zowym, z powodu podobieństwa do piranu. Ketony reagują z alkoholami w podobny sposób , również tworzą wiązania półacetalowe, hemiketalowe. Gr. ketonowa C-2 w strukturze łańcuchowej fruktozy reaguje z gr. hydroksylową przy C-5 tworząc wewnątrzcząst. hemiketal. Z powodu podobieństwa do furanu, powstający w tej reakcji 5-cio członowy pierścień cukrowy nazywamy furanozą. Wzory glukopiranozy i fruktopiranozy często przedstawia się za pomocą rzutów Howartha. Krawędź pierścienia znajdująca się najbliżej czytelnika zaznaczona jest grubą linią. Podczas cyklizacji glukozy powstaje dodatkowy węgiel asymetryczny. Węgiel C-1 to jest węgiel gr. karbonylowej (zw. karbonylowe to aldehydy i ketony), struktury łańcuchowej staje się centrum asymetrii w formie pierścieniowej. Mogą utworzyć się dwie struktury pierścieniowe alfa-D-glukopiranoza i beta-D-glukopiranoza. Znak „alfa” oznacza że gr. hydroksylowa przy węglu C-1 mieści się poniżej płaszczyzny pierścienia, a „beta” oznacza że jest ona skierowana w górę od płaszcz. pierścienia. Węgiel C-1 nazywamy węglem asymetrycznym, a formy formy „alfa” i „beta” są zwane anomerami. Podobnie dzieje się w strukturze pierścieniowej fruktozy, z tym że oznaczenie „alfa” lub „beta” dotyczy gr. hydroksylowej przy C-2 to jest węglu anomerycznym w ketozach. Przejście anomeru alfa w ano mer beta lub odwrotnie zachodzi przez łańcuchową postać tego cukru i wiąże się ze zmianą skręcalności optycznej, zjawisk to nosi nazwę mutarotacji. Epimeria- jeżeli 2 monosacharydy różnią się położeniem podstawników H i O przy jednym atomie C z wyjątkiem C grupy karbonylowe (aldehydowej lub ketonowej) są określane epimerami, a ta forma izomerii nosi nazwę epimerii. Enancjomeria- jest formą izomerii polegającą na występowaniuw 2 postaciah, z których jedna jest odbiciem zwierciadlanym drugiej. Enancjomerycznym formom cukrów przypisano D i L.
Przegląd kluczowych struktur i reakcji. Zw. pośrednie w procesie glikolizy mają albo 6 albo 3 at. węgla. Jednostki 6-cio węglowe są w glikolizie pochodnymi glukozy i fruktozy. Jednostki 3-węglowe są pochodnymi dihydroksyacetonu, ald. glicerynowego, glicerynianu lub pirogronianu. Wszystkie intermediaty w glikolizie między glukozą a pirogronianem są fosforylowane. Grupy fosforanowe wiązą się z nimi wiązaniami albo estrowymi, albo bezwodnikowymi. Ważniejsze reakcje zachodzące podczas glikolizy: 1. Przeniesienie gr. fosforanowej. Gr. fosforanowa jest przenoszona z ATP na intermediat glikolizy lub vice-versa. 2. Przesunięcie fosforanu. Gr. fosf. jest translokowana wewnątrz jednej cząst. z jednego azotanu na drugi. 3. Izomeryzacja. Ketoza jest przekształcana w aldozę lub odwrotnie. 4. Dehydra-tacja. Odłączona zostaje cząst. wody. 5. Odszczepienie aldolowe. Wiązanie C-C ulega rozerwaniu. Jest to reakcja odwrotna do kondensacji aldolowej.
SZLAK GLIKOLIZY
Jej reakcje zachodzą w cytozolu kom. Pierwsza faza - przekształcenie glukozy we fruktozo-1,6-bisfosforan obejmuje trzy etapy - fosforylację, izomeryzację, drugą fosforylację. Celem tej początkowej fazy glikolizy jest stworzenie zw. łatwo ulegającego rozszczepieniu na fosforylowane jednostki trójwęglowe. Związki 3-węglowe są następnie wykorzystywane jako źródło energii. Pierwszą reakcją jest fosforylowanie glukozy fosforanem pochodzącym z ATP co prowadzi do glukozo-6-fosforanu. Przeniesienie gr. fosf. z ATP na gr. hydroks. przy C-6 glukozy katalizuje enzym heksokinaza lub glikokinaza. Reakcja jest nieodwracalna . Następnym etapem jest izomeryzacja glukozo-6-fosf. do fruktozo-6-fosf. Jest to przekształcenie aldozy w ketozę. Przemianę tę katalizuje enzym fosfofuktoizomeraza. Wytworzony ester monofosforanowy ulega pod wpływem fosfofruktokinazy dalszej fosforylacji do fruktozo-1,6-bisfosforanu. Druga faza procesu glikolizy składa się z 4 etapów rozpoczynających się od rozszczepienia cząst. fruktozo-1,6-bisfosf. (rozszczepienie aldolowe) na ald. 3-fosfoglicerynowy i fosf. 1,3-dihydroksyacetonu. Reakcja ta jest katalizowana przez aldolazę fruktozobisfosforanową. W drukiej fazie glikolizy następuje wyzwolenie części energii nagromadzonej (podczas fotosyntezy) w cukrach. Ald. fosfoglicerynowy jest bezpośrednim substratem glikolizy, natomiast fosfodihydroksyaceton nie jest. Jednak może być łatwo przekształcony w ald. 3-fosfoglicerynowy przez izomerazę triozofosforanową. W ten sposób z 1 cząst. fruktozobisfosf. tworzą się 2 cząst. ald. 3-fosfoglicerynowego. Nie nastąpiło jeszcze uwolnienie energii, a wręcz odwrotnie zostały zużyte 2 cząst. ATP. Następnym etapem glikolizy jest utlenianie (odwodorowanie) aldehydu 3-fosfoglicerynowego i jego fosforylacja. Enzym odpowiedzialny za to utlenianie - dehydrogenaza triozofosforanowa zawiera w centrum aktywnym gr. -SH cysteiny i współ działa z koenzymem NAD+ lub NADP+. Na początku reakcji gr. aldehydowa cząst. aldehydu związuje się z gr. -SH enzymu, po czym następuje odłączenie wodoru i przeniesienie go na NAD. Wytworzony w opisany sposób tioester (C~S-wysokoenerg. wiązanie tioestrowe) ulega w obecności H3PO4 fosforolizie dając 1,3-bisfosfoglicerynian. Następnie kinaza fosfoglicerynianowa przenosi resztę fosforanową wraz z energią na ADP tworząc ATP i 3-fosfoglicerynian. Biosynteza ATP (fosforylacja ADP) dokonująca się bezpośrednio w wyniku utleniania ald. 3-fosfoglicerynowego (substratu) nosi nazwę fosforylacji substratowej. Jest to główna forma wytwarzania energii podczas oddychania beztlenowego w toku glikolizy. Z jednej cząst. glukozy powstają 2 fosfotriozy, a ich utlenianie dostarcza dwóch cząst. ATP (4-2). Jeśli proces degradacji glukozy zachodzi w warunkach tlenowych, wówczas 2 pary at. zredukowanego NAD (2 cząst.) są przekazywane na łańcuch oddechowy, dostarczając dodatkowo 6 cząst. ATP (6+4-2=8). Natomiast w warunkach beztl. Koenzym NAD jest używany w końcowych etapach glikolizy jako czynnik redukujący. W następnej fazie glikolizy 3-fosfoglicerynian musi ulec przekształceniu wewnętrznemu, które polega na przeniesieniu gr. fosf. z pozycji trzeciej (C-3) na drugą (C-2). Przemianę tę katalizuje enzym mitozę fosfoglicerynianową (z klasy transferaz), reakcja jest odwracalna. Odwodnienie (dehydratacja) 2-fosfoglicerynianu podczas reakcji z enolazą powoduje przekształcenie wiązania estrowego przy C-2 w wiązanie wysokoenerg. produktem reakcji jest fosfoenolopirogronian. Dzięki tej reakcji możliwa jest synteza kolejnej cząst. ATP. Enzym kinaza pirogronianowa katalizuje transport gr. fosf. wraz z wiązaniami makroergicznymi substr. fosfoenolopirogronianu na ADP, dając ATP.(jest to 3 nieodwracalna reakcja) Jest to również przykład fosforylacji ADP zachodzącej na poziomie substratu. Produktem omawianej reakcji oprócz ATP jest enolopirogronian., który samorzutnie przekształca się w jego izomeryczną postać - pirogronian (forma trwalsza). Wytworzony w toku glikolizy kw. pirogronowy jest węzłowym metabolitem w przemianach węglowodanów.
GLIKOLIZA BEZTLENOWA
W niektórych warunkach glikoliza tlenowa nie może funkcjonować. Dotyczy to kom nie posiadających mitochondriów np. erytrocyty, płytki krwi lub kom niedostatecznie zaopatrywane w tlen np. kom mięśni szkieletowych podczas wysiłku. Glikoliza tlenowa jest także zahamowywana w sytuacji gdy ilość powstającego NADH przekracza możliwości jego utleniania przez łańcuch oddechowy. Większość reakcji glikolizy beztlenowej pokrywa się z przebiegiem glikolizy tlenowej. Jedyna różnica polega na tym, że NADH++H+ nie jest utleniany prze mitochondrialny łańcuch oddechowy, lecz przez końcowy produkt glikolizy jakim jest pirogronian. Redukcja pirogronianu do mleczanu przy równoczesnym utl NADH++H+ do NAD+ zachodzi w cytosolu pod katalistycznym działaniem dehydrogenazy mleczanowej (reakcja od glu do mleczanu dostarcza 2 ATP). Fermentacja alkoholowa- drożdże i niektóre bakterie przekształcają pirogr w alkohol etylowy. Proces ten obejmuje 2 reakcje. Dekarbosylacje, która polega na odłączeniu grupy karbonylowej pirogronianu w postaci CO2 z wytworzeniem aldehydu octowego oraz redukcję powstałego aldehydu przez NADH++H do etanolu.
CYKL KREBSA (KWASÓW TRIKARBOKSYLOWYCH)
Następnym etapem produkcji energii z glukozy w warunkach tlenowych jest oksydacyjna dekarboksylacja pirogronianu do acetylo-CoA. Aktywny acetyl jest kompletnie utleniany do CO2 w serii reakcji zwanych cyklem Krebsa. Cykl ten jest końcowym wspólnym szlakiem utleniania cząsteczek materiału energetycznego - aminokwasów, kw. tłuszczowych i węglowodorów. Większość tych związków wchodzi do cyklu pod postacią acetylo-CoA. Cykl kw. cytrynowego dostarcza także intermediatów do biosyntez. Reakcje cyklu Krebsa (cyklu kw. cytrynowego) przebiegają wewnątrz mitochondriów w przeciwieństwie do reakcji glikolizy, przebiegających w cytozolu.
Powstawanie acetylo-CoA z pirogronianu. Pomostem łączącym glikolizę z cyklem Krebsa jest zachodząca w matriks mit. Oksydacyjna dekarboksylacja pirogronianu. Cząst. kw. pirogronowego w obecności tlenu ulega dekarboksylacji (traci CO2) do aldehydu octowego. Następnie aldehyd ten ulega odwodorowaniu (utlenieniu) do reszty acetylowej (CH3CO-), która wiąże się z CoA, tworząc acetylo-CoA. Odłączony wodór wiązany jest przez NAD. W złożonym procesie dekarboks. oksyd. pirogronianu bierze również udział pirofosforan tiaminy (TPP) oraz kw. limonowy (Lip-S2). Równanie sumaryczne wg., którego zachodzi przemiana kw. pirogronowego w czynny octan:
CH3COCOOH + CoA-SH + NAD+ ->(deh. pirogr., Lip S2, TPP,FAD)-> CH3CO~SCoA + NADH+H+ + CO2
Proces ten obejmuje kilka reakcji, które są katalizowane przez wieloskładnikowy kompleks enzymatyczny - dehydrogenaza pirogronianowa.
Przemiany biochemiczne cyklu Krebsa. Podst. substratem jest rodnik acetylowi aktywnego octanu. Dwuwęglowa gr. acetylowa (CH3CO-) włączona do cyklu Krebsa zostaje w wyniku kolejnych reakcji rozłożona na 2 cząst. CO2. Jednocześnie od pośrednich metabolitów cyklu zostają oderwane 4 pary at. wodoru (utlenianie), które są przyjmowane przez koenzymy (NAD i FAD), współdziałające z odp. dehydrogenazami. Uwolniony podczas dekarboksylacji CO2 jest prod. ubocznym, natomiast istotę cyklu Krebsa stanowią wspomniane kolejne reakcje odwodorowania. Oderwane od metabolitów wodory są wiązane przez koenzymy NAD i FAD, a następnie za pomocą skł. łańcucha oddechowego przeniesione na tlen cząsteczkowy z wytworzeniem H2O. Wyzwalająca się wówczas energia swobodna jest gromadzona w formie ATP, tak więc energia chem. zawarta w końcowych produktach cyklu Krebsa (NADH2 i FADH2) zostaje uwolniona dopiero na poziomie łań. oddech. Utlenianie i degradację acetylo-CoA w cyklu Krebsa można najprościej ująć w formie ogólnego równania:
CH3CO~SCoA + 3H2O + 3NAD+ + FAD -> 2CO2 + 3NADH+H+ + FADH2+CoA-SH Kondensacja reszty acetylowej pochadzącejnz acetylo-S-CoA ze szczawiooctanem jet katalizowana przez syntazę cytrynianową. Reakcja ta obejmuje wytw. wiązania C-C pomiędzy węglem gr. metylowej (CH3) acetylo-CoA i węglem gr. ketonowej (CO) szczawiooctanu. Powstały kw. cytrynowy pod wpływem enz. hydratazy akonitanowej ulega izomeryzacji do kw. izocytrynowego (zw. pośrednim w tej przemianie jest kw. cisakonitowy). Kwas izocytrynowy jest następnie utleniany do kw. szczawiobursztynowego. Reakcja ta polega na odwodorowniu drugorzędowej -CHOH i przekształceniu jej w gr. -CO. Przemianę tę kat. dehydrogenaza izocytrynianowa (dekarboksylująca), współdziałająca z koenzymem NAD jako przenośnikiem at. wodoru. Powstały kw. szczawiobursztynowy pod wpływem tej samej dehydrogenazy łatwo ulega dekarboksylacji do kw. 2-oksoglutarowego. W kolejnej reakcji cyklu kw. 2-oksoglutarowy podlega dekarboksylacji oksydacyjnej. Mechanizm tej przemiany jest analogony do opisanej wyżej dekarboks. oksyd. pirogroninu. Powstały produkt reakcji sukcynylo-S-CoA (bursztynylo-S-CoA) jest związkiem bogatym w energię. Przemiana dokonuje się na zespole wieloenzymowym, który nosi nazwę kompleksu dehydrogenazy-2-oksoglutaranowej. Sukcynylo-S-CoA może przenieść swoje wysokoenerg. wiązanie na GDP z wytworzeniem GTP, kw. bursztynowego i CoA-SH z udziałem enzymu syntetazy bursztynylo-CoA.
W dalszym przebiegu cyklu kw. bursztynowy ulega odwodorowaniu do kw. fumarowego. Reakcja ta jest katalizowana przez dehydrogenazę bursztynianową będącą flawoproteiną.
Wytworzony kw. fumarowy ulega następnie hydratacji pod wpływem enzymu fumaraza
W wyniku czego powstaje kw. jabłkowy ostatecznie kwas jabłkowy który ostatecznie zostaje przekształcony przez dehydrogenazę jabłczanową współdziałającą z koenzymem NAD w kw. szczawiooctowy który zamyka cykl.
Z przytoczonych wyżej reakcji wynika że przy jednym obrocie cyklu 2 atomy węgla zostają oderwane w postaci CO2. Atomy nie pochodzą jednak z Acetylo-CoA włączonego bezpośrednio do kwasu cytrynowego. Dopiero zregenerowany kwas szczawiooctowy zawiera znaczone atomy węgla, które przy kolejnym obrocie cyklu formują znaczony CO2. Cykl Krebsa łączy różnorodne procesy kataboliczne i anaboliczne. Podstawowym zadaniem cyklu jest dostarczenie komórce zredukowanych koenzymów NADH2 i FADH2. Cykl dostarcza równieżwielu metabolitów do biosyntezy niezbędnych dla komórki oraz jest głównym producentem CO2.
Cykl Krebsa można przedstawić: Acetylo-S-CoA+ 3 NAD+ + FAD+ + GDP+ Pi+2 H2O= 2 CO2+ 3NADH+ 3H+ + GTP+ CoA-SH
Łańcuch oddechowy i fosforylacja oksydacyjna.
Utworzone podczas glikolizy , utleniania kwasów tłuszczowych oraz cyklu kwasów trójkarboksylowych NADH2 i FADH2 są cząsteczkami wysokoenergetycznymi, ponieważ zawierają pary elektronów o dużym potencjale przenoszenia. Podczas ich przenoszenia (na cz. tlenu) wydziela się znaczna ilość energii. Energia ta jest wykorzystywana do syntezy ATP.
Proces syntezy ATP zachodzący w miarę przepływu elektronów z NADH lub FADH2 na O2 przez zespół przenośników elektronów nazywany jest fosforyzacją oksydacyjną. Jest ona głównym źródłem ATP w organizmach aerobowych. Np. spośród 36 cząsteczek ATP syntetyzowanych w czasie rozkładu glukozy do CO2 i H2O- 32 cząsteczki powstają w wyniku fosforyzacji oksydacyjnej.
Proces ten wykazuje następujące cechy:
Fosforyzacja oksydacyjna zachodzi w zespołach oddechowych zlokalizowanych w wewnętrznej błonie mitochondrialnej. Cykl kw. cytrynowego i utlenianie kwasów tłuszczowych dostarczające większości NADH2 i FADH2, przebiegają w przyległej matriks mitochondrialnej.Utlenianie jednej cząsteczki NADH dostarcza 3 cząsteczek ATP. Utlenianie FADH2 dostarcza 2 ATP.Utlenianie i fosforyzacja SA procesami wzajemnie sprzężonymi.
Zespół oddechowy zawiera liczne przenośniki elektronów takie jak cytochromy. Stopniowe przekazywanie elektronów z NADH lub FADH2 do O2 dzieli sumaryczną zmiane swobodnej energii co umożliwia syntezę wiecej niż 1 cz. ATP.
W trakcie działania łańcucha oddechowego dokonywane SA 3 fosforylacje. Fosforyzacja oksydacyjna zachodzi w mitochondriach. Organelle te zawierają dwa systemy błon. Błonę zewnętrzną i dobrze wykształconą i pofałdowaną błonę wewnętrzną. Błona wew. Swymi pofałdowaniami tworzy tzw. grzebienie mitochondrialne. W mitochondriach można zauważyć 2 przedziały- zewnętrzny międzybłonowy zawarty między błona zew. i wew. Oraz wewnętrzny otoczony błoną wewnętrzną , stanowiący matriks mitochondrialną. Łańcuch oddechowy(zespół oddechowy) stanowi integralny składnik błony wewnętrznej, podczas gdy większość reakcji cyklu kwasu cytrynowego oraz utlenianie kwasów tłuszczowych zachodzi w matriks.
Jak już wielokrotnie podkreślono- utlenianie danego substratu polega na oderwaniu od jego cząsteczki 2 atomów wodoru które są przejściow związywane przez koenzymy NAD lub FAD odpowiednich dehydrogenaz. Tak np. dehydrogenazy współdziałające z NAD: izocytrynianowa-2-oksyglutaranowa, jabłczanowa - stanowią pierwsze ogniwo łańcucha oddechowego kolejnym przenośnikiem atomu wodoru z NADH w łańcuchu są dehydrogenazy zredukowanego FAD to jest pobierające wodór z NADH, zwane również flawoproteinami. Są to w istocie białka żelazosiarkowe związane trwale z mononukleotydemflawinowym (FMN) jako grupa prosyntetyczna. W nastepnym etapie para atomów wodoru zostaje skierowana na ubichinion czyli koenzym Q. Redukując go do koenzymuQH2 (ubihydrochinon). Zredukowany ubichinon przekazuje już sam elektrony na układ cytochromowy i oksydaze cytochromową redukując cząsteczkę tlenu do O2 minus. Protony natomiast przenikają do środowiska i przyłączają się poza łańcuchem oddechowym do zredukowanego tlenu.
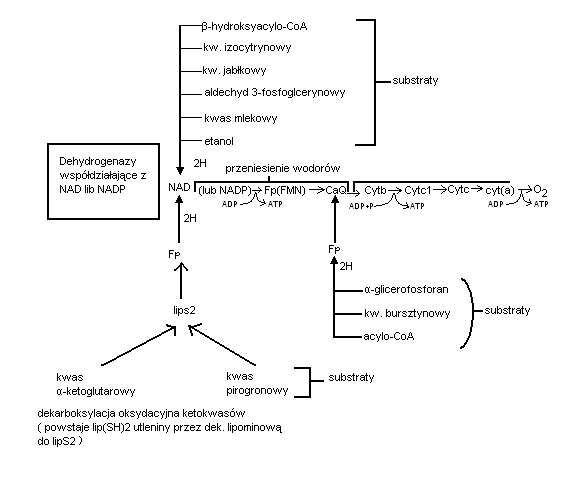
Składa się z łańcucha głównego głównego krótkich łańcuchów bocznych. Łańcuch główny zaczyna się od dehydrogenaz współdziałających z NAD, a następnie przebiega przez flawoproteiny ( Fp ), koenzym Q i cytochromy.
Na pierwsze ogniwo łańcucha głównego tj. na dehydrogenazy współdziałające z NAD lub niekiedy niekiedy NADP przekazuje swe wodory większość utlenianych w komórce substratów. Są to: aldehyd 3-fosfoglicerynowy, kw. mlekowy, etanol ( metabolity glikolizy ); glukozo-6-fosforan kwas 6-fosforanowy { cykl pentozofosforanowy ); β-hydroksyacylo-CoA, kwas izocytrynowy i cytrynowy ( metabolity cyklu kresa ) i wiele innych związków. Nie wszystkie substraty przekazują pary atomów wodoru do głównego łańcucha oddechowego za pośrednictwem dehydrogenaz współdziałających współdziałających NAD ( lub NADP ).
Koenzymy związane z FAD odszczepiają pary atomów wodoru od kwasu bursztynowego { cykl krebsa ), acylo-CoA (β-oksydacja kwasów tłuszczowych )transportując je bezpośrednio na CoQ
Podczas dekarboksylacji oksydacyjnej ketokwasów ( pirogronian i α-ketoglutaran) powstaje miedzy innymi zredukowany octan który jest utleniany przez dehydrogenazę. Dopiero dehydrogenaza zwiazana z FADH2 przekazuje swe wodory na pierwszy człon łańcucha głównego tj. na NAD. Przeniesienie każdej pary elektronów i całych wodorów z NADH2 przez łańcuch oddechowy na tlen związane jest z biosyntezą trzech cząsteczek ATP. Gdy utlenianie substratu zapoczątkowują dehydrogenazy lawinowe współdziałające z FAD w łańcuchu oddechowym powstają dwie cząsteczki ATP. Sprzężenie transportu elektronów na określonym odcinku łańcucha z biosynteza ATP nazywamy fosforylacą
W jaki sposób utlenianie NADH jest sprzężone z fosforyzacją ADP? Początkowo sugerowano że przepływ elektronów przez łańcuch oddechowy prowadzi do utworzenia się wysokoenergetycznego intermediatu, który mógłby służyć jako prekursor ATP. Nie wyizolowano jednak bogatych w energię intermediatów tego typu. W związku z tym Peter Mitchell przedstawił hipotezę chemiosmotyczną i zaproponował radykalnie odmienny mechanizm zgodnie z którym transport elektronów i synteza ATP są sprzężone przez gradient protonowy a nie przez intermedia intermedia wysokiej energii. Według hipotezy chemioosmotycznej przepływ elektronów przez łańcuch oddechowy powoduje przepompowanie protonów protonów matriksowej ( wewnętrznej ) na cytoplazmatyczną ( zewnętrzną ) stronę wewnętrznej błony mitochondrialnej. Stężenie jonów wodorowych wzrasta po cytoplazmatycznej stronie błony, wytwarza się potencjał; przy czym cytoplazmatyczna strona błony ładuję się dodatnio.
Transport elektronów przez łańcuch oddechowy, powoduje wypompowanie protonów z matriks poza cytoplazmatyczną powierzchnię wewnętrznej błony mitochondrialnej. Podstawowe znaczenie w procesach akumulacji energii według hipotezy chemioosmotycznej ma wytworzenie się gradientu stężeń protonów protonów poprzek wewnętrznej błony.
Istota proponowanego mechanizmu sprowadza się więc do tego że podstawowym procesem, umożliwiającym wychwytywanie i zachowanieenergii uwalnianej podczas utleniania komórkowego jest przepływ protonów protonów poprzek wewnętrznej błony mitochondrialnej. Obecnie istnieje wiele dowodów potwierdzających hipotezę Mitchella. Gradient protonowy tworzy się w 3 miejscach. W miarę przepływu elektronów od NAD do O2 przez łańcuch oddechowy w trzech miejscach następuje pompowanie protonów protonów poprzek wewnętrznej błony mitochondrialnej. Miejscem pierwszym jest kompleks dehydrogenazy NADH. Miejsce drugie to kompleks reduktazy- czyli miejsce pomiędzy cytochromem b a cytochromem c1. Miejscem trzecim jest kompleks oksydazy cytochromowej C. Gradient protonowy wytworzony w każdym z tych trzech miejsc przez przepływ pary elektronów pochodzących z jednej czasteczki NADH jest wykorzystywany do syntezy jednej cz. ATP ( przy utworzeniu się gradientu we wszystkich 3 miejscach utlenianie się gradientu we wszystkich 3 miejscach, utlenianie jednej czasteczki NADH prowadzi zatem do syntezy właśnie 3 czasteczek ATP).
FOSFORYLACJA OKSYDACYJNA
Przepływ el z NADH do O2 przez kompleksy białkowe w wewn błonie mitoch powoduje wypompowanie protonów z matrix. Wytworzona siła protonomotoryczna składa się z gradientu Ph i transbłonowego potencjału elektrycznego. Synteza ATP zachodzi dzięki powrotnemu przepływowi protonów przez kompleks enzymatyczny do matrix. Utlenianie sprzężone jest z fosforydacją dzięki gradientowi protonowemu. Istotę fosforydacji-przekształcenie siły elektromotorycznej w protomotoryczną, a następnie w potencjał fosforydacyjny. W I fazie są 3 pompy protonowe napędzane el: reduktaza NADH-Q, reduktaza cytochromowa i oksydaza cytochromowa. W II fazie uczestniczy synteza ATP. ATP jest syntetyzowane przez kompleks enzymatyczny złożony z kanałowej podjednostki F0 przewodzącej protony i katalicznej F1. W cząsteczkach mitoch bez buławek przebiega transport elektonów, ale nie potrafią one syntezować ATP. Podjednostka F1 zawiera 5 rodzajów łańcuchów polipeptydowych. Przepływ protonów przez syntazę ATP powoduje uwolnienie ściśle związanego ATP. Syntaza ATP katalizuje synteze ATP z ADP i Pi. Protony w F1 uwalniają tlen i przesuwają równowagę do syntezy ATP. Zasadnicza rola gradientu protonowego-odłączenie nuleotydu od syntazy. Syntaza ATP wykazuje kooperatywność katalityczną.
BILANS ENERGETYCZNY CALKOWITEGO UTLENIANIA GLUKOZY
Każda z 2 cząsteczek NAD daje 2 cząsteczki ATP bo trzecia to koszt transportu. Ogólna wydajność produkcji ATP jest duża. W war. stand 1 cz. daje 686 kcal. Wydajność termodynamiczna tworzenia ATP podczas utleniania glukozy wynosi 38%. Podczas całkowitego utleniania glukozy do CO2 powstaje 30 cząsteczek ATP a 26 - fosforydacja oksydacyjna.
Rodzaj procesu |
Substraty podlegające utlenieniu lub innym przemianom |
Sposób powstawania ATP |
Liczba moli ATP na 1 mol glukozy |
glikoliza |
2 cz aldehydu 3 - fosfoglicerynowego |
Utl. 2 NADH w łańcuchu odd. |
6 (4) |
|
2 cz. 1,3 - bisfosfoglicerynianu |
Fosforylacja substratowa |
2 |
|
2 cz. fosfoenolopirogronianu |
Fosforylacja substratowa |
2 |
|
Zużycie 2 ATP na podwójną fosforylację heksozy |
10 (8)
8 (6) |
|
Dekarboksylacja oksydacyjna kwasu pirogronowego, cykl cytrynianowy |
2 cz. Kwasu pirogronowego |
Utl. 2 NADH w łańcuchu odd. |
6 |
|
2 cz. Kwasu izocytrynowego |
Utl. 2 NADH w łańcuchu odd. |
6 |
|
2 cz. Kwasu alfaketoglutarowego |
Utl. 2 NADH w łańcuchu odd. |
6 |
|
2 cz. Sukcynylo-S-CoA |
Fosforylacja substratowa |
2 |
|
2 cz. Kwasu bursztynowego |
Utl. 2 FADH2 w łańcuchu |
4 |
|
2 cz. Kwasu jabłkowego |
Utl. 2 NADH w łańcuchu |
6 |
|
Liczba moli ATP wytworzona w wyniku rozkładu 1 mola glukozy w war. Tlenowych Liczba moli ATP w war. Beztlenowych |
30 (zysk z tego wyżej) 38 (36) 2 |
|
CYKL PENTOZOWY
Cykl pentozowy jest alternatywnym do glikolizy szlakiem przemiany glukozy.W glikolizie chodzi glownie o synteze ATP kosztem utleniania glukozy. Cykl pentozowy zaś wytwarza innego rodzaju energie metaboliczna-potencjal redukcyjny. Niektóre z el i atomów H2 cząsteczek materiału energetycznego musza być zachowane do celów biosyntezy i nie są przekazywane w celu uzyskania ATP.Zrodlem latwo dostępnego potencjalu redukcyjnego w kom jest NADPH. Są zasadnicze różnice miedzy NADH i NADPH.NADH jest utleniany w łan.odd. a wydzielona przy tym energia sluży do syntezy ATP.Zas NADPH sluzy jako donor protonow i el podczas redukcyjnych procesow biosyntezy.Badania przemian zwanych obecnie cyklem pentozowym doprowadzilyu do wniosku ze istnieje droga bezpośredniego skracania łańcucha tego cukru o pierwszy atom C bez rozczepienia do triozofosforanow.Cykl pentozowy przebiega w cytoplazmie i można w nim wyróżnić dwie części, które nie muszą występować po sobie.
UTLENIANIE GLUKOZO-6-P
Proces katabolizmu glukozy rozpoczyna się od glukoz-6-P który to zw zostaje utleniony do 6-fosfoglukonolaktonu.Utlenianie to polega na odlaczeniu atomow H2od glukozofosforanu i przeniesieniu ich na NADP.Reakcje te katalizuje dehydrogenaza glukozo-6-fosforanowa.Hydroliza 6-fosfogluikonolaktonu na kwas 6-fosfoglukonowy odbywa się z udzialem glukonolaktonazy.Kolejna reakcja obejmuje odwodorowanie kwasu 6-fosfoglukonowego po czym dekarboksylacje nietrwalewgo produktu pośredniego dajac rybulozo-5-fosforan.Obie reakcje katalizuje dehydrogenaza6-fosfoglukonianowa.Dalsze przemiany rybulozo-5-fosforanu maja na celu odtworzenieglukozo-6-P a także dostarcza org pentoz.
REGENERACJA GLUKOZO-6-P
Z rybulozo-5-fosforanu mogą powstawać inne pentozy. Pod wpływem izomerazy rybozofosforanowej z rybulozo-5-fosforanu powstaje rybozo-5-fosforan, a pod wpływem epimerazy rybulozofosforanowej powstaje ksululozo-5-fosforan. Np. z 3 cz rybulozofosforanu powstaja 2 cz ksylulozofosforanu i tylko 1 cz rybozofosforanu a w nastepenej reakcji katalizowanej przez transketolaze fragment dwuweglowy zostaje przeniesiony z ksylulozo-5-P na rybozo-5-P co prowadzi do wytworzenia się aldehydu 3-fosfoglicerynowego i sedoheptulozo-7-P w dalszym ciagu cyklu reszta trojweglowa dihydroksyacetonu jest przenoszona z udzialem transaldolazy z 7-fosforanusedoheptulozy na aldehyd 3-fosfoglicerynowy i tworzy sie tetroza -erytrozo-4-fosroran oraz pierwsza czasteczka zregenerowanej heksozy w postaci 6-fosforanu fruktozy.Erytrozo-4-P w nastepnej reakcji katalizowanej przez transketolaze sluzy jako akceptor reszty ketolowej przeniesionej z 2 czasteczki ksylulozo-5-P.owstaje wtedy druga czasteczka zregenerowanego heksozofosforanu w postaci fruktozo-6-P i cz aldehydu 3-fosfoglicerynowego.Ten ostatni z druga czasteczka triozofosforanu może przy udziale aldolazy wytworzyc nastepna cz heksozy.Wiec 3 czasteczki pentozofosforanu przeksztajacaja się w 2 cz heksozofosforanu i 1 triozofosforanu.
Bilans nieoksydacyjnej czesci przedstawia się w ten sposób ze ze 3 czasteczki pentozofosforanu przekształcone zostaja w 2 czasteczki heksozofosforanu i 1 triozofosforanu. Izomeraza glukozsofosforanowa powoduje przekształcenie ufosforylowanej fruktozy w glukozo-6-P.W ten sposób cykl zostaje zmkniety.Ponadto 2 czasteczki aldehydu glicerynowego mogą wytworzyc fruktozo-1,6-bisfosforan przy udziale izomerazy fosfotriozowej i aldolazy.
W pierwszej części cyklu pentozowego powstają więc pentozy, a NADP jest dwukrotnie redukowany.
Równoważniki wodorowe w formie NADPD wykorzystywane są głównie w syntezach wielu związków, w których przebiegu konieczna jest redukcja, jak np. w syntezie kwasów tłuszczowych, dezoksynukleotydów, steroidów czy hemu. Oczywiście wodory z NADPH mogą zostać również spalone w łańcuchu spalań końcowych, ale to zależy od potrzeb komórki i jej stanu metabolicznego.
Jeżeli istnieje zapotrzebowanie na NADPH, a powstająca w przebiegu cyklu pentozowego ilość pentoz jest nadmierna, wówczas zachodzi druga część cyklu, w której wyniku następuje odtworzenie heksoz z pentoz.
RESYNTEZA GLUKOZY
Kwas mlekowy gromadzony jest w pracujących mięśniach a tworzy się w procesie glikolizy przy niedostatecznej ilości O2.Kwas mlekowy zostaje przeniesiony do wątroby gdzie nastepuje z jego udzialem resynteza glukozy.
Reakcja syntezy fosfoenolopirogronianu przebiega droga okrezna,której zw przejściowym jest szczwiooctan-1 z metabolitow cyklu Krebsa.Gdy prekursorem glukozy jest mleczan to produkt jego utlenienia-pirogronian przenika do mitochondriom gdzie przy udziale karboksylazy pirogronianowej i CO2 zostaej przekształcony w szczawiooctan. Przemiana ta wymaga ATP i Mg2+.
glukoneogeneza to proces syntezy glukozy z mleczanu i związków nie cukrowych. W warunkach tlenowych, pod wpływem dehydrogenazy mleczanowej, mleczan przechodzi w pirogronian. Właściwy proces glukoneogenezy rozpoczyna się pirogronianu i jest w dużej mierze odwróceniem procesu glikolizy. Jednak nie wszystkie etapy glikolizy można w prosty sposób odwrócić. Do takich etapów należy przejście:
- glukozy w glukozo-6-fosforan,
- fruktozo-6-fosforanu we fruktozo1,6-dwufosforan,
- fosfoenolopirogronianu w pirogronian,
Glukoneogeneza zachodzi w cytoplazmie, poza pierwszym etapem, czyli karboksylacją pirogronianu. 7 z 10 etapów glikolizy to reakcje odwracalne. W procesie glukoneogenezy przebiegają odwrotnie przy udziale tych samych enzymów. Reakcje nieodwracalne katalizowane są przez kinazy: heksokinazę lub glukokinazę, fosforuktokinazę i kinazę pirogronianową. Reakcje katalizowane przez te enzymy w procesie glikolizy nie zachodzą w procesie glukoneogenezy. Ich przebieg jest katalizowany przez inne enzymy. Przemiana pirogronianu w fosfoenolopirogronian jest reakcją 2-etapową zachodzącą przy udziale 2 enzymów: karboksylazy pirogronianowej i karboksylazy fosfoenolopirogronianowej oraz biosyntezy ATP i GTP. Rozpad fruktozo-1,6-bisfosforanu do fruktozo-6-fosforanu i Pi jest katalizowany prze fruktozo-1,6-bisfosfatazę a hydroliza glukozo-6-fosforanu katalizowana jest przez glukozo-6-fosfatazę.
TŁUSZCZE dzielimy na:lipidy proste( tłuszcze właściwe i woski),
lipidy złożone( fosfolipidy i glikolipidy)
Tłuszcze właściwe: estry trihydoksylowego alkoholu,
naturalne to mieszanka triacylogliceroli diacylogliceroli ,proste acyloglicerole zawieraja jeden rodzaj kwasu.Kwasy tłuszczowe:otrzymuje się przez hydrolize kw., zasad., enzymatyczna z udziałem lipaz, hydroliza = zmydlanie , nienasycone=wiązania po2 (etylenowe), wiązania podwójne powodują łatwe przyłaczanie tlenu.Tłuszcze złożone:fosfolipidy( fosfoglicerydy, fosfosfingozydy) glikolipidy (galaktolipidy)Fosfoglicerydy: zbud. z glicerolu zestryfikowanego 2 resztami kw. tłuszczowych i reszta kw. fosforanowego.Przemiany tłuszczów:nieparzyste kw. tłuszczowe = kw.benzoesowy, parzyste = kw. fenylooctowy .Hydroliza tłuszczów:I etap to hydroliza do glicerolu i kw. tłuszczowych zachodzi to z udziałem lipaz.Przmiany glicerolu:glicerol musi zostac przeształcony do fosfodihydroksyacetonu z udziałem 2 enzymów kinazy glicerolowej która przy udziale ATP katalizuje przeształcenie glicerolu do 3-fosforanuglicerolu oraz dehydrogenzy 3-fosfoglicerolowej która z udziałem NAD katalizuje odwodorowanie substratu do 3-fosfodihydroksyaceton. Następnie może on być włączony do glikolizy jako kw. pirogronowy (kierunek kataboliczny) lub 1,6- bisfosforanfruktozy (kierunek anaboliczny).
Betaoksydacja Reakcja jest katalizowana przez mitochondrialną syntetazę acetylo-S-CoA (tiokinazę) koszt energetyczny tego procesu wynosi2 ATP. Utlenianie kw. Tł. W mitochondriach jest procesem 2etapowym. Pierwszy etap to β- oksydacja- polega na wielokrotnych reakcjach utl. łańcucha przy węglu β, co prowadzi do jego rozpadu zw. na fragmenty 2- węglowe. Jej produktem jest wiele cząst. Acetylo-S-CoA. Drugi etap polega na utl. Reszt acetylowych w cyklu kw. trikarboksylowych do CO2 i H2O. Obydwa procesy są bardzo wydajne pod względem energ. Występują pewne róznice pomiędzy raekcjami β-oksydacji kw. o parzystej i nieparzystej liczbie at. C., o łańcuchu prostym lub rozgałęzionym.Β-Oksydacja nasyconych kw. Tł. O parzystej liczbie at. C.I utl. Acylo-S-CoA: zaczyna się od odłączenia pary at. H od at. węgli α i β katalizowanego przez dehydrogenazę acylo-S-CoA. Akceptorem donorów jest FAD powstaje transΔ2-enoilo-S-CoA (nienasycony S-CoA) i cząsteczka FADH2. II hydratacja nienasconego acylo-S-CoA: produkt poprzedniej reakcji przyłącza wodę w miejscu podwójnego wiązania. Reakcję katalizuje hydrataza enoilo-S-CoA. H wiąże się z Cα, a -OH z Cβ. Powstaje β-hydroksyacylo-S-CoA. III utl. β-hydroksyacylo-S-CoA: utl. Produktu poprzedniej reakcji przy udziale dehydrogenazy β-hydroksyacylo-S-CoA współdział. z NAD. Enzym odłącza parę at. H od β-hydroksyacylo-S-CoA powstaje β-ketoacylo-S-CoA i cząst. NADH+. IV odłączenie acylo-S-CoA: skrócenie łańcucha o frag. 2 węglowy pod działaniem tiolazy i Co-A-SH. Następuje odłączenie acetylo-S-CoA i powstanie nowego acylo-S-CoA krótszego o 2 at. węgla. Bilans energetyczny betaoksydacji: ilość energii uwolnionej w całkowitym utl. Kwasów tłuszczowych zależy od dł. łańcucha np. Kwas palmitynowy (16 at. C) do aktywacji palmitynianu potrzeba 2 ATP. W każdej β-oksydacji zachodzą 2 reakcje utlenienia, pierwsza z udziałem FAD (+2 ATP), druga z udziałem z NAD+ (+3 ATP). Każda β-oksydacja dostarcza więc 5 ATP, utlenienie każdej reszty acetylowej w cyklu Krebsa dostarcza 12 ATP. Proces zachodzi 7-krotnie, w jego wyniku 8 acetylo-S-CoA.
KWASY NUKLEINOWE:
tRNA tranportujący
-przenoszenie zaktywowanych aminokw. do rybosomów na mRNA
-1niciowy łań. polinukleotydowy -80 jed.nukleotyd., 25kDa
-wewnątrz- łańcuchowe. w. wodorowe tworzące pary zasad AU, GC
-struktura II rz.- liść koniczyny ( zawiera 4 pętle)
RAMIE AKCEPTOROWE- 7par nukleotydów, koniec 5' zawiera GMP, koniec C3' sekw. CCA-OH, do reszty adenylanowej przyłącza się aminokwas
R. DIHYDROURACYLOWE-D- składa sięz 3,4 par nukleotydów oraz pętli bogatej w reszty dihydrouracylu
R. TψC- 5par nukleotydów oraz pętla- jednoniciowa zawiera 7 nukleotydów, najwięcej rzadkich zasad: pseudourydyna,4-tiourydyna,1-metyloguanozyna, służy jako punkt zaczepienia syntetazy aa-tRNA
R. ANTYKODONOWE-5par nukleot. oraz pętla zaw. 7 nukleotydów, rozpoznaje kodon matrycy mRNA za pomoca sekwencję 3 nukleotydów komplementarnych
R. DODATKOWE-zmienny skład i liczba nukleotydów, funkcja nie jest określona
rRNA rybosomowy
-pełni gł. funkcje strukturalna
-wchodzi w skład rybosomów (60-65%)
- składa się z dwóch podjednostek: małej i dużej
-rybosomy Procaryota 70S -50S(5S,23SrRNA+34bialkaL)30S(16SrRNA+21bialekS)
-ryb. Eucar.80S-60S(5,5,8,28SrRNA+50bialek)40S(18SrRNA+33bialka)
mRNA informacyjny
-przenosi informację zapisana w DNA do rybosomów
-otwarty łańcuch, nie ma większych wewnątrz-łńcuchowychn pofałdowań
-koniec C-5'- oczapeczkowanie- przyłączanie 7-metyoguanozyny przez mostek trifosforanowy przez gr 5' -OH rybozy
-koniec C-3'-ogon poliA-20-300nukleot. adenylowych, chroni przed 3'-egzonukleazami
-sekwencja zasad odpowiada kolejności aminokwasów w białku
-nadmiar sekwencji nukleotydowych w stosunku do długości białka
-pre-mRNA zaw. egzony i introny wycinane ( splicing) przez spliceosom
-może być mono- lub policistronowy
-informosomy-mRNA+bialka u Eucar.- chroni przed egzonukleazami w jadrze
-czas istnienia od kilku minut do kilkunastu godzin
REPLIKACJA
-3ogolne procesy:rozdzielenie i zabezpiecznie nici,synteza,naprawa bledow
-model semikonserwatywny,podczas fazy S,endoreplikacja(poza cyklem kom.):pelna lub wybiorcza
u PROCARYOTA
enzymem kat. replikacje jest polimeraza DNA wyst. w3 typach: wszystkie typy mogoa przyłączać nukleotydy oraz posiadaja aktywność 5'->3'
PolimerazaI- poj.lan.polinukleotydowy,naprawa bledow,usuwa starteryRNA
polimerazaII- poj.lan.polinukleotydowy,tylko naprawa bledow
Pol.III- bialko z wielu podjednostek 900kDa,wlasciwa polimeraza (wymaga Mg2+,startera)
Proces:1. kolisty chromosom-zawiera miejsca ori, gdzie nastepuje rozwiniecie nici i tworza się widelki replik. w obu kier.2 helikaza-bialko destabilizujące spirale(1ATP na 1obrot),SSB-bialko wiążące 1niciowy DNA zapobiega ponownemu łączeniu DNA3 tropoizomerazaI przecina 1 z 2 nici umożliwiając swobodny obrot,potem je laczy;tropoizomerazaII-relaksuje superhelikalne naprężenia,przecina i spaja DNA przed widelkami, praca od ATP 4prymaza-polimeraza RNA tworzy startery od 5 u Proc. Do 10u Eucar, nukleotydow. 5 polimeraza DNAIII- synteza od 5'do3' (odczyt od3' do 5'),tworzy wiazanie 3'->5'fosfodiestrowe 6 polimDNAI-usuwanie starterow 7.ligaza-laczy DNA
u EUCARYOTA
-10razy wolniej,wiele miejsc replikacji,wiele replikonow
-kat. Przez replisom(zbiór enzymów biorących udział w replikacji i kw nukleinowe)
-5 rodzajow polimeraz α-dziala na nici opóźnionej, aktywność prymazy β-naprawa γ-naprawa δ-dziala na nici wiodacej, wl korekcyjne ε-w mitochondriom
-przed replikacja odwinety DNA z nukleosomow
-przy nici opóźnionej koncowe odcinki skracane, telomeraza -enzym RNP posiada wlasna matryce i jest odwrotna transkryptaza
TRANSKRYPCJA
-proces biosyntezy z DNA na RNA kat. Przez nukleotydylotransferaza RNA zalezna od DNA-polimeraza RNA
-u Proc. 1 enzym syntetyzujący wszystkie frakcje RNA
-u Euc. 3 jadrowe i 2 w chloropl. i mitochond.
PROCARYOTA
polimeraza: kompleks rdzeniowy 2α,β,β', holoenzym zaw. podj δ rozpoznajaca promotor
1.Inicjacja: podjed δ rozpoznaje promotor(bliżej konca3', 40-60pz,bogate w pary AT ramka-35 i TATA box-przyłączaja się do niej białka umożliwiające przyłaczenie się polimerazy RNA), podjed. δ jest uwlania z kompleksu po przyłączeniu polimerazy do DNA 2. Elongacja- rozpoczyna się proces syntezy- tworzy się tzw Babel transkrypcyjny ( Pol. DNA, matryca DNA, rosnacy trankrypt)3. Terminacja - przez sekw na pasmie matrycowym, rozpoznawana przez czynnik Rho- powstałe RNA zawija się w strukturę spinki do wlosów i uniemożliwia dalszą syntezę RNA, RNA odczepia się przez rozerwanie wiązan A-T w miejscu rozpoznania
-dojrzewanie dot tylko rRNA i tRNA-formy prekursorowi jako gen zespolony-4frakcje poł - 16,23,5S rRNA i 2x tRNA
EUCARYOTA
-3 polimerazy RNA: I-w jąderku(28, 5,8 ,18SrRNA); II-nukleoplazma,geny kodujące bialka snRNA, III-w nukleoplazmie, tRNA, 5SRNA, snoRNA, scRNA
-region promotora: Ramka TATA-odpowiednie umiejscowienie polimerazy; elementy promotorowe powyżej TATA (UPE) od ich ilości zalezy czy promotor jest silny lub slaby
1.Inicjacja: Kompleks transkrypcyjny wielopodjed,, zaw. czynniki podst., koaktywatory oraz aktywatory-represory łączące się z wzmacniaczami lub wyciskaczami (enhancer/silancer) regulując szybkość transkrypcji; wymaga czynnikow podstawowych TF tworząc kompleks inicjujący transkrypcje-reszta tak jak u Procaryota.
-miejsca promotorowe dla polimeraz RNA I i II wyst po stronie 5'poczatku transkrypcji, promotory Pol.RNAIII SA wew genow ulegajacych transkrypcji i SA określane jako promotory wew.
TRANSLACJA
aktywacja aminokw.-2stopniowa reakcja kat. przez syntetaze aminoacylo-tRNA zaw 2 centra aktywne: rozpoznające lancuchy boczne aminokw i strukture odpowiedniego tRNA
1. aktywuje Aminokw z wykorzystaniem ATP AMP przyłączany do gr COOH, odlaczony PPi
2. przeniesienie grupy aminoacylowej z aa-AMP na tRNA
-gr aminoacylowa do nukleotydu A(w tryplecie CCA) na koncu 3'ramienia tRNA wiaze się estrowo z 3'gr-OH rybozy
1.Inicjacja: kompleks inicjujący(rybosom,mRNA,inicjatorowi-tRNA,IF lub eIF,GTP)
a)Procaryota-potrzebne 3czynniki inicjujące
1.dysocjacja rybosomu-stymulowania przez IF1 laczacy się z mala podjed. (30S)
-mala podjed. Stabilizowana przez IF3 (czynni antyasocjacyjny)
2.inicjatorowy tRNA+IF2-tzw kompleks podwojny stymuluje wiazanie tRNA z miejscem P dużej podjed
3.kompleks podwojny+mRNA a nastepnie do malej podjed. Tak ze kodon AUG znajduje się na miejscu P
4. polaczenie z duza podj i odłącznie czynnikow inicjujących,uwolnieniu IF2 hydroliza GTP
b)Eucaryota-9 czynnikow eIF, udzial biora bialka wiążące kap
-u Pro do wyznaczania miejsca startu-sekwencja bogata w puryny
2.Elongacja
-2 miejsca na dużej podjed. - miejsce P i A, do związania niezbędny GTP+EF-Tu, EF-Ts
a)EF-Tu+GTP umieszcza aatRNA w m-scu A->hydrolizaGTP->kompleks EF-Tu-GDP opuszcza (EF-Tu chroni wiazanie w aatRNA)
-(EF-Ts+EF-Tu uwalnia GDP i przylacza GTP -> gotowy EF-Tu)
b)gdy fMet-tRNA w P a aatRNA w A->powstaje wiaznie peptydowe kat przez peptydylotransferaze (skl podj 50S) lancuch polipeptydowy jest przerzucany na gr NH2 wprowadzonego aatRNA
c)translacja-wymaga czynnika elongacyjnego EF-G oraz GTP
d)terminacja- sygnal terminacji-kodony terminacyjne
-z kodonem laczy się czynnik uwalniający RF (u Proc sa 3) oraz GTP w miejscu A (RF blokuje wiazenie nowego aatRNA,powoduje hydrolize peptydylo-tRNA
Wyszukiwarka