Wpływ wspólnego jonu na dysocjację słabego elektrolitu. Roztwory buforowe.
Wpływ wspólnego jonu na dysocjację elektrolitu
Dysocjacja elektrolityczna - proces odwracalny w układzie homogenicznym (ciekłym)
(za wyjątkiem elektrolitów mocnych)
a A + b B 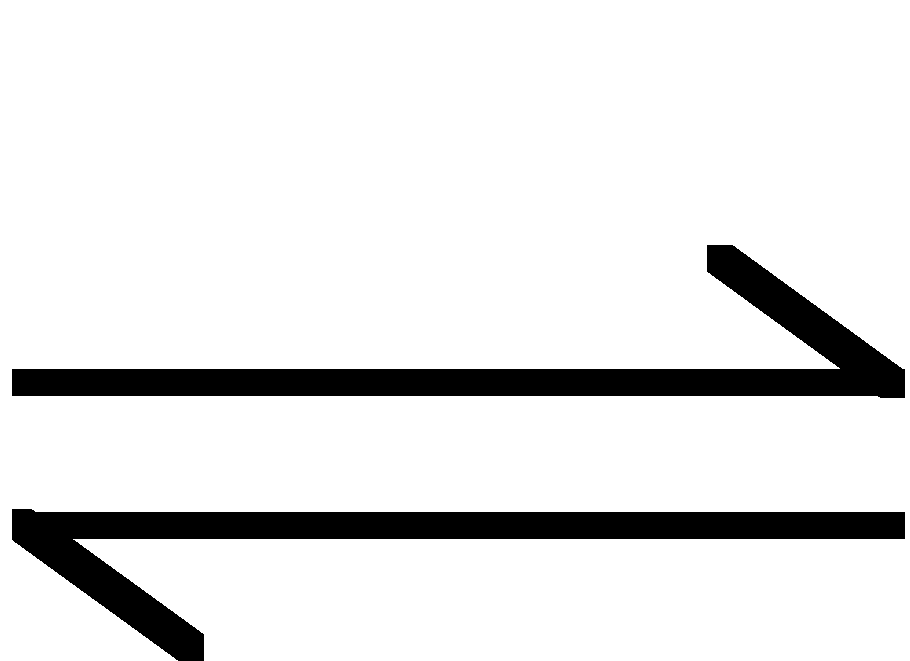
c C + d D
czyli:
- prawo działania mas:
tzn. można:
- rozważać zmiany położenia stanu równowagi wynikające ze zmiany stężenia któregokolwiek ze składników reakcji,
- wyznaczać stężenia składników układu, po wprowadzeniu do roztworów jonów wspólnych z jonami słabego elektrolitu
Cztery przypadki:
1) słaby elektrolit + mocny elektrolit o wspólnym anionie,
a) słaba zasada + mocna zasada, np.:
NH3 + NaOH
NH3 + H2O 
![]()
+ ![]()
NaOH ![]()
![]()
+ ![]()
- wspólny jon: ![]()
b) słaby kwas + sól tego kwasu (z mocną zasadą), np.:
CH3COOH + CH3COONa
CH3COOH + H2O 
![]()
+ ![]()
CH3COONa ![]()
![]()
+ ![]()
- wspólny jon: ![]()
2) słaby elektrolit + mocny elektrolit o wspólnym kationie,
a) słaby kwas + mocny kwas, np.:
HCOOH + HCl
HCOOH + H2O 
![]()
+ ![]()
HCl + H2O ![]()
![]()
+ ![]()
- wspólny jon: ![]()
b) słaba zasada + sól tej zasady (z mocnym kwasem), np.:
NH3 + NH4NO3
NH3 + H2O 
![]()
+ ![]()
NH4NO3 ![]()
![]()
+ ![]()
- wspólny jon: ![]()
3) słaby elektrolit + słaby elektrolit o wspólnym kationie,
np. mieszanina dwóch słabych kwasów:
HCOOH + CH3COOH
HCOOH + H2O 
![]()
+ ![]()
CH3COOH + H2O 
![]()
+ ![]()
- wspólny jon: ![]()
4) słaby elektrolit + słaby elektrolit o wspólnym anionie,
np. mieszanina dwóch słabych zasad:
NH3 + C2H5NH2
NH3 + H2O 
![]()
+ ![]()
C2H5NH2 + H2O 
![]()
+ ![]()
- wspólny jon: ![]()
Przypadki 1) i 2):
- stan równowagi charakteryzuje jedno wyrażenie określające stałą dysocjacji słabego elektrolitu,
- dodanie wspólnego jonu - cofnięcie dysocjacji słabego elektrolitu
Przypadki 3) i 4):
- stan równowagi charakteryzują dwa wyrażenia, określające stałe dysocjacji słabych elektrolitów,
- wypadkowe stężenie wspólnego kationu lub anionu jest równe sumie stężeń jonów pochodzących od jednego i drugiego słabego elektrolitu.
ad 1a) i 2a)
Do roztworu słabego kwasu HA (Ka), o stężeniu początkowym C1, dodano mocny kwas HA1 w takiej ilości, że jego stężenie w roztworze wynosi C2
- dysocjacja słabego kwasu:
HA + H2O 
![]()
+ ![]()
- dysocjacja mocnego kwasu:
HA1 ![]()
![]()
+ ![]()
- stała dysocjacji słabego kwasu:
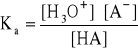
- wprowadzając następujące oznaczenia:
C1 - początkowe stężenie słabego kwasu HA
C2 - stężenie mocnego kwasu HA1
- stężenie jonów ![]()
pochodzących z dysocjacji mocnego kwasu
x - stężenie jonów ![]()
pochodzących z dysocjacji słabego kwasu
- stężenie anionów ![]()
, pochodzących z dysocjacji słabego kwasu
C1 - x - stężenie niezdysocjowanych cząsteczek słabego kwasu HA1
zatem: ![]()
ad 1b) i 2b)
Do roztworu słabego kwasu HA (Ka), o stężeniu początkowym C1, dodano roztwór jego soli (MA) w takiej ilości, że jego stężenie wynosi C2.
- dysocjacja słabego kwasu:
HA + H2O 
![]()
+ ![]()
- dysocjacja soli:
MA ![]()
![]()
+ ![]()
- stała dysocjacji słabego kwasu:
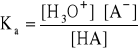
- wprowadzając następujące oznaczenia:
C1 - początkowe stężenie słabego kwasu HA
C2 - stężenie soli MA
- stężenie jonów ![]()
pochodzących z dysocjacji soli
x - stężenie jonów ![]()
pochodzących z dysocjacji słabego kwasu HA
- stężenie jonów ![]()
pochodzących z dysocjacji słabego kwasu HA
C1-x - stężenie niezdysocjowanych cząstek słabego kwasu HA
C2+x - całkowite stężenie jonów ![]()
- w roztworze słabego kwasu:
![]()
ponieważ C2 >> x to C2 + x = C2
i C1 >> x to C1 - x = C1
- zatem:
![]()
![]()
W roztworze będącym mieszaniną słabego kwasu i jego soli (z mocną zasadą) stężenie jonów oksoniowych jest wprost proporcjonalne do stosunku stężenia słabego kwasu do stężenia soli.
Analogicznie:
- w roztworze stanowiącym mieszaninę słabej zasady i jej soli (z mocnym kwasem) stężenie jonów wodorotlenowych jest wprost proporcjonalne do stosunku stężenia słabej zasady do stężenia jej soli:
np.: mieszanina NH3 - stężenie C1
i NH4Cl - stężenie C2
![]()
Przykład 1. Obliczyć zmianę stężenia jonów oksoniowych, jeżeli do 1 dm3 0,2 molowego roztworu kwasu octowego wprowadzi się 0,5 mola octanu sodu (bez zmiany objętości).
Ka = 1,8![]()
- dysocjacja kwasu octowego:
CH3COOH + H2O 
![]()
+ ![]()
Stężenie jonów [![]()
]w 0,2 molowym roztworze CH3COOH:
![]()
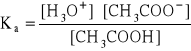
= ![]()
![]()
![]()
![]()
mol/dm3
Stężenie [![]()
] po dodaniu 0,5 mola CH3COONa:
roztwór staje się także 0,5 molowy względem CH3COONa,
- przyjmując następujące oznaczenia:
C1 - początkowe stężenie CH3COOH
C2 - stężenie octanu sodu (mocny elektrolit)
- stężenie jonów ![]()
pochodzących z dysocjacji soli
x - stężenie jonów ![]()
pochodzących z dysocjacji kwasu
- stężenie jonów ![]()
pochodzących z dysocjacji kwasu
C2+x - całkowite stężenie jonów ![]()
C1-x - stężenie niezdysocjowanych cząstek CH3COOH
- stała dysocjacji kwasu wyraża się zależnością:
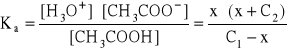
- ponieważ: C2 >> x i C1 >> x
to można uznać: C2 + x C2 i C1 - x C1
- zatem:
![]()
- skąd:
![]()
![]()
![]()
mol/dm3
Stężenie jonów oksoniowych zmalało - dodatek wspólnego jonu cofa dysocjację słabego elektrolitu.
Roztwory buforowe
Układy (roztwory):
- niwelujące zmiany pH wynikające z rozcieńczenia roztworu,
- minimalizujące zmiany pH wynikające z dodatku niewielkiej ilości mocnego kwasu lub mocnej zasady.
Zatem, cechy charakterystyczne roztworów buforowych:
- stałe stężenie jonów oksoniowych podczas rozcieńczania,
- bardzo mała zmiana stężenia jonów oksoniowych po dodaniu niewielkiej ilości mocnego kwasu lub mocnej zasady.
Znaczenie roztworów buforowych:
- procesy biochemiczne zachodzące w organizmach roślinnych i zwierzęcych,
- chemia analityczna,
- procesy technologiczne.
Roztwory buforowe:
- mieszaniny słabych kwasów i ich soli (z mocnymi zasadami) lub mieszaniny wodorosoli, np.:
HCOOH + HCOONa
CH3COOH + CH3COONa
KH2PO4 + Na2HPO4
wg teorii Brnsteda-Lowry'ego - roztwory słabych kwasów i sprzężonych z nimi zasad, np.:
HCOOH + ![]()
CH3COOH + ![]()
![]()
- mieszaniny słabych zasad i ich soli (z mocnymi kwasami), np.:
NH3H2O + NH4Cl
wg teorii Brnsteda-Lowry'ego - roztwory słabych zasad i sprzężonych z nimi kwasów, np.:
![]()
Po zmieszaniu dwu roztworów:
1. słabego kwasu HA,
2. sprzężonej z nim zasady ![]()
,
w mieszaninie ustala się stan równowagi:
HA + H2O 
![]()
+ ![]()
Stała równowagi tej reakcji jest stałą dysocjacji kwasowej:
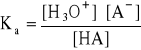
skąd:
![]()
czyli:
stężenie jonów hydroniowych zależy od stosunku stężenia kwasu do stężenia sprzężonej z nim zasady,
a wartość pH takiego roztworu:
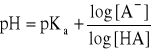
np.:
sprzężona para: kwas - zasada z nim sprzężona
CH3COOH - jony ![]()
[HA] = [CH3COOH] - stężenie kwasu octowego
stężenie początkowe kwasu octowego
[A-] = stężenie zasady sprzężonej z kwasem octowym, tzn stężenie jonów ![]()
= stężenie soli (np. octanu sodu)
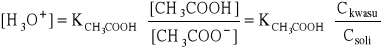
![]()
Po zmieszaniu dwu roztworów:
1. słabej zasady BOH,
2. sprzężonego z nią kwasu ![]()
,
w mieszaninie ustala się stan równowagi:
BOH + H2O 
![]()
H2O + ![]()
Stała równowagi tej reakcji jest stałą dysocjacji zasadowej:
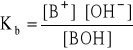
skąd:
![]()
czyli:
stężenie jonów wodorotlenowych zależy od stosunku stężenia zasady do stężenia sprzężonego z nią kwasu,
a wartość pOH takiego roztworu:
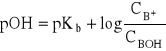
skąd:
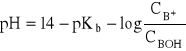
np.:
sprzężona para: zasada - sprzężony z nią kwas
![]()
- ![]()
(np. chlorek amonu)
![]()
![]()
+ ![]()
[BOH] = [NH3] - stężenie amoniaku
stężenie początkowe amoniaku
[B+] = stężenie kwasu sprzężonego z amoniakiem, tzn. stężenie jonów ![]()
= stężenie soli (np. chlorku amonu)
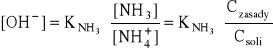
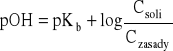
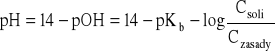
Obecnie
- roztwór zawierający amoniak i sól amonową traktuje się jak roztwór kwasu i sprzężonej z nim zasady:
![]()
NH3 + ![]()
Stała równowagi tej reakcji jest stałą dysocjacji kwasowej jonu amonowego:
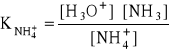
skąd:
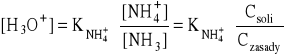
- uwzględniając:
KaKb = Kw = 10-14
czyli:
![]()
i ![]()
- otrzymuje się wyrażenie wyprowadzone poprzednio:
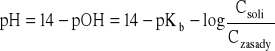
Przykład 2. Obliczyć zmianę pH w 110-4 molowym roztworze HCl po dodaniu 0,01 mola HCl (bez zmiany objętości roztworu).
- HCl - mocny elektrolit:
HCl + H2O ![]()
+ ![]()
- [H3O+] przed dodaniem kwasu:
[H3O+] = CHCl = 110-4
pH = 4
- całkowite stężenie kwasu po dodaniu 0,01 mola HCl:
![]()
= ![]()
- [H3O+] po dodaniu kwasu:
[![]()
]' = 110-2
pH = 2
Przykład 3. Obliczyć stężenie jonów oksoniowych i pH roztworu buforowego, zawierającego w objętości 0,5 dm3:
- 4,6 g kwasu mrówkowego (HCOOH) i
17,0 g mrówczanu sodu (HCOONa).
Ka = 2,510-4 pKa = 3,60
- stężenie jonów ![]()
w roztworze buforowym:
![]()
- pH roztworu buforowego:
![]()
![]()
![]()
![]()
skąd:
pH = -log [H3O+] = 4
lub:
![]()
Przykład 4. Obliczyć zmianę pH roztworu buforowego z przykładu 2., po dodaniu 0,01 mola HCl (bez zmiany objętości roztworu).
- w roztworze buforowym:
- skutkiem reakcji kwasu (jonów [![]()
]) z zasadą (jonami ![]()
) tworzy się niezdysocjowany kwas HCOOH,
- zatem całkowite stężenie kwasu [HCOOH]' wyniesie:
[HCOOH]' = 0,2 + 0,01 = 0,21 mol/dm3
- stężenie jonów [![]()
] zmniejszy się o tyle, o ile wzrośnie stężenie kwasu,
- czyli stężenie zasady (jonów ![]()
):
[![]()
]' = 0,5 - 0,01 = 0,49 mol/dm3
- zatem pH roztworu buforowego po dodaniu kwasu:
![]()
Przykład 5. Do kolby miarowej pojemności 1 dm3 wprowadzono 10,0 cm3 roztworu amoniaku o stężeniu 8,84% i gęstości 0,964 g/cm3 oraz 4,279 g stałego chlorku amonu. Zawartość kolby rozcieńczono wodą do objętości 1 dm3. Obliczyć pH otrzymanego roztworu buforowego.
Kamoniaku = 1,8·10-5
W roztworze znajdują się jony wynikające z dysocjacji:
a) chlorku amonu:
![]()
b) amoniaku:
![]()
![]()
- równowaga w tym roztworze: równowaga dysocjacji zasadowej amoniaku,
- zatem:
- pH tego roztworu (zasadowego) oblicza się wg zależności:
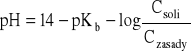
- konieczne jest jednak uprzednie obliczenie stężeń molowych soli i zasady w otrzymanym roztworze:
a) stężenie amoniaku:
masa amoniaku w roztworze wyjściowym:
![]()
stężenie molowe amoniaku w roztworze utworzonym:
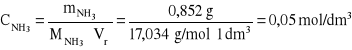
b) stężenie molowe chlorku amonu:
![]()
- pH roztworu buforowego:
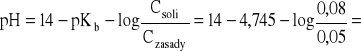
14 - 4,745 - 0,204 = 9,051
Inne podejście do obliczeń:
- równowaga w tym roztworze: równowaga dysocjacji kwasowej, przy czym kwasem są jony amonowe:
![]()
![]()
- przy obliczaniu pH korzysta się z zależności:
![]()
skąd:
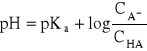
gdzie:
Ka - stała dysocjacji kwasu sprzężonego z zasadą NH3, czyli stała dysocjacji kwasowej jonów amonowych,
![]()
- stężenie zasady sprzężonej, czyli stężenie NH3,
CHA - stężenie kwasu, czyli stężenie jonów amonowych.
- znając: Kb = 1,810-5
- i wiedząc, że: KaKb = Kw
- oblicza się Ka:
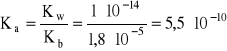
- a stąd:
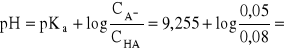
![]()
Zadania
1. W 1,0 dm3 roztworu zawarte jest 0,2 mola kwasu azotowego(III) i 0,02 mola kwasu chlorowodorowego. Obliczyć stężenie jonów azotanowych(III) w tym roztworze.
Kkwasu = 4·10-4
2. Do 0,5 dm3 0,2 molowego roztworu amoniaku dodano 0,5 dm3 0,02 molowego roztworu wodorotlenku sodu. Obliczyć stężenie jonów amonowych w powstałym roztworze.
Kamoniaku = 1,810-5
3. Zmieszano 0,5 dm3 0,02 molowego roztworu kwasu chlorowego(I) i 0,5 dm3 0,2 molowego roztworu chloranu(I) sodu. Obliczyć stężenie jonów oksoniowych w powstałym roztworze.
Kkwasu = 4,310-8
4. W 1,0 dm3 roztworu zawarte jest 0,3 mola amoniaku i 0,02 mola chlorku amonu. Obliczyć stężenie jonów wodorotlenowych w tym roztworze.
Kamoniaku = 1,810-5
5. W 0,5 dm3 roztworu zawarte jest 0,02 mola jednoprotonowego słabego kwasu (HA) i 0,2 mola soli sodowej tego kwasu (NaA). Obliczyć stężenie jonów oksoniowych w tym roztworze.
KHA = 7,210-8
6. W 0,5 dm3 roztworu zawarte jest 0,2 mola jednoprotonowej słabej zasady (BOH) i 0,02 mola chlorku tej zasady (BCl). Obliczyć stężenie jonów wodorotlenowych w tym roztworze.
KBOH = 510-4
7. Obliczyć pH 0,2 molowego roztworu kwasu octowego, do którego dodano octan sodu w takiej ilości, że stężenie soli = 0,05 mol/dm3.
Kkwasu = 1,8·10-5
8. Obliczyć stężenie jonów azotanowych(III) w:
a) 0,5 molowym roztworze kwasu azotowego(III) Kkwasu = 4·10-4
b) po dodaniu 0,2 mola HCl (bez zmiany objętości).
9. Obliczyć pH roztworu zawierającego w objętości 1 dm3: 0,1 mola amoniaku i 0,2 mola chlorku amonu.
Kamoniaku = 1,8·10-5
10. Obliczyć stężenie jonów oksoniowych w roztworze, zawierającym w objętości 0,5 dm3 0,1 mola kwasu octowego i 0,1 mola octanu potasu.
Kkwasu = 1,8·10-5
11. 21,4 g chlorku amonu rozpuszczono w 1 dm3 roztworu amoniaku o stężeniu 0,21 mol/dm3. Obliczyć pH w powstałym roztworze.
Kamoniaku = 1,8·10-5
12. Obliczyć masę octanu sodu, którą należy rozpuścić w 500 cm3 0,2 molowego roztworu kwasu octowego, aby otrzymać roztwór buforowy o pH = 5. Założyć, że rozpuszczenie soli nie spowoduje zmiany objętości roztworu.
Kkwasu = 1,8·10-5
13. Do 1 dm3 roztworu buforowego, w którym stężenie chlorku amonu = 1,2·10-3 mol/dm3, a pH = 9,7 dodano 100 cm3 1,0 molowego roztworu amoniaku. Obliczyć pH powstałego roztworu.
Kamoniaku = 1,8·10-5
14. Do kolby miarowej poj. 1 dm3 wprowadzono 100 cm3 1,0 molowego roztworu amoniaku i 100 cm3 1,0 molowego roztworu chlorku amonu, po czym całość uzupełniono wodą do objętości 1 dm3. Obliczyć pH w powstałym roztworze.
Kamoniaku = 1,8·10-5
15. Jak zmieni się pH roztworu z poprzedniego zadania, jeżeli do roztworu wprowadzi się 0,01 mola HCl (bez zmiany objętości)?
16. Obliczyć stężenie jonów oksoniowych i pH w roztworze buforowym, zawierającym w objętości 500 cm3 0,25 g kwasu mrówkowego i 0,25 g mrówczanu potasu.
Kkwasu = 1,8·10-4
17. Obliczyć wykładnik stężenia jonów oksoniowych w roztworze buforowym powstałym ze zmieszania 2 objętości 1,00% roztworu amoniaku i 8 objętości 1,00% roztworu bromku amonu. Gęstość wszystkich roztworów przyjąć = 1,0 g/cm3.
Kamoniaku = 1,8·10-5
18. Do 200 cm3 0,2 molowego roztworu kwasu octowego dodano 180 cm3 0,2 molowego roztworu wodorotlenku sodu. Obliczyć pH w otrzymanym roztworze.
Kkwasu = 1,8·10-5
19. Który roztwór wykazuje większą kwasowość:
a) 0,01 molowy HClO
b) mieszanina zawierająca w objętości 1 dm3: 0,01 mola HClO i 0,01 mola KClO
Kkwasu = 4,3·10-7.
20. Należy przygotować roztwór buforowy złożony z kwasu octowego i octanu sodu, o pH = 4. Sumaryczne stężenie molowe obu składników winno być równe 0,2 mol/dm3. Obliczyć stężenie każdego składnika.
Kkwasu = 1,8·10-5
21. Obliczyć zmianę pH:
a) 0,01 molowego roztworu HCl,
b) 0,01 molowego roztworu HCOOH,
c) roztworu buforowego będącego mieszaniną 0,01 molowego HCOOH i 0,01 molowego HCCOK
po dziesięciokrotnym rozcieńczeniu.
Kkwasu = 1,8·10-4
22. Obliczyć, w jakim stosunku objętościowym należy zmieszać 0,05 molowy roztwór kwasu mlekowego i 0,5 molowy roztwór mleczanu potasu, aby po uzupełnieniu wodą do objętości 500 cm3 otrzymać roztwór buforowy o pH = 4,5.
Kkwasu = 2,5·10-4
23. Obliczyć stężenie jonów oksoniowych i wykładnik stężenia jonów oksoniowych w roztworze buforowym składającym się z mieszaniny 0,1 mola diwodoroortofosforanu(V) sodu i 0,1 mola wodoroortofosforanu(V) sodu w jednym decymetrze sześciennym roztworu. Wartość stałej dysocjacji drugiego etapu kwasu ortofosforowego(V) K2 = 6,2·10-8.
Rozwiązania
1. [![]()
] = 2,7·10-4
2. [![]()
] = 2·10-4
3. [![]()
] = 4,3·10-9
4. [![]()
] = 2,7·10-4
5. [![]()
] = 7,2·10-9
6. [![]()
] = 5·10-5
7. pH = 4,14
8. a) [![]()
] = 1,4·10-2 b) [![]()
] = 1·10-3
9. pH = 8,95
10. [![]()
] = 1,8·10-5
11. pH = 8,98
12. moctanu sodu = 14,76 g
13. pH = 9,71
14. pH = 9,26
15. pH = 9,18
16. pH = 3,49
17. pH = 9,41
18. pH = 5,7
19. a) pH = 4,19; b) pH = 6,37; większa kwasowość - roztwór a
20. Ckwasu = 0,17 mol/dm3; Csoli = 0,03 mol/dm3
21. a) ΔpH = 1; b) ΔpH = 0,49; c) ΔpH = 0
22. Vkwasu : Vsoli = 6 : 5
23. [H3O+] = 6,2·10-8; pH = 7,21
Mantysy dwucyfrowe logarytmów dziesiętnych
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
1 2 3 4 5 6 7 8 9 |
00 30 48 60 70 78 85 90 95 |
04 32 49 61 71 79 85 91 96 |
08 34 51 62 72 79 86 91 96 |
11 36 52 63 72 80 86 92 97 |
15 38 53 64 73 81 87 92 97 |
18 40 54 65 74 81 88 93 98 |
20 41 56 66 75 82 88 93 98 |
23 43 57 67 76 83 89 94 99 |
26 45 58 68 76 83 89 94 99 |
28 46 59 69 77 84 90 95 996 |
10
11
Wyszukiwarka