OTRZYMYWANIE ALKANÓW.
1. Katalityczna redukcja alkenów.
![]()
2-metylobut-2-en 2-metylobutan (70%)
2. Redukcja aldehydów i ketonów amalgamatem cynku (Clemmensen)

heptan-4-on heptan (74%)
3. Redukcja aldehydów i ketonów hydrazyną (Wolff-Kiżner).
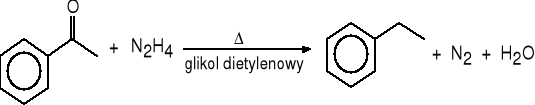
acetofenon etylobenzen (63%)
4. Hydroliza halogenków alkilomagnezowych (Cerewitinow).
![]()
1-bromoheksan bromek heksylomagnezu(A)
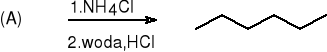
heksan (33%)
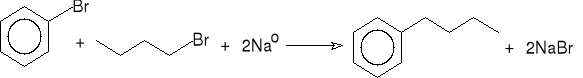
5. Reakcja sprzęgania związków metaloorganicznych (Wurtz).
![]()
1-bromobutan oktan (52%)
bromobenzen butylobenzen (46%)
6. Reakcja utleniania anodowego soli kwasów karboksylowych (Kolbe).
Anoda:
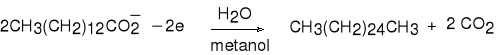
tetradekanian (sodu) heksakozan (65%)
Katoda: 2Na+ +2e + CO2 + H2O = Na2CO3 + H2
7. Aklilowanie arenów (Friedel-Crafts).
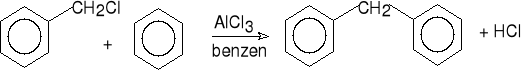
chlorek benzylu difenylometan (50%)
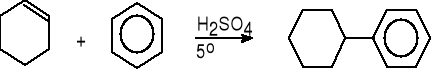
cykloheksen benzen cykloheksylobenzen (68%)
OTRZYMYWANIE ALKENÓW I ALKADIENÓW.
1. Odszczepienie wody od alkoholu.
![]()
alkohol t-butylowy izobuten (2-metylopropen)
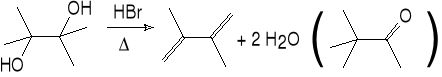
pinakol 2,3-dimetylobuta-1,3-dien (57%) pinakolon
2. Odszczepienie halogenowodoru.
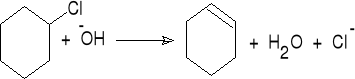
chlorocykloheksan cykloheksen
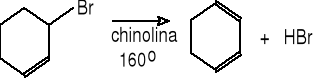
3-bromocykloheksen cykloheksa-1,3-dien (68%)
3. Piroliza wodorotlenków czteroalkiloamoniowych (Hofmann).
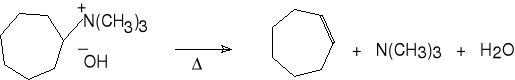
wodorotlenek trimetylo- cyklohepten (87%)
cykloheptyloamoniowy
4. Piroliza estrów.
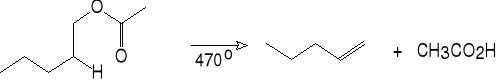
octan pentylu pent-1-en
5. Piroliza ksantogenianów metylowych (Czugajew).
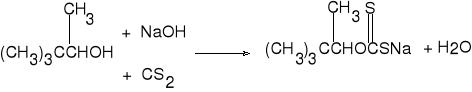
3,3-dimetylobutan-2-ol ksantogenian O-(1,2,2-trimetylopropylu)-sodu (A)
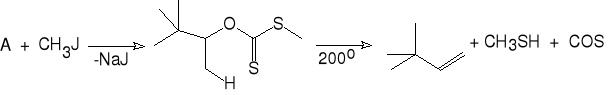
ksantogenian O-(1,2,2-trimetylopropylu)-S-metylu 3,3-dimetylobut-1-en
6. Piroliza tlenków amin (Cope).
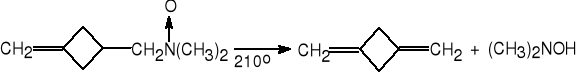
tlenek aminy
7. Reakcja 1,2-dihalogenków z metalami.
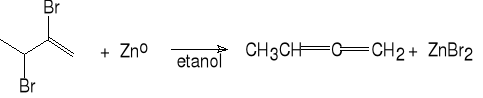
2,3-dibromobut-1-en buta-1,2-dien
8. Reakcja 1,2-dihalogenków z jonem jodkowym.
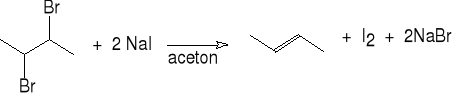
2,3-dibromobutan but-2-en
9.Redukcja alkinów.
9.a. Katalityczna redukcja alkinów.
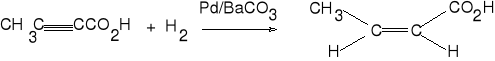
kwas but-2-ynowy kwas (Z)- but-2-enowy (72%)
9.b. Hydroborowanie alkinów.
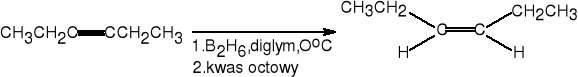
heks-3-yn (Z)- heks-3-en (68%)
9.c. Redukcja alkinów metalami.
![]()
nona-2,7-diyn (2E,7E)- nona-2,7-dien (79%)
10. Reakcje sprzęgania związków metaloorganicznych (Wurtz).
![]()
1-bromobutan bromek butylomagnezu
![]()
hept-1-en (71%)
11. Reakcja alkilidenofosforanów ze związkami karbonylowymi (Wittig).
![]()
trifenylofosfina bromek trifenylometylofosfoniowy (99%)
![]()
trifenylometylideno-5-fosfan
(trifenylometylidenofosforan)
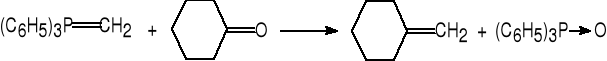
cykloheksanon metylidenocykloheksan
OTRZYMYWANIE ALKINÓW.
1. Odszczepienie chlorowcowodorów od 1,2-dihalogenków.

kwas undec-10-enowy kwas 10,11-dibromoundekanowy
![]()
kwas undec-10-ynowy (32%)
2. Alkilowanie -alkinów.
![]()
acetylen amidek sodu acetylenek sodu
![]()
1-bromobutan heks-1-yn (68%)
3. Oksydatywne sprzęganie -alkinów (Glaser).
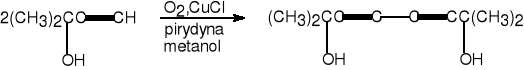
2-metylobut-3-yn-2-ol 2,7-dimetylookta-3,5-diyn-2,7-diol (70%)
4. Niesymetryczne sprzęganie -alkinów (Cadiot-Chodkiewicz).
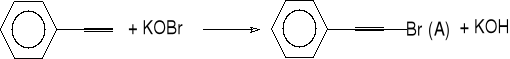
etynylobenzen (bromoetynylo)benzen
fenyloacetylen 1-bromo-2-fenyloacetylen (89%)

6-fenylo-2-metyloheksa-3,5-diyn-2-ol (73%)
OTRZYMYWANIE HALOGENKÓW ALKILOWYCH.
1. Otrzymywanie z alkoholi i halogenowodorów.
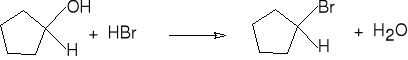
cyklopentanol bromek cyklopentylu (74%)
![]()
butan-1-ol chlorek butylu (69%)
2. Otrzymywanie z alkoholi i halogenków fosforu.
![]()
propan-1-ol bromek propylu (90%)
![]()
izobutanol bromek izobutylu (91%)
3. Otrzymywanie z alkoholi i chlorku tionylu.
![]()
dodekan-1-ol chlorek dodecylu (68%)
![]()
butano-1,4-diol 1,4-dichlorobutan chlorowodorek pirydyny
chlorek pirydyniowy
4. Reakcja podstawienia halogenku alkilowego innym halogenkiem.
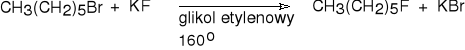
bromek heksylu fluorek heksylu(42%)
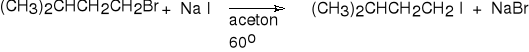
1-bromo-3-metylobutan 1-jodo-3-metylobutan (66%)
5. Halogenowanie weglowodorów w pozycji allilowej (benzylowej).
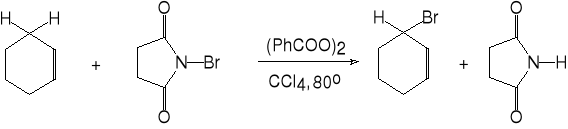
cykloheksen N-bromosukcynoimid 3-bromocykloheksen(45%) sukcynoimid
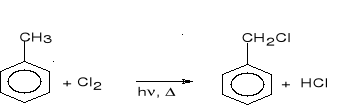
toluen chlorek benzylu (93%)
6. Przyłączanie halogenowodorów lub halogenków do alkenów.
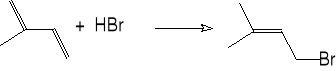
2-metylobuta-1,3-dien 1-bromo-3-metylobut-2-en (78%)
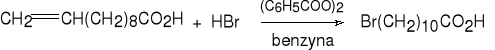
kwas undec-10-enowy kwas 11-bromoundekanowy (70%)
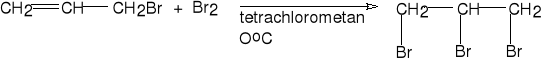
bromek allilu 1,2,3-tribromopropan (95%)
7. Z soli srebrowych kwasów karboksylowych i halogenków.
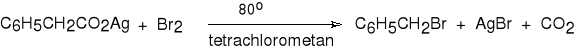
fenylooctan srebra bromek benzylu
OTRZYMYWANIE ALKOHOLI
1. Przyłączanie wody do alkenów.
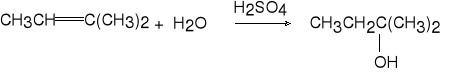
2-metylobut-2-en alkohol t-amylowy (74%)
2. Hydroborowanie - utlenianie alkenów.
3 NaBH4 + BF3 = 3 NaF + B2H6
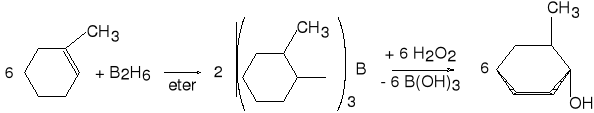
1-metylocykloheksen tri(2-metylocykloheksylo)boran trans-2-metylocykloheksanol (90%)
3. Reakcja związków metaloorganicznych ze związkami karbonylowymi.
3.a. Alkohole I rz. z aldehydów.
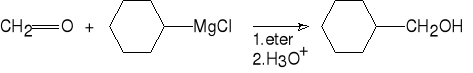
metanal chlorek cykloheksylomagnezu cykloheksylometanol(69%)
3.b. Alkohole II rz. z aldehydów.
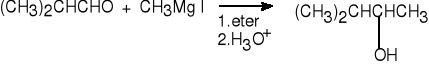
2-metylopropanal jodek metylomagnezu 3-metylobutan-2-ol (56%)
3.c. Alkohole III rz. z ketonów.
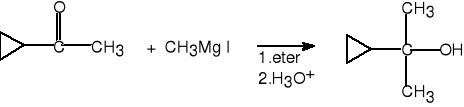
1-cyklopropyloetanon 2-cyklopropylopropan-2-ol (68%)
3.d. Alkohole III rz. z estrów, chlorków kwasowych i bezwodników.
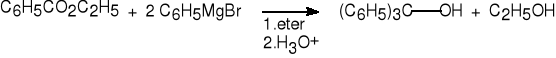
benzoesan etylu bromek fenylomagnezu trifenylometanol (93%)
4. Reakcje odczynników Grignarda z eterami cyklicznymi.
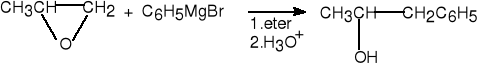
tlenek propylenu 1-fenylopropan-2-ol (60%)
5. Utlenianie odczynników Grignarda.
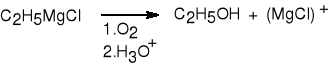
chlorek etylomagnezu etanol
6. Redukcja związków karbonylowych i kwasów za pomocą wodorków metali.
6.a. Alkohole I rz. z aldehydów, kwasów, chlorków kwasowych i estrów.
![]()
hydrat chloralu 2,2,2-trichloroetanol (65%)
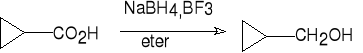
kwas cyklopropanokarboksylowy cyklopropylometanol (77%)
6.b. Alkohole II rz. z ketonów.
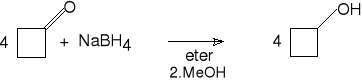
cyklobutanon cyklobutanol (90%)
7. Redukcja eterów cyklicznych za pomocą wodorków metali.
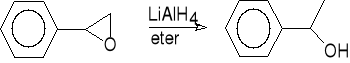
fenylooksiran 1-fenyloetanol
8. Redukcja związków karbonylowych metalami.
8.a. w środowisku kwaśnym.
![]()
heptanal heptan-1-ol (78%)
heptan-2-on heptan-2-ol (65%)
8.b. w środowisku zasadowym.
![]()
heptan-2-on heptan-2-ol
9. Katalityczne uwodornienie związków karbonylowych.
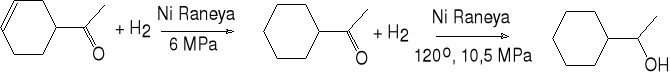
3-cykloheksenyloetanon 1-cykloheksyloetanol(96%)
10. Redukcja aldehydów i ketonów (Meerwein - Ponndorf - Oppenauer - Verley).
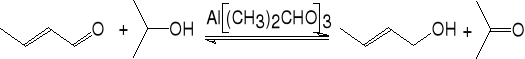
but-2-enal propan-2-ol but-2-en-1-ol aceton
11. Otrzymywanie glikoli-1,2 z alkenów.
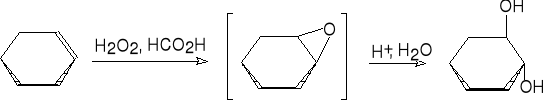
trans-cykloheksano-1,2-diol (69%)-
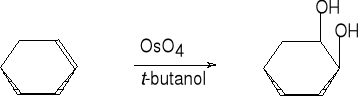
cis-cykloheksano-1,2-diol (45%)
12. Hydroliza halogenków alkilowych i allilowych.
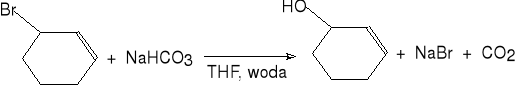
cykloheks-2-enol (96%)
13. Hydroliza estrów.
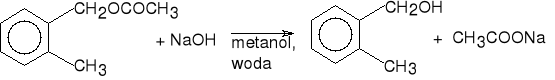
alkohol 2-metylobenzylowy (95%)
14. Rozszczepienie eterów.
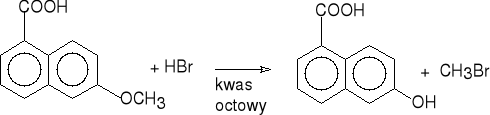
kwas 6-hydroksy-1-naftoesowy (90%)
OTRZYMYWANIE ETERÓW.
1. Reakcje alkoksylanów ze związkami alkilowymi (Williamson).
![]()
eter butylowo-metylowy (70%)
2. Odszczepienie wody od alkoholi.
![]()
eter t-butylowo-etylowy
(95%)
3. Metylowanie alkoholi za pomocą diazometanu.
![]()
eter metylowo-oktylowy (87%)
OTRZYMYWANIE ALDEHYDÓW I KETONÓW.
1. Utlenianie alkenów ozonem.
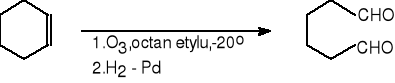
cykloheksen heksanodial (61%)

2. Utlenianie glikoli połączone z rozpadem cząsteczki.
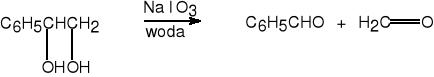
aldehyd benzoesowy
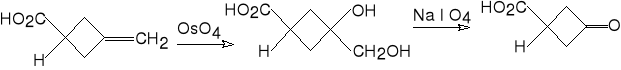
kwas 3-metylidenocyklo- kwas 3-oksocyklobutano-
butanokarboksylowy karboksylowy
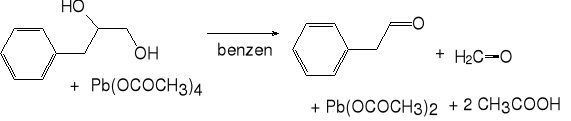
3-fenylopropano-1,2-diol aldehyd fenylooctowy
3. Utlenianie alkoholi I rz.
3.a. za pomocą kwasu chromowego
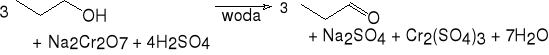
propan-1-ol aldehyd propionowy (36%)
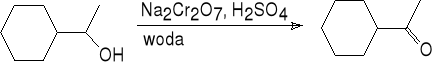
1-cykloheksylo-1-etanol cykloheksylometyloketon
3.b. innymi związkami karkonylowymi z alkoksylanami glinu (Oppenauer).
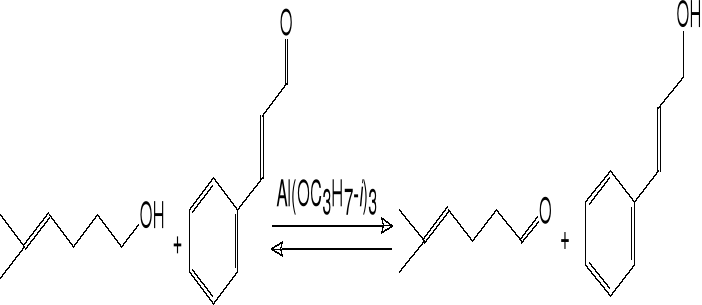
5-metyloheks-4-en-1-ol aldehyd cynamonowy 5-metylo-4-heks-4-enal alkohol cynamonowy
(nadmiar)
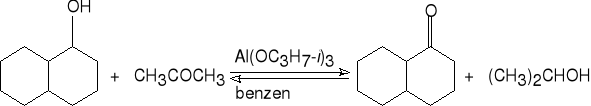
bicyklo[4.4.0]dekan-1-ol aceton (nadmiar) bicyklo[4.4.0]dekan-1-on propan-2-ol
4. Odwodornienie alkoholi Irz.
![]()
heksan-1-ol heksanal (22%)
5. Redukcja chlorków kwasowych (Rosemund).
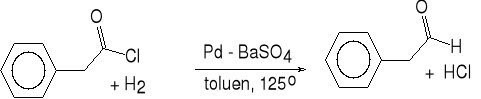
chlorek fenyloacetylu aldehyd fenylooctowy
6. Redukcja za pomocą glinowodorku litowego.
6.a. z nitrylów.
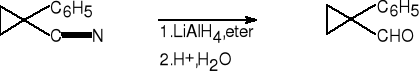
1-fenylocyklopropanokarbonitryl 1-fenylocyklopropanokarboaldehyd
6.b. z amidów
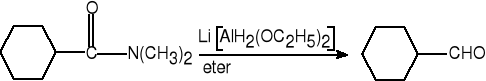
N,N-dimetylocykloheksanokarboksyamid cykloheksanokarboaldehyd
6.c. z chlorków kwasowych
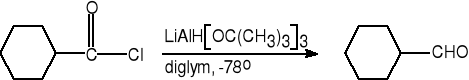
chlorek kwasu cyklo-
heksanokarboksylowego
7. Przyłączanie odczynnika Grignarda do ortomrówczanu etylu.
![]()
bromek pentylomagnezu
![]()
dietylowy acetal heksanalu
![]()
heksanal
8. Przyłączanie związków metaloorganicznych do dimetyloformamidu.
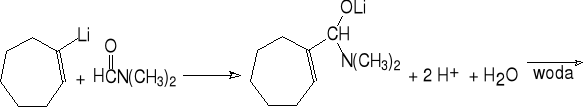
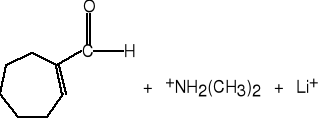
9. Przyłączanie wody do alkinów.
![]()
acetylen alkohol winylowy aldehyd octowy
![]()
kwas undec-10-ynowy kwas 10-oksoundekanowy (50%)
10. Utlenianie pierwszorzedowych halogenków lub estrów kwasu p-tolueno-
sulfonowego.
![]()
1-jodoheptan (A)
![]()
heptanal
11. Rozpad -ketonoestrów.
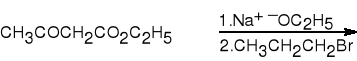
acetylooctan etylu
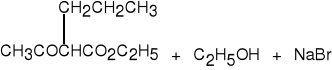
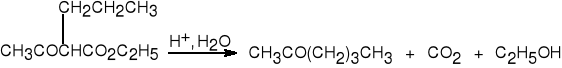
pochodna heksan-2-on (67%)
acetylooctanu etylu
![]()
malonian dietylu
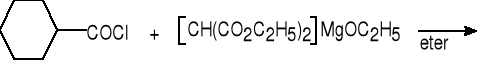
chlorek
cykloheksanokarbonylu
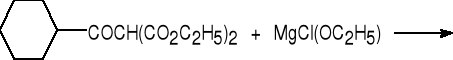
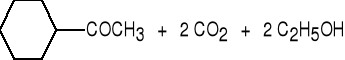
keton cykloheksylowo-metylowy (70%)
12. Przyłączanie związków metaloorganicznych do wiązań wielokrotnych.
12.a. do nitrylów.
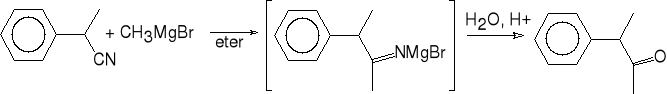
2-fenylopropionitryl 3-fenylobutan-2-on
12.b. do chlorków kwasowych.
![]()
chlorek benzoilu keton t-butylowo-fenylowy
13.Przegrupowanie glikoli-1,2 (pinakolinowe).
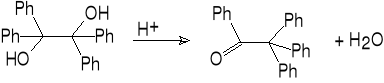
tetrafenyloetano-1,2-diol keton fenylowo-trifenylometylowy
14. Przegrupowanie wodoronadtlenków.
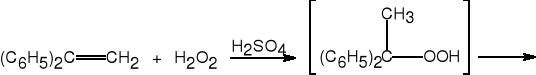
1,1-difenyloeten
![]()
acetofenon fenol
15. Termiczna dekarboksylacja kwasów karboksylowych.
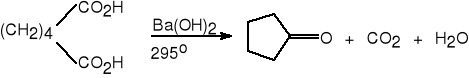
kwas adypinowy cyklopentanon
![]()
![]()
pentan-2-on(43%)
16. Reakcja formylowania pierścienia aromatycznego.
16.a. formylowanie tlenkiem węgla i chlorowodorem ( Gattermann - Koch ).
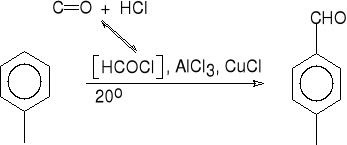
toluen aldehyd p-toluilowy (46%)
16.b. formylowanie cyjanowodorem ( Gattermann ).
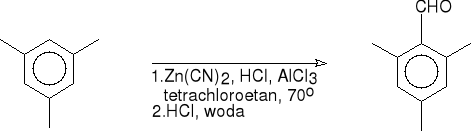
mezytylen 2,4,6-trimetylobenzenokarboaldehyd (80%)
16.c. formylowanie dichlorokarbenem ( Reimer-Tiemann )
![]()
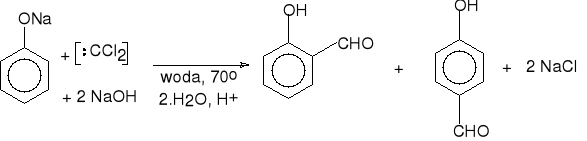
fenol aldehyd salicylowy(37%) p-hydroksybenzaldehyd (9%)
16.d.formylowanie dimetyloformamidem ( Vilsmeier ).
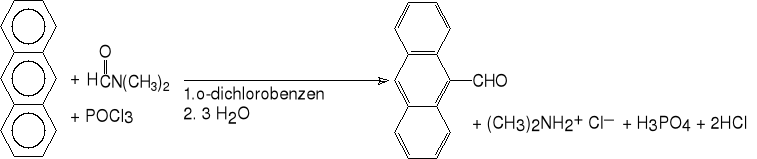
antracen antraceno-9-karboaldehyd (58%)
16.e. Formylowanie eterem dichlorometylowym ( Rieche ).
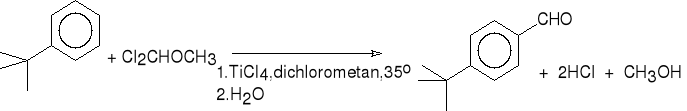
tert-butylobenzen p-tert-butylobenzaldehyd (67%)
17. Reakcja acylowania pierścienia aromatycznego ( Friedel-Crafts ).
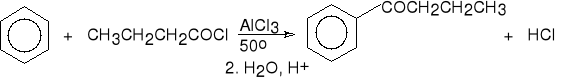
benzen chlorek butyrylu butyrofenon (51%)
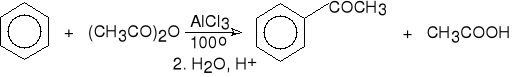
bezwodnik acetofenon (83%)
octowy
OTRZYMYWANIE KWASÓW KARBOKSYLOWYCH.
Hydroliza nitryli.
![]()
fenyloacetonitryl kwas fenylooctowy (78%)
![]()
pentanonitryl
![]()
kwas pentanowy (81%)
2. Reakcja związków metaloorganicznych z CO2.
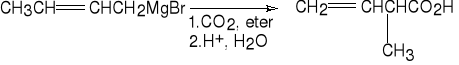
bromek but-2-enylomagnezu kwas 2-metylobut-3-enowy (75%)
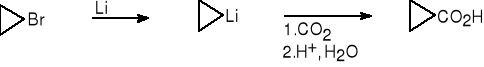
bromek związek kwas cyklopropano-
cyklopropylu litoorganiczny karboksylowy
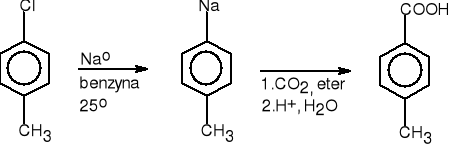
4-chlorotoluen p-metylofenylosód kwas p-toluilowy (72%)
3. Synteza z estru malonowego.
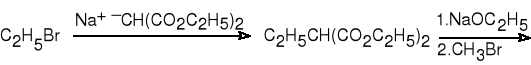
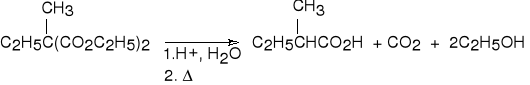
kwas 2-metylobutanowy (84%)
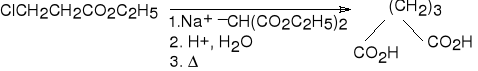
3-chloropropanian etylu kwas glutarowy (80%)
(kwas pentanodiowy)
![]()
![]()
![]()
kwas glutarowy (60%)
4. Utlenianie alkoholi I rz., II rz. i aldehydów.
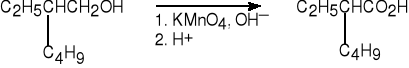
2-etylo-1-heksanol kwas 2-etyloheksanowy (74%)
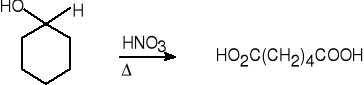
cykloheksanol kwas adypinowy (55%)
(kwas heksanodiowy)
![]()
2-metylopent-2-enal kwas 2-metylpent-2-enowy (60%)
5. Utlenianie alkenów.
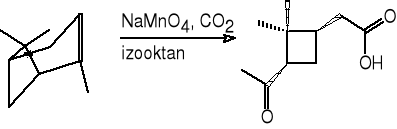
α-pinen kwas pinowy
6. Utlenianie metyloketonów ( reakcja haloformowa ).
![]()
keton t-butylowo-metylowy kwas trimetylooctowy (74%) bromoform
![]()
tlenek mezytylu kwas 3-metylobut-2-enowy (51%)
7. Reakcja aldehydów z zasadą ( Cannizzaro ).
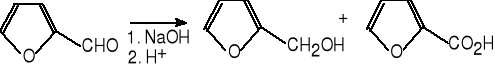
furfural alkoholfurfurylowy kwas furano-2-karboksylowy (63%)
8. Utlenianie ketonów nadkwasami ( Baeyer - Villiger ).
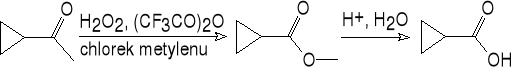
cyklopropyloetanon kwas cyklopropanokarboksylowy (53%)
9. Utlenianie zwiazków aromatycznych.
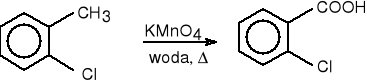
o-chlorotoluen kwas o-chlorobenzoesowy (68%)
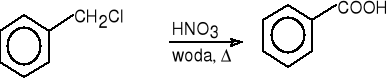
chlorek benzylu kwas benzoesowy (84%)
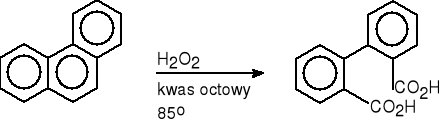
fenantren kwas difenowy (69%)
10. Karboksylowanie pierścienia aromatycznego ( Kolbe ).
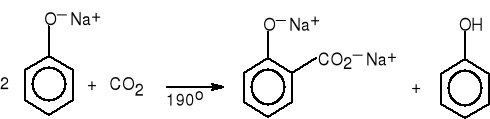
fenolan sodu salicylan disodu fenol
(27%)
OTRZYMYWANIE ESTRÓW, HALOGENKÓW, BEZWODNIKÓW, AMIDÓW I NITRYLI.
ESTRY.
1. Z kwasów karboksylowych i alkoholi I rz.
![]()
octan etylu (90%)
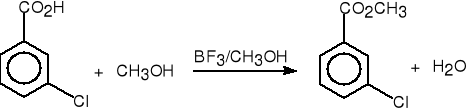
kwas 3-chloro- 3-chlorobenzoesan
benzoesowy metylu (91%)
![]()
wodoroadypinian metylu (34%)
2.Z chlorków kwasowych i alkoholi (fenoli).
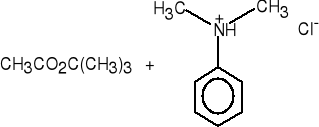
octan t-butylu (62%)
![]()
![]()
winylooctan etylu (75%)
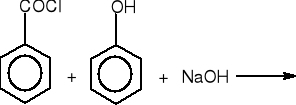
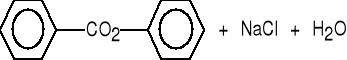
benzoesan fenylu (76%)
3.Z bezwodników i alkoholi.
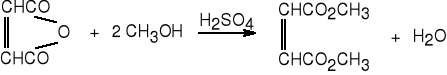
bezwodnik maleinian
maleinowy dimetylu
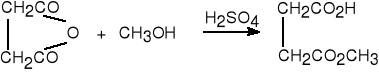
wodorobursztynian
metylu
4. Reakcja transestryfikacji.
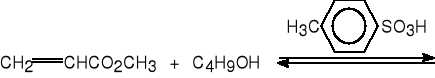
akrylan metylu
![]()
akrylan butylu (94%)
5.Z soli kwasów karboksylowych, chlorku tionylu i alkoholi.
![]()
chlorek chlorosulfinian
tionylu butylu
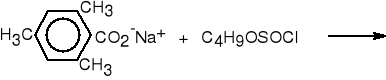
2,4,6-trimetylobenzoesan sodu
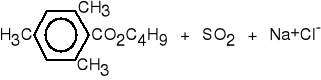
2,4,6-trimetylobenzoesan butylu
6. Z soli kwasów karboksylowych i halogenków alkilowych.
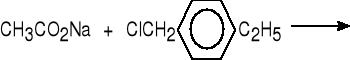
chlorek 4-etylobenzylu
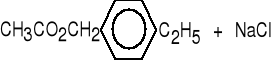
octan 4-etylobenzylu
7. Alkoholiza nitrylów.
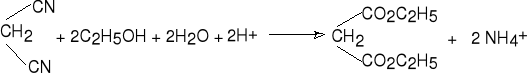
malononitryl malonian dietylu (62%)
8. Reakcja kwasów karboksylowych z diazometanem.
![]()
cyklopropylooctan metylu (79%)
HALOGENKI KWASOWE.
1. Z chlorku tionylu i kwasów karboksylowych.
![]()
kwas masłowy chlorek butyrylu (86%)
2. Z halogenków fosforu i kwasów karboksylowych.
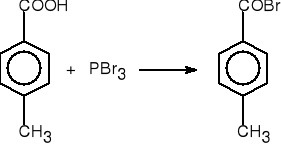
bromek 4-metylobenzoilu (65%)
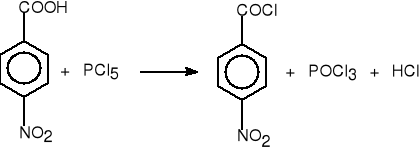
chlorek 4-nitrobenzoilu (95%)
3. Z chlorku tionylu i bezwodników.
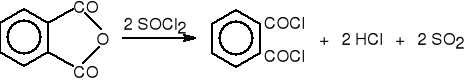
bezwodnik ftalowy chlorek ftaloilu
4. Otrzymywanie fluorków, bromków i jodków kwasowych z chlorków kwasowych.
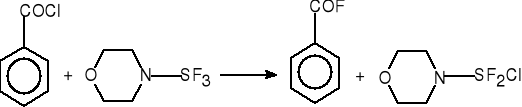
fluorek benzoilu (70%)
5. Z chlorku oksalilu.
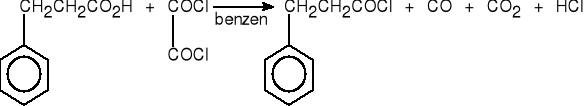
kwas 3-fenylo- chlorek chlorek 3-fenylo-
propanowy oksalilu propanoilu (98%)
BEZWODNIKI.
1. Z bezwodnilka octowego i kwasu dikarboksylowego.
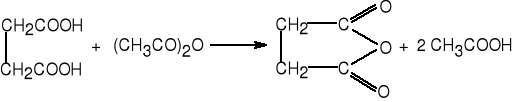
bezwodnik bursztynowy (90%)
2. Z halogenków kwasowych i kwasów karboksylowych.
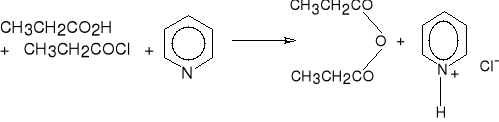
bezwodnik chlorek
propionowy pirydyniowy
3. Z halogenków kwasowych i soli kwasów karboksylowych.
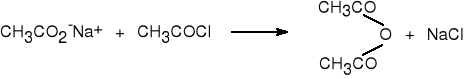
bezwodnik octowy (77%)
4. Z ketenu i kwasów karboksylowych.
![]()
keten
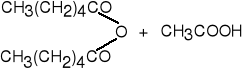
bezwodnik heksanowy(84%)
AMIDY.
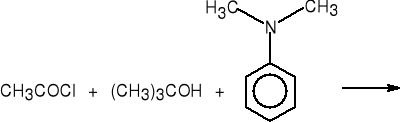
1. Z chlorków acylowych i amoniaku lub amin.
![]()
chlorek heksanoilu heksanoamid (63%)
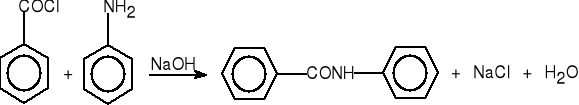
chlorek benzoilu benzanilid (75%)
2. Z kwasów karboksylowych i amoniaku (mocznika) lub amin.
![]()
mocznik acetamid (90%)
3. Z estrów lub bezwodników i amoniaku lub amin.
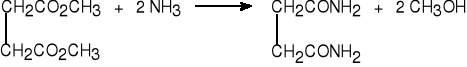
butanodiamid (88%)
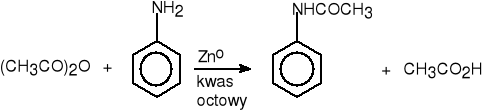
acetanilid (70%)
4. Hydroliza nitrylów.
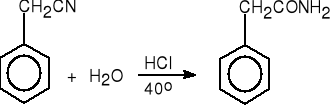
cyjanek benzylu fenyloacetamid (82%)
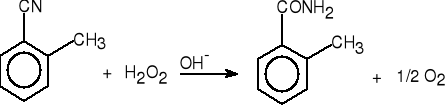
2-metylobenzonitryl 2-metylobenzamid (90%)
5. Przyłączanie nitrylów do alkenów (Ritter).
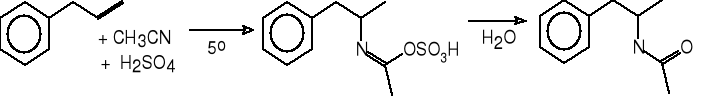
allilobenzen acetonitryl N-[(1-etylo-2-fenylo)etylo]acetamid
NITRYLE.
1. Z halogenków alkilowych i cyjanków.
![]()
1,3-dibromopropan pentanodinitryl (82%)
![]()
1-chlorobutan pentanonitryl (82%)
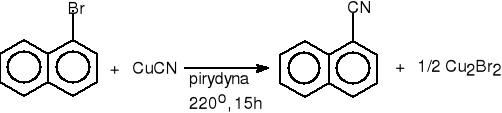
1-bromonaftalen 1-naftonitryl (84%)
2. Z amidów lub aldoksymów w reakcji odwodnienia.
![]()
heksanoamid heksanonitryl (86%)
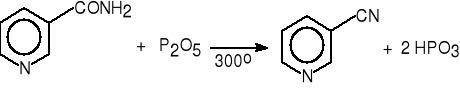
nikotynoamid pirydyno-3-karbonitryl (3-cyjanopirydyna) (86%)
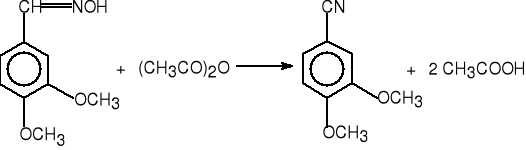
weratroaldoksym weratronitryl (74%)
3. Reakcja cyjanoetylowania.
![]()
akrylonitryl 3-etoksypropionitryl (65%)
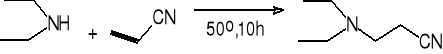
akrylonitryl 3-(dietyloamino)propionitryl (86%)
METODY SYNTEZY AMIN.
1.Redukcja związków z azotem.
a. związki nitrowe
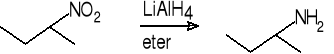
2-nitrobutan butano-2-amina
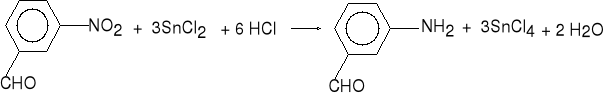
3-nitrobenzaldehyd 3-aminobenzaldehyd
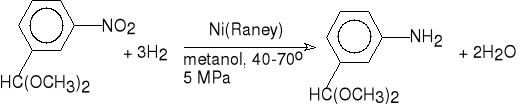
dimetylowy acetal dimetylowy acetal
3-nitrobenzaldehydu 3-aminobenzaldehydu (78%)
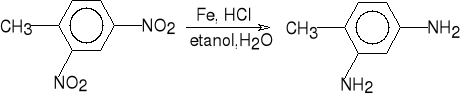
2,4-dinitrotoluen 4-metylobenzeno-1,2-diamina (2,4-diaminotoluen)
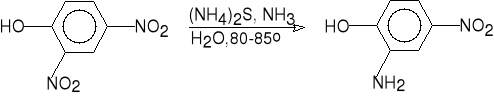
2,4-dinitrofenol 2-amino-4-nitrofenol (89%)
b. nitryle

cyjanek benzylu 2-fenyloetyloamina (90%)
![]()
butyronitryl butyloamina (57%)
c. amidy
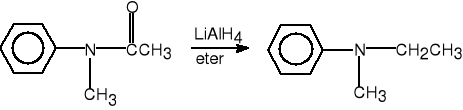
N-metyloacetanilid N-etylo-N-metyloanilina (91%)
d. oksymy
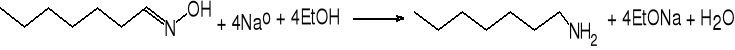
oksym heptanalu heptyloamina (70%)
![]()
oksym benzofenonu benzhydryloamina (60%)
2. Hydroliza ftalimidów (Gabriel).
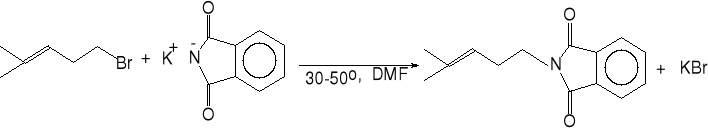
bromek 4-metylopent-3-enylu (A)
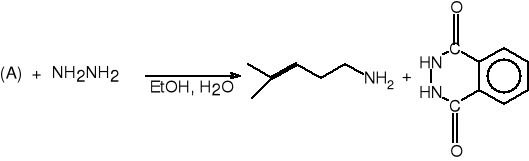
4-metylopent-3-enyloamina (60%)
3.Alkilowanie amoniaku i amin.
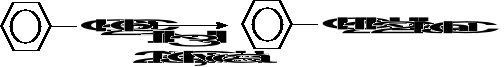
chlorek benzylu benzyloamina (53%)
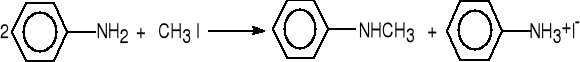
anilina N-metyloanilina (90%)
4.Aminowanie halogenków arylowych.
a.zaktywowane halogenki arylowe.
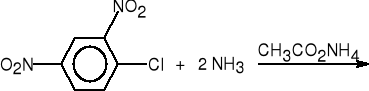
1-chloro-2,4-dinitrobenzen
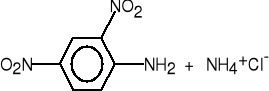
2,4-dinitroanilina (76%)
b.niezaktywowane halogenki arylowe.
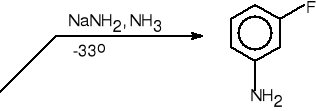
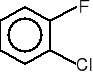
3-fluoroanilina (83%)
1-chloro-2-fluorobenzen
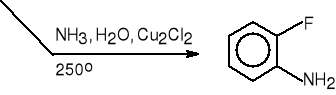
2-fluoroanilina (100%)
5.Przegrupowanie benzydynowe hydrazoarenów.
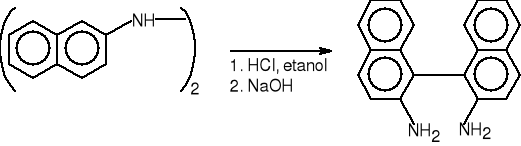
2,2'-hydrazonaftalen 2,2'-diamino-1,1'-dinaftyl(92%)
6. Przegrupowanie oksymów (Beckmann).
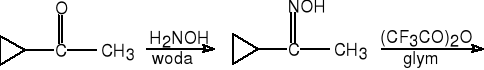
keton cyklopropylowo-metylowy (E)-oksym
ketonu cyklopropylowo-metylowego
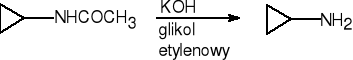
cyklopropyloamina (77%)
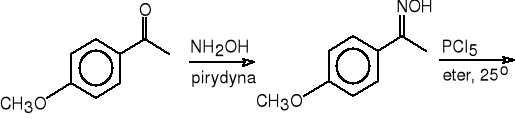
p-metoksyacetofenon (E)-oksym p-metoksyacetofenonu
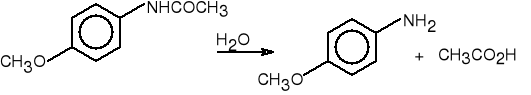
p-anizydyna (85%)
7. Degradacja amidów (Hofmann).
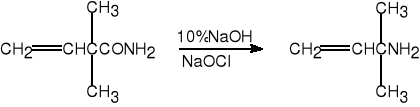
2,2-dimetylobut-3-enoamid 1,1-dimetyloalliloamina
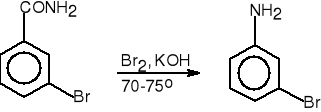
3-bromobenzamid 3-bromoanilina (87%)
8. Degradacja azydków acylowych (Curtis).
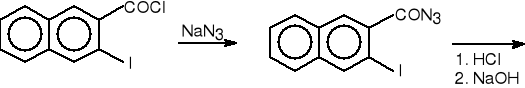
chlorek 3-jodo-2-naftoilu azydek
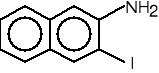
3-jodo-2-naftyloamina (85%)
![]()
chlorek azydek izocyjanian chlorek
acetylu acetylu metylu metyloamoniowy (65%)
9. Degradacja azydków acylowych (Schmidt).

kwas fenylooctowy kwas benzyloamina (92%)
azotowodorowy
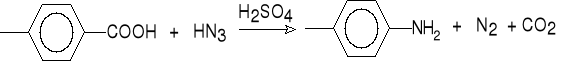
kwas 4-toluilowy 4-toluidyna (70%)
Rozpuszczalniki:
DMF N,N-dimetyloformamid
DMSO sulfotlenek dimetylu
EtOH etanol
THF tetrahydrofuran, oksolan
glym 1,2-dimetoksyetan
diglym 1,1'-oksybis[2-metoksyetan], eter bis(2-metoksyetylowy)
30
Wyszukiwarka