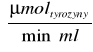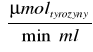LABORATORIUM Z BIOTECHNOLOGII
Ćwiczenie nr. 4
Biosynteza proteinaz bakteryjnych w fermentorach
Biotechnologia grupa V
Piątek 815-12oo
Data oddania sprawozdania 03.04.2009r
Paweł Mróz
Karolina Kominiak
Sylwia Szymczak
Łukasz Pietrakiewicz
Wstęp teoretyczny.
Drobnoustroje, które stosowane są do produkcji enzymów mogą być hodowane dwoma metodami:
powierzchniową- na pożywkach stałych lub płynnych w cienkiej warstwie
wgłębną w dużych zamkniętych fermentorach przy intensywnym napowietrzaniu i mieszaniu.
Produkcję dzieli się na 2 etapy:
proces biosyntezy enzymu
proces jego wyodrębniania.
Biosyntezę prowadzi się przeważnie w oparciu o wgłębną, okresową hodowlę bakterii w klasycznych fermentorach w ciekłych pożywkach o ściśle określonym składzie i przy zastosowaniu specyficznych dla każdego szczepu warunków fizycznych i chemicznych. Skład pożywki dobiera się indywidualnie dla każdego gatunku, musi uwzględniać mechanizmy regulacji biosyntezy (represję) oraz być ekonomiczny.
Proteinazy - stanowią grupę enzymów proteolitycznych, która katalizuje hydrolizę wiązań peptydowych oraz estrowych. Proteinazy są nierozerwalnie związane z całym życiem białek. Przetwarzanie białek przez proteinazy powoduje w rezultacie włączenie lub wyłączenie ich aktywności biologicznej. Najlepiej scharakteryzowaną grupą enzymów stanowią proteinazy serynowe. Powodem tego może być ich rola biologiczna oraz fakt, że stanowią one najliczniejszą grupę enzymów proteolitycznych występującą w przyrodzie. Oprócz pożytecznej funkcji proteolizy istnieją również związane z nią niebezpieczeństwa. W związku z powyższym, procesy te muszą być ściśle kontrolowane w określonym czasie i miejscu, tak, aby były pożądane i skuteczne. Jednym z mechanizmów kontroli proteolitycznej jest działanie inhibitorów proteinaz, obecnych we wszystkich znanych organizmach oraz w różnych tkankach tych organizmów.
Subtilizyny - alkaliczne proteinazy pozakomórkowe wytwarzane przez bakterie Bacillus
subtilis.
Bioreaktor (fermentor) - jest to urządzenie umożliwiające prowadzenie procesów mikrobiologicznych, enzymatycznych jak również hodowle komórek organizmów wielokomórkowych, skonstruowane w sposób umożliwiający, poprzez pomiar i regulację parametrów, kontrolę procesu produkcyjnego i jego optymalny przebieg, w warunkach maksymalnego ograniczenia lub całkowitego wyeliminowania możliwości zakażeń
W warunkach laboratoryjnych stosuje się bioreaktory o różnych pojemności roboczej.
Popularne są bioreaktory do hodowli wgłębnych, które zapewniają optymalne warunki mieszania i napowietrzania. Możemy w nim wyróżnić dwa typy mieszania: mikro mieszanie i makro mieszanie. Ważnym parametrem związanym z mieszaniem jest szybkość obrotu mieszadła. Mieszanie musi zapewniać dobre warunki wymiany gazowej. Jeżeli są te warunki spełnione, pozostałe parametry mieszania jak rozkład stężenia substratów, produktów oraz dyfuzja w podłożu nie stanowią czynników ograniczających szybkość procesu biologicznego lub zakłócających ich przebieg.
Poważnym problemem podczas hodowli drobnoustrojów jest tworzenie się piany. Piana jest heterogenicznym układem pęcherzyków gazu rozproszonych w malej ilości cieczy. Powstawanie i utrzymywanie się piany uzależnione są od składu i właściwości fizykochemicznych środowiska oraz od intensywności mieszania dwóch faz: gazowej i ciekłej. Substancje pianotwórcze wprowadzane są do środowiska fermentacyjnego w składzie surowców kompleksowych używanych do przygotowania podłoży. W czasie fermentacji skład chemiczny podłoża i jego właściwości fizykochemiczne ulegają zmianie, co w istotny sposób wpływa na pienienie się środowiska. Degradacja i asymilacja składników podłoża, zmiana pH, obniżenie się lepkości i wzrost napięcia powierzchniowego dają w efekcie redukcję pienistości, która po osiągnięciu trwającego krócej lub dłużej minimum, zazwyczaj ponownie wzrasta w końcowej fazie procesu. Przyczyną tego mogą być zarówno ulegające stopniowo rozkładowi składniki podłoża, wydzielane pozakomórkowo produkty metabolizmu użytego drobnoustroju, jak i degradacja składników biomasy zachodząca podczas autolizy komórek. Powstawanie piany i konieczność stosowania środków zapobiegających temu bywa przyczyną szeregu poważnych kłopotów natury technicznej, biologicznej i ekonomicznej:
wzrost heterogeniczności środowiska
utrudnienie lub wręcz uniemożliwienie kontroli stężenia składników podłoża oraz objętości hodowli
zagrożenie wypienienia hodowli z bioreaktora oraz możliwość jego zainfekowania obcą mikroflorą
obniżenie pojemności użytkowej bioreaktora o 30 — 50%,
konieczność stosowania odpowiedniego oprzyrządowania przeciwdziałającego pienieniu się hodowli
przechodzenie śladowych ilości substancji przeciwpianowych do produktów,
pogorszenie się warunków natlenienia środowiska na skutek wprowadzenia środków przeciwpianowych,
niekorzystny ich wpływu na morfologię i fizjologię drobnoustrojów.
Efektywność odpieniania zależy od właściwości fizykochemicznych, zarówno
środka przeciwpianowego, jak i substancji pianotwórczych oraz od wzajemnego stosunku ilościowego w układzie. Wprowadzenie środka odpieniającego do hodowli powoduje okresowe pogarszanie się rozpuszczalności tlenu, warunków jego transportu z fazy gazowej do podłoża oraz blokowanie powierzchni komórek drobnoustrojów. Dobór środka przeciwpianowego uzależniony jest od składu podłoża, użytego drobnoustroju i produkowanego metabolitu. Jest on dokonywany doświadczalnie, metodą prób. Oprócz chemicznych mamy również szereg rozwiązań pozwalających na mechaniczne niszczenie piany.
Przykładowy bioreaktor
Hodowla w fermentorze
Przed rozpoczęciem pracy należy wysterylizować fermentor i wszystkie elementy potrzebne nam do pracy, sterylizacja przebiega w temperaturze 121oC, pod ciśnieniem 1 atm przez określony czas. Po ochłodzeniu do temperatury hodowli, pH pożywki koryguje się do wskazanej wartości i wprowadzamy inokulum (10-20% objętości fermentora)-luzujemy króciec wlotowy, opalamy zwojem waty nasyconej spirytusem i otwieramy, opalamy szyjkę kolby z inokulum nad palnikiem, wlewamy inokulum do fermentora i natychmiast zamykamy króciec wlotowy (do dużych fermentorów produkcyjnych otrzymanie koniecznej ilości inokulum wymaga kilkuetapowego namnażania: probówka kolbamały fermentor (15dm3)duży fermentor(3m3)główny fermentor produkcyjny ).
Fermentory wyposażone są w układ zapobiegający nadmiernemu powstawaniu piany
odpieniacze chemiczne - zmniejszają napięcie powierzchniowe cieczy; działają one na powierzchni cieczy, rozpuszczając się w niej. Tak wiec ich działanie nie jest długie
odpieniacze mechaniczne (zbijacz mechaniczny)- w postaci dwóch stożków, które mają na swoim obwodzie płytki, piana jest zbijana, tworzy się ciecz, która zrasza pianę i ta jest zbijana. Przeważnie są montowane w górnej części fermentora.
W fermentorach są czujniki, które informują o wysokim poziomie piany i zostaje uruchomiony wtedy mechaniczny odpieniacz. Jeśli on nie pomoże to zostaje uruchomiony chemiczny odpieniacz.
Fermentor po określonym czasie hodowli opróżnia się ,ciecz pohodowlaną poddaje określonej obróbce, fermentor czyści się i proces zaczyna się od nowa.
Cel ćwiczenia
Badanie dynamiki biosyntezy proteinaz przez szczep Bacillus subtilis oraz poznanie ogólnych zasad prowadzenia hodowli drobnoustrojów w fermentorach.
Materiały i metody
W ćwiczeniu stosowaliśmy szczep Bacillus subtilis. Szczep przechowywany jest na podłożu stałym w temperaturze 4oC. Materiał posiewowy do zaszczepienia inokulum stanowi biomasa bakteryjna uaktywniona w 24-godzinnej hodowli statystycznej w temperaturze 370C. Inokulum otrzymuje się prze 21-24-godzinną hodowle wstrząsaną bakterii na pod…łożu N w kolbach kulistych, płaskodennych o poj. 500 ml zawierających 100 ml pożywki w temperaturze 30oC.
Oznaczanie zmętnienia
Pomiar zmętnienia umożliwia monitorowanie wzrostu w fermentorze.
Wykonanie ćwiczenia:
Do wykonania oznaczenia posiadaliśmy 6 probówek, z których każda była pobrana po określonym czasie hodowli wgłębnej ( 24h, 36h, 48h, 54h, 62h, 72h). Wszystkie próby rozcieńczyliśmy 20-krotnie. Pobieraliśmy 0,5 ml cieczy i dodaliśmy 9,5 ml wody destylowanej i mierzyliśmy absorbancję na „spekolu” przy długości fali 660 nm; próbą kontrolną była woda.
Na podstawie otrzymanych wyników wyznaczonej absorbancji obliczyliśmy zmętnienie dla poszczególnych próbek ze wzoru.
OD660=A660×R
R - rozcieńczenie próby
A660 - absorbancja
OD660 - gęstość optyczna (zmętnienie)
Tabela 1.Wyniki przedstawione są w tabeli poniżej (wyniki te dotyczą jedynie mojej grupy).
Próby pobrane po określonych godz. hodowli |
Przyrost biomasy A660 |
Rozcieńczenie R |
Zmętnienie OD660 |
24h |
0,087 |
x 20 |
1,74 |
36h |
0,425 |
x 20 |
8,5 |
48h |
0,470 |
x 20 |
9,4 |
Oznaczanie aktywności proteinaz metodą Ansona
Do oznaczenia korzystaliśmy z tych samych prób, pobranych po określonym czasie hodowli wgłębnej ( 24h, 36h, 48h, 54h, 62h, 72h). Na każdą próbę robiliśmy jedna próbę badaną i jedną kontrolną.
Próba właściwa:
Do probówki wprowadziliśmy 1ml substratu- hemoglobiny, której pH wynosiło 10,2 i 0,2 ml enzymu( jest to ciecz hodowlana po rozcieńczeniu 20-krotnym) i pozostawiliśmy na 10min (aby zaszła reakcja enzymatyczna) Po tym czasie dodaliśmy 2 ml kwasu trójchlorooctowego (TCA, który zatrzymuje reakcje i powoduje denaturacje białka). Następnie mieszaninę dokładnie wymieszaliśmy i odstawiliśmy na 30 min w temperaturze pokojowej. Po upływie tego czasu każda próba została przesączona
Próba kontrolna:
Do probówki wprowadziliśmy 1 ml hemoglobiny o pH=10,2 i 2 ml kwasu trójchlorooctowego (TCA). Próbkę dokładnie wymieszaliśmy i pozostawiliśmy na 3 min w temperaturze pokojowej. Po tym czasie dodaliśmy 0,2 ml enzymu, całość została dokładnie wymieszana i odstawiona na 30 min a następnie przesączona.
Otrzymane filtraty (próby właściwej i kontrolnej) użyliśmy do reakcji z odczynnikiem Folina.
Próba właściwa:
Do 1ml filtratu dodaliśmy 2ml NaOH i dokładnie wymieszaliśmy a następnie 0,6ml odczynnika Folina i ponownie wymieszaliśmy i odstawiliśmy na 10 min. Ostatnią czynnością było zmierzenie absorbancji na „spekolu” każdej z prób właściwych wobec odpowiadającej jej próbie kontrolnej przy długości fali 690nm.
Próba kontrolna:
Analogicznie jak próba właściwa.
Na podstawie otrzymanych wyników absorbancji obliczyliśmy aktywność proteinaz A10,2 dla każdej z prób ze wzoru:
A10,2=K×ΔE690×R
gdzie:
A - jest to taka ilość enzymu która w standardowych warunkach uwalnia z tyrozyny w ciągu 1 minuty taką ilość produktów rozpuszczalnych w TCA. 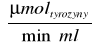
R- rozcieńczenie
K- współczynnik, który pozwala na przeliczenie absorbancji na µmoltyrozyny/(min×ml) =0,75
E690 - różnica ekstynkcji próby właściwej i kontrolnej
Moja grupa zajmowała się hodowlą 24h, 36h, 48h. Oto jedno z przykładowych obliczeń
24h hodowla
E690=0,090
R=20
K=0,75
A10,2= 0,75× 0,090× 20 = 1,35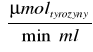
Tabela 2.Wyniki przedstawione są w tabeli poniżej (wyniki te dotyczą jedynie mojej grupy).
Próby pobrane po określonych godz. hodowli |
Absorbancja E690 |
Współczynnik K |
Rozcieńczenie R |
Aktywność A10,2
|
24h |
0,090 |
0,75 |
x 20 |
1,35 |
36h |
0,120 |
0,75 |
x 20 |
1,80 |
48h |
0,190 |
0,75 |
x 20 |
2,85 |
Tabela 3.Wyniki całej grupy zamieszczam w tabeli poniżej.
Próby pobrane po określonych godz. hodowli |
Absorbancja A660 |
R |
Biomasa OD660= A660×R
|
Absorbancja E690 |
R |
Aktywność A10,2
|
||
24h |
0,080 0,087 |
Średnia 0,0835 |
20 |
1,67 odrzucam |
0,090 0,075 0,145 |
Średnia 0,103
|
20 |
2,06 |
|
0,120 0,106 |
Średnia 0,113 |
|
2,26 |
|
|
|
|
36h |
0,420 0,425 |
Średnia 0,4225 |
20 |
8,45 |
0,120
|
Średnia 0,120
|
20 |
2,4 |
|
0,510 0,490 |
Średnia 0,500 |
|
10 odrzucam |
|
|
|
|
48h |
0,500 0,470 |
Średnia 0,485 |
20 |
9,7 |
0,130 0,132 0,175 |
Średnia 0,145
|
20 |
2,9 |
|
0,650 0,590 |
Średnia 0,620 |
|
12,4 odrzucam |
|
|
|
|
54h |
0,480 0,480 |
Średnia 0,480 |
20 |
9,6 |
0,160 0,160 0,140 |
Średnia 0,153
|
20 |
3,06 |
|
0,580 0,590 |
Średnia 0,585 |
|
11,7 odrzucam |
|
|
|
|
62h |
0,450 0,600 |
Średnia 0,525 |
20 |
10,5 |
0,150 0,220
|
Średnia 0,240
|
20 |
3,7 |
|
0,580 0,670 |
Średnia 0,625 |
|
12,5 odrzucam |
|
|
|
|
72h |
0,430 0,650 |
Średnia 0,540 |
20 |
10,8 odrzucam |
0,190 0,210 0,150 |
Średnia 0,183
|
20 |
3,66 |
|
0,590 0,610 |
Średnia 0,600 |
|
12 |
|
|
|
|
OD660 - Zmętnienie
A10,2 - Aktywność proteolityczna
W kolumnie pt Absorbancja E690 znajduje się różna ilość wyników, wynika to z tego ze były duże rozbieżności i część z nich odrzuciłem. Wyniki pogrubione posłużą mi do sporządzenia wykresów
Wykres 1. Zależność zmętnienia (OD660) i aktywności proteolitycznej (A10,2) od czasu hodowli (t)
4. Wnioski
W naszym doświadczeniu możemy zaobserwować wzrost zmętnienia. Oznaczenie zmętnienia dało nam możliwość określenia wzrostu biomasy. Największy jej przyrost przypada na hodowle w przedziale 24h - 36h.
Hemoglobina użyta w oznaczeniu aktywności metodą Ansona była już zneutralizowana mocznikiem, ponieważ taka hemoglobina jest bardziej podatna na degradacje proteolityczną. Hemoglobina odczepia produkty rozpuszczalne w kawasie trójchlorooctowym, w których zawartość tyrozyny oznacza się fenolowym odczynnikiem Folina-Ciocalteu. Kwas trójchlorooctowy denaturuje hemoglobinę (jak można było zauważyć podczas doświadczenia) W próbie kontrolnej od razu do hemoglobiny dodajemy kwasu trójchlorooctowego, żeby całkowicie zdenaturować ją przed dodaniem enzymu.
Z naszego doświadczenia wynika, że największy przyrost aktywności proteinazy jest w godzinach od 54 do 62, natomiast w pozostałych godzinach jest bardzo podobny i dość niski. Uważam ze wynik ten nie jest do końca prawidłowy, ponieważ uważam ze największy przyrost aktywności proteolitycznej powinien przypadać na hodowle nieco młodsze.
9
Wyszukiwarka