dla jednego mola gazu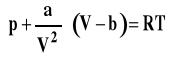
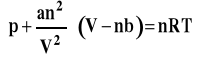
dla n moli gazu
Równanie stanu gazu doskonałego Równanie Clapeyrona pV=nRT R=8,314 J/mol*K
Równanie Van der Waalsa, znaczenie stałych a i b
dla jednego mola gazu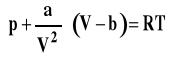
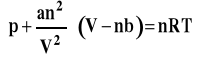
dla n moli gazu
gdzie : a, b - stałe charakterystyczne dla danego gazu, niezależne od temperatury
a - stała związana z oddziaływaniami międzycząst (przyciąganiem) b - stała związana z obj własną cząsteczek
Co to jest energia wewnętrzna układu
jest to suma wszystkich rodzajów energii zawartych w układzie (energii kinetycznej ruchu postępowego i rotacyjnego cząsteczek, energii kinetycznej i potencjalnej oscylacji cząsteczek, energii oddziaływań międzycząsteczkowych, energii oddziaływań cząsteczek z zewnętrznymi polami), za wyjątkiem energii kinetycznej i potencjalnej układu jako całości. Oznaczamy ją symbolem U, jest funkcją stanu, czyli jej zmiana nie zależy od drogi procesu, a tylko stanu końcowego i początkowego
Omówić I zasadę termodynamiki Pierwsza zasada termodynamiki jest szczególną formą ogólniejszej, znanej doskonale z fizyki, zasady zachowania energii
Dla układu izolowanego Energia wewnętrzna jest stała. U=const dU=0 Dla układu zamkniętego Układ zamknięty może wymieniać energię z otoczeniem na sposób ciepła lub pracy. Wobec tego zmiana energii wewnętrznej układu zamkniętego jest sumą ciepła i pracy wymienionych przez ten układ z otoczeniem ΔU=q+w dU=dq+dw
Układ izolowany nie może wymieniać en. z otoczeniem to jego en. wewnętrzna nie może ulegać zmianie. Druga część (dla ukł. zamkniętego) określa o ile zmienia się energia wewnętrzna układu, gdy w toku jakiegoś procesu wymienia on energię z otoczeniem na sposób ciepła lub pracy. Czyli pierwsza zasada termodynamiki jest bilansem zmian energii w układzie.
Prawo Hessa Ciepło reakcji chemicznej prowadzonej w układzie zamkniętym w stałej temperaturze i pod stałym ciśnieniem lub w stałej objętości nie zależy od drogi reakcji, a jedynie od stanu początkowego i końcowego (substratów i produktów).
Prawo Hessa pozwala na obliczanie efektów cieplnych reakcji w oparciu o ciepła innych reakcji
Standardowa entalpia tworzenia zw. chemicznego to zmiana entalpii towarzysząca utworzeniu 1 mola związku z czystych, rozdzielonych pierwiastków w warunkach standardowych, przy czym powstający związek jak i pierwiastki muszą być w najtrwalszej w tych warunkach odmianie termodynamicznej. Standardowa entalpia tworzenia pierwiastków w ich najtrwalszej odmianie termodynamicznej wynosi zero
Obliczyć standardową entalpię reakcji na podstawie standardowych entalpii tworzenia związków
ΔrH°=suma ΔtwH°prod - sumaΔtwH°subs
Dla pewnej reakcji ΔrCp wynosi -20 J/mol*K. Entalpia tej reakcji gdy temperatura rośnie będzie: malała Prawo Kirchoffa można zapisać wzorem w postaci różniczkowej. 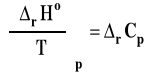
Znak pierwszej pochodnej określa, czy funkcja jest malejąca czy rosnąca. Wobec tego wpływ temperatury na entalpię reakcji zależy od znaku zmiany pojemności cieplnej po prawej stronie wzoru Kirchoffa. Jeśli rCp < 0 to, gdy temperatura rośnie to entalpia reakcji maleje. Natomiast jeśli rCp > 0, to wraz ze wzrostem temperatury entalpia reakcji też rośnie.
Podać przynajmniej dwa różne sformułowania 2 zasady termodynamiki
Sformułowanie Kelvina - Nie można zbudować takiej maszyny cieplnej, działającej w sposób cykliczny, która pobierałaby ciepło ze zbiornika i całkowicie zamieniała je na pracę.
Sformułowanie Clausiusa - Niemożliwy jest samorzutny przepływ ciepła z ciała o temperaturze niższej do ciała o temperaturze wyższej.
Jeszcze inne sformułowanie - W określonym procesie, jeśli może on być wykonany w sposób odwracalny, wówczas praca wykonana ma wartość maksymalną
Reguła faz Gibbsa i definicja wielkości w niej występujących z=s-f-2 Reguła faz Gibbsa określa związek liczby stopni swobody z liczbą składników niezależnych i liczbą faz w układzie. Aby się nią móc prawidłowo posługiwać, należy umieć prawidłowo określić liczbę składników niezależnych w układzie i liczbę faz w nim. S= Składniki niezależne to te indywidua chemiczne (składniki) obecne w układzie, których stężenia trzeba znać, aby w sposób jednoznaczny móc określić stężenia wszystkich składników we wszystkich fazach układu. f=Faza jest część układu jednorodna pod względem fizycznym i chemicznym, oddzielona od reszty układu fizyczną powierzchnią rozdziału; o takim stosunku powierzchni do masy, że można zaniedbać fluktuacje składu i gęstości oraz zjawiska powierzchniowe. z=Stopnie swobody to te parametry intensywne opisujące układ, które można zmieniać niezależnie od siebie (w pewnych granicach) bez zakłócenia równowagi termodynamicznej układu czyli bez zmiany liczby i rodzaju faz w układzie.
Wytłumaczyć dlaczego temperatura topnienia wody maleje gdy ciśnienie rośnie
Rozpatrujemy teraz przemianę, w której zachodzi przejście od fazy stałej do ciekłej. ciało stałe → ciecz
Wzór Clapeyrona możemy dla topnienia zapisać jako : 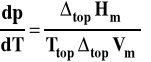
Lód ma mniejszą gęstość niż woda, czyli równocześnie posiada większą objętość molową
Wobec tego dla wody różnica objętości molowych cieczy i ciała stałego jest ujemna. Vm(c)<Vm(s) ΔtopVm= Vm(c)-Vm(s)<0
Prawa strona wzoru Clapeyrona maznak minus, co oznacza, że pochodna ciśnienia po temperaturze jest ujemna.
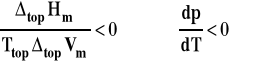
Oznacza to, że ciśnienie pod którym zachodzi topnienie lodu jest malejącą funkcją temperatury czyli, że gdy temperatura rośnie, to maleje ciśnienie równowagowe przemiany. I na odwrót : temperatura topnienia lodu maleje, gdy rośnie ciśnienie.
Narys i omówić wykresy fazowe dla ukł azeotrop ujemnego
Układy azeotropowe ujemne wykazują ujemne odchylenia od prawa Raoulta, posiadają minimum na krzywej zależności prężności pary od składu cieczy. Na linii zależności temperatury wrzenia od składu cieczy pod stałym ciśnieniem mają maksimum. W ekstremum zwanym punktem azeotropowym skład cieczy i pary jest taki sam. Dlatego też roztworu tworzącego układ azeotropowy nie można rozdzielić na składniki przez destylację. W wyniku destylacji otrzymamy zawsze jeden ze składników i roztwór o składzie odpowiadającym punktowi azeotropowemu. Azeotropy ujemne tworzą ciecze, dla których entalpia mieszania jest ujemna mixH < 0, proces mieszania jest egzotermiczny. Przykładem mogą być układy woda - HNO3 , woda - HCl. Na rysunku 12 przedstawiono wykresy fazowe dla układu azeotropowego ujemnego. A-punkt azeotropowy
Mamy 0,1 mol/kg wodny roztwór glukozy i 0,1 mol/kg wodny roztwór NaCl. Czy dowolna wielkość koligatywna będzie: jednakowa dla obu roztworów, ponieważ właściwości koligatywne zależą tylko od stężenia substancji a nie są zależne od rodzaju substancji rozpuszczonej
Reguła przekory. Wyjaśnić w oparciu o regułę przekory jaki będzie wpływ temperatury na stan równowagi poniższej reakcji 3H2(g) + N2(g) 2NH3(g) egzotermiczna
Gdy układ znajdujący się w stanie równowagi zostanie poddany działaniu czynnika zaburzającego równowagę (bodźca), reaguje w taki sposób, aby zminimalizować zaburzenie.
Podana reakcja jest egzotermiczna, czyli wydziela się w jej toku ciepło, gdy zachodzi ona tak jak jest zapisana (z lewa na prawo). Reakcja odwrotna będzie wobec tego endotermiczna czyli w jej toku będzie pochłaniane ciepło. Jeśli będziemy podwyższać temperaturę w tym układzie (dostarczać do niego ciepło), to układ będzie starał się to ciepło pochłonąć i równowaga reakcji będzie się przesuwać w lewo (w stronę substratów), gdyż w tym kierunku reakcja jest endotermiczna. I odwrotnie, obniżanie temperatury, będzie prowadziło do przesunięcia stanu równowagi na prawo. Aby przedyskutować wpływ ciśnienia, musimy ocenić, co ma większą objętość - substraty czy produkty. W tej reakcji mamy trzy mole gazowych substratów, a tylko dwa mole gazowych produktów. W toku reakcji zmniejsza się więc objętość układu reakcyjnego. Wobec tego wzrost ciśnienia, będzie powodował przesunięcie stanu równowagi na prawo, gdyż sprężamy układ. Zmniejszanie ciśnienia będzie przesuwało stan równowagi w lewo, bo to zwiększa objętość układu.
gdy reakcja jest egzotermiczna (rHo < 0), to na wykresie uzyskamy prostą o nachyleniu dodatnim, a gdy reakcja jest endotermiczna (rHo > 0), to nachylenie prostej będzie ujemne
Obliczyć średnie stężenie jonowe dla roztworu AgCl3 o stężeniu 0.005 mol/kg
![]()
=4√(11*22) * 0.005 = 0,00707
Obliczyć siłę jonową roztworu MgSO4 o stężeniu 0,002mol/kg ![]()
I=1/2 (22*0,002+22*0,002)=0,008
Poznać definicję przewodnictwa właściwego i przewodnictwa molowego roztworu elektrolitu Przewodność elektrolityczna (dawniej - przewodnictwo właściwe elektrolitu) jest to przewodnictwo roztworu elektrolitu zawartego pomiędzy równoległymi elektrodami odległymi o jednostkę (1 m) i polu przekroju poprzecznego słupa cieczy zawartego między nimi jednostkowym (1 m2), przy czym pole elektryczne pomiędzy elektrodami jest jednorodne. Przewodność molowa (dawniej - przewodnictwo molowe) jest to przewodnictwo roztworu elektrolitu zawartego pomiędzy równoległymi elektrodami odległymi o jednostkę (1 m) i o takim polu przekroju poprzecznego słupa cieczy zawartego między nimi, że w tak utworzonej objętości zawarty jest jeden mol elektrolitu, przy czym pole elektryczne pomiędzy elektrodami jest jednorodne.
Do wyznaczenie jakiej wielkości jest niezbędna jest znajomość liczby przenoszenia jonu
Niezbędne są one do wyznaczenia przewodnictw równoważnikowych i molowych jonów
Zdefiniować ogniwo galwaniczne i siłę elektromotoryczną ogniwa
Ogniwo galwaniczne to układ złożony z dwu półogniw, w którym entalpia swobodna reakcji chemicznej redoks zamieniana jest na pracę elektryczną, a wymiana elektronów pomiędzy reagentami nie zachodzi bezpośrednio, a poprzez przewodnik metaliczny łączący elektrody obu półogniw. Siła elektromotoryczna ogniwa (SEM) jest to różnica potencjałów pomiędzy elektrodami, gdy ogniwo nie pracuje (jest otwarte), to znaczy opór zewnętrzny jest nieskończenie wielki, a natężenie prądu płynącego przez ogniwo wynosi zero.
Jak przebiega reakcja w ogniwie
Jeżeli E > 0, to reakcja w ogniwie przebiega w sposób samorzutny z lewa na prawo (tak jak jest zapisana).
Jeżeli E < 0, to reakcja w ogniwie przebiega w sposób samorzutny z prawa na lewo (w odwrotnym kierunku niż jest zapisana).
Jeżeli E = 0, to reakcja osiągnęła stan równowagi.
Szybkość reakcji chemicznej to ubytek stężenia molowego substratu lub przyrost stężenia molowego produktu do czasu, w jakim nastąpiła ta zmiana.
Czynniki wpływające na szybkość reakcji chemicznych :
Stężenie substratów i produktów
Temperatura
Rodzaj i stężenie katalizatora
Inne : rodzaj rozpuszczalnika, siła jonowa, ciśnienie, światło, kształt i rodzaj naczynia, w którym przebiega reakcja i wiele innych
Całkowity rząd reakcji chemicznej to suma wykładników potęgowych, w jakich stoją stężenia reagentów w kinetycznym równaniu reakcji. Całkowity rząd reakcji wyraża się liczbami 0,1,2 i 3. Nie istnieje rząd reakcji wyższy niż trzy. W pewnych reakcjach możliwy jest rząd wyrażony liczbami ułamkowymi 1/2 lub 3/2. Występuje on często w przypadku reakcji polimeryzacji wolnorodnikowej. W przypadku cząstkowych rzędów reakcji spotyka się też rząd -1. Rząd reakcji jest wielkością wyznaczaną eksperymentalnie
Jak można wyznaczyć rząd reakcji chemicznej na podstawie czasów połowicznej przemiany Czas połowicznej przemiany jest to czas, po którym stężenie substratu maleje o połowę (osiąga połowę stężenia początkowego).
Metoda czasów połowicznej przemiany
W tej metodzie wyznaczamy dwa czasy połowicznej przemiany przy różnych stężeniach początkowych substratów w tej samej temperaturze. Ogólny wzór na czas połowicznej przemiany ma postać : 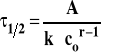
gdzie stała A wynosi ln2 dla rzędu pierwszego, a dla innych rzędów : 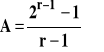
Napiszmy takie równania dla dwu różnych stężeń początkowych substratów. Podzielmy je stronami :
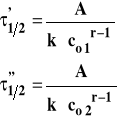
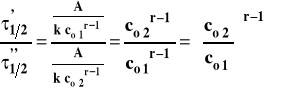
Następnie zlogarytmujmy obie strony :
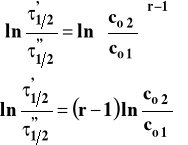
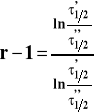
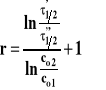
Mając wyznaczone czasy połowicznej przemiany dla dwu różnych stężeń początkowych, obliczamy rząd reakcji z powyższego wzoru. Można też mierzyć czas potrzebny do przereagowania innego ułamka stężenia początkowego np. 1/4, a wzór ten pozostaje słuszny.
Reakcje pierwszego rzędu r=1 v=k*cr v=k*c
Szybkość reakcji pierwszego rzędu jest wprost proporcjonalna do stężenia. Aby uzyskać scałkowane równanie reakcji, musimy uwzględnić, czym jest szybkość reakcji, następnie rozdzielić zmienne i scałkować otrzymane wyrażenie od startu reakcji czyli czasu 0 do czasu t i od stężenia początkowego co do stężenia c odpowiadającego czasowi t.
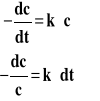
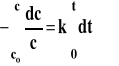
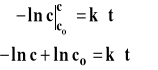
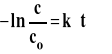
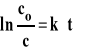
Scałkowane równanie reakcji można też zapisać w postaci : lnc=lnc0-k*t
Dla reakcji pierwszego rzędu logarytm ze stężenia jest liniową funkcją czasu. Powyższe równanie jest podstawą wyznaczania stałej szybkości reakcji pierwszego rzędu. W tym celu należy wykreślić zależność lnc od czasu, a wartość bezwzględna nachylenia uzyskanej prostej jest równa stałej szybkości (rysunek 3).
Jednostkę stałej szybkości reakcji pierwszego rzędu znajdujemy następująco :
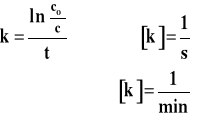
Równanie :![]()
możemy zapisać wprost bez użycia logarytmów : ![]()
Równanie to wskazuje, że stężenie substratu maleje w toku reakcji wykładniczo. Stężenie produktu w czasie można opisać równaniem :
![]()
Na rysunku 4 pokazano, jak zmieniają się stężenia produktu i substratu w toku reakcji pierwszego rzędu.
Rysunek 4. Zmiany stężeń substratu i produktu w toku reakcji pierwszego rzędu.
Czas połowicznej przemiany znajdziemy, podstawiając pod c co/2 do równania :
Czas połowicznej przemiany w reakcji pierwszego rzędu nie zależy od stężenia początkowego substratu. Jest to cecha charakterystyczna dla reakcji pierwszego rzędu.
Reakcje pierwszego rzędu są bardzo często spotykane. Kilka z nich, jak hydroliza estru w środowisku kwaśnym czy hydroliza sacharozy, poznajecie w toku laboratorium. Pierwszy rząd reakcji spotykamy zwykle dla reakcji jednocząsteczkowych oraz dla dwucząsteczkowych, gdy jeden z reagentów jest zarazem środowiskiem reakcji i występuje w bardzo wielkim nadmiarze (jak w przypadku kwasowej hydrolizy estrów). Kinetykę reakcji pierwszego rzędu należy bezwzględnie umieć (równania ją opisujące, sposób wyznaczania stałej szybkości), gdyż jest to model przebiegu w czasie rozmaitych procesów. Równania kinetyki reakcji pierwszego rzędu stosuje się między innymi do opisu takich zjawisk jak :
rozpad izotopów promieniotwórczych
rozpad leku w organizmie po podaniu
śmiertelność mikroorganizmów w wyniku działania temperatury (pasteryzacja, sterylizacja)
zanik substancji szkodliwych w środowisku
zanik fotoluminescencji (fluorescencji lub fosforescencji) po ustaniu wzbudzenia
Równanie Arrheniusa opisuje ilościowo wpływ temp. na szybkość reakcji. Ilościowo wpływ temperatury na szybkość reakcji opisuje równanie Arrheniusa, które podaje zależność stałej szybkości reakcji od temperatury w postaci różniczkowej.
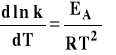
gdzie : EA - energia aktywacji
Katalizatory to substancje, które zwiększają szybkość reakcji chemicznej, pozornie nie wchodząc w nią, a po zajściu reakcji pozostają niezmienione.
Katalizator powoduje przyspieszenie reakcji.
Katalizator zwiększa stałą szybkości reakcji w danej temperaturze.
Obecność katalizatora obniża energię aktywacji reakcji.
W obecności katalizatora mechanizm reakcji jest inny niż bez niego.
Katalizator nie ma wpływu na stan równowagi reakcji ani na jej efekt cieplny.
Katalizator przyspiesza osiągnięcie stanu równowagi reakcji chemicznej.
Katalizator nie zmienia stałej równowagi reakcji.
Proces odwracalny (quasi statyczny) to taki, który zachodzi pod wpływem nieskończenie małej siły napędowej, poprzez szereg kolejnych stanów równowagi. W każdej chwili można go przerwać i po tej samej drodze cofnąć do stanu początkowego.
Proces nieodwracalny to taki, który zachodzi pod wpływem skończonej siły napędowej. Nie można go cofnąć po tej samej drodze do stanu początkowego.
Standardowa entalpia spalania to zmiana entalpii towarzysząca pełnemu utlenieniu 1 mola związku w czystym tlenie, przy czym jako produkty reakcji powstają : CO2(g), H2O(c), N2(g), SO2(g), w warunkach standardowych.
Związek pomiędzy ciepłem reakcji w stałej objętości a pod stałym ciśnieniem
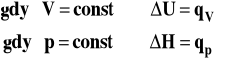
Ponieważ energia wewnętrzna i entalpia są funkcjami stanu i ich zmiana nie zależy od drogi przemiany, to w określonych uprzednio warunkach ciepło nie zależy od drogi procesu. W odniesieniu do reakcji chemicznych ten wniosek z pierwszej zasady termodynamiki formułuje się jako prawo Hessa
Gazy rzeczywiste i doskonałe.
Gazem doskonałym nazywamy gaz spełniający równanie stanu Clapeyrona. pV=nRT
Własności gazu doskonałego:
-nie można go skroplić
-jego cząsteczki nie przyciągają się i nie mają objętości własnej
-nie oddziaływają ze sobą ulegają jedynie elastycznym zderzeniom wymieniając tylko energię kin i pęd
-cząsteczki są pkt materialnymi.
-poruszają się ruchem bezwładnym
-lepkość i wsp. Przenikania ciepła nie zal od temp.
Gaz rzeczywisty-ma określone wymiary, a pomiędzy jego cząsteczkami występują różnego rodzaju oddziaływania, nie spełnia on założeń gazu doskonałego, nie spełnia równ. Clapeyrona, skraplają się w niskich temp
Wyprowadzić i omówić warunek samorzutności procesu zachodzącego przy p,T=const. Samorzutność procesów izochoryczno-izotermicznych
Wychodzimy z nierówności Clausiusa i pierwszej zasady termodynamiki zapisanej przy użyciu energii wewnętrznej.
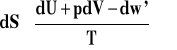
Przekształcamy tę nierówność w sposób analogiczny jak uprzednio, wykorzystując definicję energii swobodnej. F=U-TS i otrzymujemy
![]()
Jeżeli proces przebiega w stałej temperaturze i w stałej objętości, to : V = const dV =0 i T = const dT = 0![]()
Otrzymaliśmy ostatecznie warunek samorzutności procesów izochoryczno izotermicznych. Jeżeli dodatkowo nie ma pracy nieobjętościowej dw' = 0, to :![]()
Co to znaczy że układ jest w stanie równowagi termodynamicznej
W stanie równowagi termodynamicznej potencjał chemiczny każdego ze składników jest jednakowy we wszystkich fazach układu
![]()
Mamy 0,1 mol/kg wodny roztwór glukozy i taki sam NaCl. Czy ciśnienie osmotyczne będzie: jednakowe dla obu roztworów, ponieważ ciśnienie osm jest wart. koligatywną
Graniczne prawo Debye'a-Hückla
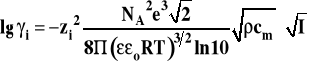
gdzie : NA - liczba Avogadro e - ładunek elemt.
- względna przenikalność dielektryczna rozpuszczalnika o - przenikalność dielektryczna próżni
ρ - gęstość rozpuszczalnika
![]()
- stężenie standardowe 1 mol/kg zi - wartościowość jonu I - siła jonowa roztworu
Cząsteczkowość reakcji chemicznej to liczba cząsteczek biorących udział w elementarnym akcie reakcji, decydującym o szybkości całej reakcji.
Które wielkości nie są funkcjami stanu?
-Praca W -Ciepło Q
Ich wartość zależy od drogi procesu. Funkcje stanu: energia wewnętrzna, entalpia, entropia, entropia swobodna, entalpia swobodna
Standardowa entalpia tworzenia jonu to zmiana entalpii towarzysząca powstaniu 1 mola solwatowanych jonów w rozcieńczeniu nieskończenie wielkim z czystych, rozdzielonych pierwiastków w warunkach standardowych. Standardowa entalpia tworzenia jonu wodorowego w dowolnym rozpuszczalniku i temperaturze wynosi zero.
Pewna ilość gazu doskonałego uległa odwracalnemu adiabatycznemu sprężeniu (rozprężeniu)
-Energia wewnętrzna gazu: wzrosła
-Końcowa temperatura gazu była: wyższa
Zależność pomiędzy temperaturą a ciśnieniem przemiany fazowej - wzór Clapeyrona
Rozpatrujemy układ jednoskładnikowy, w którym zachodzi przemiana fazowa pierwszego rodzaju, czyli w stanie równowagi współistnieją dwie fazy. Z reguły faz Gibbsa wynika, że zmienność takiego układu wynosi 1, czyli można zmieniać w sposób niezależny tylko jeden parametr układu, a reszta parametrów musi się dostosować do jego zmian. W stanie równowagi :
![]()
W danej temperaturze i ciśnieniu ustala się stan równowagi, w którym :
![]()
Jeśli zmienimy temperaturę o dT, to ponieważ układ jest jednozmienny, wymusi to zmianę ciśnienia o dp, oraz entalpii swobodnych o dG.
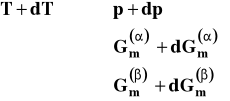
W efekcie ustala się nowy stan równowagi, w którym nowe wartości entalpii swobodnych są sobie równe.
![]()
Ponieważ molowe entalpie swobodne w początkowym stanie równowagi były sobie równe :
![]()
to ostatecznie ich różniczki są sobie równe.
![]()
Różniczkę molowej ent swob można wyrazić jako :
![]()
Podstawiając to do poprzedniej równości, otrzymujemy :
![]()
Porządkujemy to wyrażenie, aby wyrazy z entropią były po jednej stronie, a z objętością po drugiej.
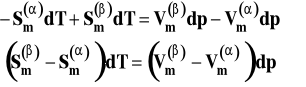
Różnice w nawiasach to odpowiednio molowa entropia przemiany fazowej i zmiana objętości molowej w przemianie fazowej.
![]()
Ostatecznie otrzymujemy wzór Clapeyrona.
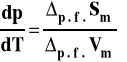
Wzór ten podawany jest zwykle w nieco innej postaci, po uwzględnieniu związku entropii przemiany fazowej z entalpią.
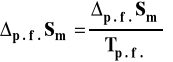
Osmoza to samorzutna migracja cząsteczek rozpuszczalnika od czystego rozpuszczalnika do roztworu przez membranę półprzepuszczalną w stałej temperaturze. Ciśnienie osmotyczne, to ciśnienie, jakie należy przyłożyć do roztworu oddzielonego od rozpuszczalnika membraną półprzepuszczalną, aby zahamować całkowicie migrację rozpuszczalnika przez nią.
Wpływ ciśnienia na stałą równowagi reakcji chemicznej - izoterma van Laara-Plancka Rozpatrujemy układ zamknięty, w którym zachodzi reakcja chemiczna, w stałej temperaturze. Z ogólnych zależności termodynamicznych wiemy, że :
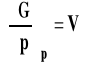
co dla zmian stand możemy zapisać jako :
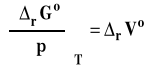
Symbol rVo oznacza standardową zmianę objętości w reakcji chemicznej, czyli różnicę objętości molowych w warunkach standardowych produktów i substratów, pomnożone przez odpowiednie współczynniki stechiometryczne w równaniu reakcji chemicznej.
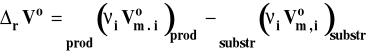
Standardowa entalpia swobodna reakcji chemicznej jest związana ze stałą równowagi następująco :
![]()
Po podstawieniu do pochodnej i przekształceniach, otrzymujemy :
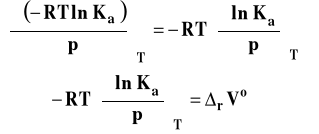
Izoterma van Laara-Plancka
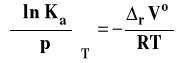
Izoterma van Laara-Plancka określa wpływ ciśnienia na stałą równowagi reakcji chemicznej w stałej temperaturze. Należy dodać, że pod ogólnie oznaczoną stałą Ka kryją się stałe Kx, Km lub Kc, gdyż one zależą od ciśnienia. Natomiast, jak pamiętamy, stała równowagi wyrażona przez ciśnienia Kp nie zależy od ciśnienia. Ta postać stałej izotermy van Laara-Plancka pozwala wnioskować, jaki jest wpływ ciśnienia na wartość stałej równowagi.
Jeżeli rVo < 0 (reakcja zachodzi ze zmniejszeniem objętości czyli objętość produktów jest mniejsza niż substratów), to Ka rośnie, gdy ciśnienie rośnie.
Jeżeli rVo > 0 (reakcja zachodzi ze wzrostem objętości czyli gdy objętość produktów jest większa niż substratów), to Ka maleje, gdy ciśnienie rośnie.
Solwatacja jonu to samorzutne otaczanie jonu przez cząsteczki rozpuszczalnika w wyniku oddziaływań jon - dipol, przy czym dipol elektryczny cząsteczki rozpuszczalnika może być stały lub wyindukowany.
Wzór Kohlrauscha
![]()
Dla mocnych elektrolitów przewodność molowa maleje liniowo wraz ze wzrostem pierwiastka ze stężenia elektrolitu. Stała b w tym wzorze zależy od układu elektrolit-rozpuszczalnik oraz od temperatury. o to graniczna przewodność molowa.
Energia aktywacji to najmniejsza ilość energii, jaką muszą posiadać substraty, aby ulec przekształceniu w produkty, liczona na 1 mol elementarnych aktów reakcji.
Prawo podziału Nernsta.
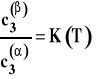
W stałej temperaturze i pod stałym ciśnieniem w układzie dwu niemieszających się cieczy, do których dodano składnik rozpuszczalny w każdej z nich, ustala się stan równowagi, w którym stosunek stężeń tego trzeciego składnika w obu cieczach jest stały w danej temperaturze.
Stałą K występującą w tym wzorze nazywamy stałą (współczynnikiem) podziału Nernsta. Jej wartość zależy od temperatury.
Energia wiązania jest to pewna umowna wielkość przypisywana wiązaniu w cząsteczce w ten sposób, że suma energii wiązań jest równa entalpii rozpadu 1 mola związku w stanie gazowym na atomy w stanie gazowym w temperaturze 0 K, przy czym analogiczne wiązania traktuje się jako równocenne energetycznie.
Pewna ilość gazu doskonałego ulega odwracalnemu adiabatycznemu rozprężaniu:
Energia wewnętrzna gazu zmalała
Końcowa temp. gazu była niższa od początkowej
Roztwór doskonały
-to taki, w którym potencjał chemiczny każdego składnika w roztworze można opisać równaniem :
![]()
w całym zakresie stężeń
![]()
- spełnia prawo Raoulta
Wzór ebulioskopowy (ebuliometryczny) ![]()
Stała ebulioskopowa 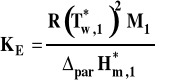
gdzie : cm2 - stężenie molarne substancji rozpuszczonej (w mol/kg)
M1 - masa cząsteczkowa rozpuszczalnika
parH*m,1 - molowa entalpia parowania rozpuszczalnika
Jednostką stałej ebulioskopowej jest kg·K/mol.
15.Stała równowagi Kx dla reakcji:
wraz ze wzrostem ciśnienia będzie rosła.
16.Standardowa entalpia pewnej reakcji wynosiła 100kJ/mol
Stała równowagi reakcji wraz ze wzrostem temp. będzie malała.
Związek pomiędzy aktywnością elektrolitu, aktywnościami jonów, średnią aktywnością jonową
Aktywność elektrolitu-współ. aktywności elektrolitu można obliczyć w oparciu o teorię Debye'a-Huckla.
a±=![]()
![]()
![]()
![]()
19.Mostek Wheatstone'a
Pomiar przy jego użyciu jest pomiarem porównawczym. Pomiar nieznanego oporu Rx polega na takim doborze wartości R1 oraz stosunków oporu R2 i R3 aby galwanometr G nie wykazywał przepływu prądu. Potencjały C i D są sobie równe.
W stanie równowagi IAB=0 =>VA=VB I1=I3 i I2=IX
I1R1=I3R3 I2R2=IXRX
R1/R3=R2/RX RX=R2R3/R1
20.Prawo niezależnej wędrówki jonów Kohlrausha:
Jony w roztworze w polu elektrycznym wędrują niezależnie od siebie, a przewodnictwo roztworu elektrolitu jest sumą przewodnictw pochodzących od poszczególnych jonów (kationów i anionów).
![]()
21.Co to jest ruchliwość jonu?
Ruchliwość jonu- szybkość poruszania się jonu w polu elektrycznym o natężeniu jednostkowym.
![]()
=![]()
Jednostką ruchliwości jest m2/Vs.
Ruchliwość jonu zależy od jego promienia hydrodynamicznego, lepkości środowiska oraz ładunku.
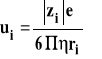
22.Dlaczego def. SEM ogniwa zawiera sposób jej pomiaru?
Def. SEM wskazuje jakie warunki muszą być spełnione przy jej pomiarze- przez ogniwo nie może płynąć prąd.
27.Jednostka stałej szybkości reakcji chemicznej:
Jednostka szybkości reakcji chemicznej jest taka sama dla wszystkich reakcji, natomiast zależy od użytych jednostek czasu.
Jak można wyznaczyć EA reakcji chemicznej?
Trzeba wyznaczyć dośw. stałe szybkości w co najmniej dwu różnych temp. Następnie do obliczenia energii aktywacji korzystamy z równania Arheniusa:
ln![]()
=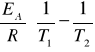
![]()
lub graficznie całkując to równanie bez granic
lnK=lnK0-![]()
wtedy - ![]()
jest współczynnikiem kierunkowym prostej w zależności lnK od ![]()
.
Mechanizm działania katalizatora
Reakcja bez katalizatora: A+B->P (wolna)
Reakcja z kat zachodzi co najmniej w 2 etapach:
1 etap(szybko) A+kat->Akat substrat reaguje z kat tworząc produkt przejściowy
2 etap(szybko) Akat +B-> P+kat związki przejściowe reagują dalej i w końcowym dają produkty zregenerowany kat.
Szybkość reakcji katalizowanej jest wprost proporcjonalna do stężenia katalizatora.
30.Dla pewnej reakcji zależność stężenia od czasu może być przedstawiona w postaci linii prostej:
Reakcja ta jest 2 rzędu
Stała szybkości można wyznaczyć z tgα=k
narysowac wykres dla układu 2-skaldnikowego ciecz-cialo stale spelnaiajce prawo raoulta
Wzor na stała krioskopowa i wzor kriometryczny
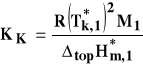
![]()
![]()
9. Czy można metoda ebulioskopowa obliczyc mase czasteczkowa kwasu azotowego??
Tak, ale jeżli jest on rozpuszczalnikiem przekształcając wzor
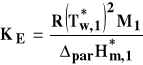
10. Czy wzor ![]()
można zastosoawac do opisu cisnienia osmotycznego roztwotrow mocnych elektrolitow?
Nie, tylko dla roztwotrow slabych elektrolitow
Parametry (wielkości) intensywne to te, których wielkość nie zależy od masy (ilości) substancji. Zaliczamy do nich : temperaturę, ciśnienie oraz każdą wielkość liczoną na 1 mol lub gram substancji - np. objętość molowa, ciepło molowe, ciepło właściwe.
Parametry (wielkości) ekstensywne to te, których wielkość zależy od masy (ilości) substancji. Np. pojemność cieplna układu, energia wewnętrzna, objętość.
21.III zasada termodynamiki
Jeśli entropia każdego pierwiastka w jego najtrwalszym stanie w temperaturze 0 kelwinów jest równa zero, to entropia każdej substancji ma wartość dodatnią, która w temperaturze 0 kelwinów, może być równa zero, zaś jest równa zero dla kryształów idealnych.
co to jest proces adiabatyczny
Przemiana gazu w której nie zachodzi wymiana ciepla z otoczniem. Podczas tego procesu całość energii dostarczana/odbierana jest jako praca
Równanie adiabaty
pVκ= const κ=cp/cv
reakcja jest II rzedu A->B, gdy co wzrosnie 3 razy
Szybkość reakcji wzrośnie 9 razy
Czas połowicznej przemiany zmaleje 3 razy
Mostek Wheatstone'a do pomiarów przewodnictwa właściwego roztworów elektrolitów jest zasilany prądem zmiennym gdyż:
-zapobiega to polaryzacji elektrod i elektrolizie roztworu