Badanie właściwości fizykochemicznych aminokwasów
Identyfikacja aminokwasów
Białka, jak i wolne aminokwasy reagują za pośrednictwem grup: -NH2 i -COOH z ninhydryną, dinitrofluorobenzenem i kwasem azotowym (III). Występowanie w strukturze aminokwasów innych grup funkcyjnych, oprócz aminowej i karboksylowej, umożliwia identyfikację tych aminokwasów na podstawie czułych reakcji barwnych.
Reakcja biuretowa
Nazwa pochodzi od biuretu, związku powstającego przy ogrzewaniu mocznika do 180OC. Reakcję biuretową dają wszystkie połączenia zawierające w cząsteczce co najmniej 2 grupy -CO-NH- połączone ze sobą bezpośrednio (np. w diamidzie kwasu szczawiowego NH2-CO-CO-NH2), poprzez azot (w biurecie) lub poprzez atom węgla (w diamidzie kwasu malonowego, bursztynowego, w produktach hydrolizy białek). W wyniku utworzenia połączenia koordynacyjnego Cu2+ z dwoma przyległymi wiązaniami -CO-NH- powstaje barwny produkt. Dodatniego odczynu reakcji biuretowej nie dają wolne aminokwasy i dipeptydy.
Wykonanie:
Do 1 ml danej próby dodać 1 ml NaOH i kilka kropli 0,5% CuSO4 W obecności białka powstaje fioletowe zabarwienie. Uwaga: ponieważ niebieska barwa odczynnika może maskować właściwy odczyn należy unikać nadmiaru CuSO4.
Reakcja ninhydrynowa
Aminokwasy pod wpływem ninhydryny ulegają utlenieniu poprzez iminokwasy do amoniaku, dwutlenku węgla i aldehydu uboższego o 1 atom węgla. W wyniku kondensacji cząsteczki zredukowanej i utlenionej ninhydryny z amoniakiem powstaje niebiesko-fioletowe zabarwienie, którego natężenie jest proporcjonalne do zawartości azotu aminowego aminokwasów.
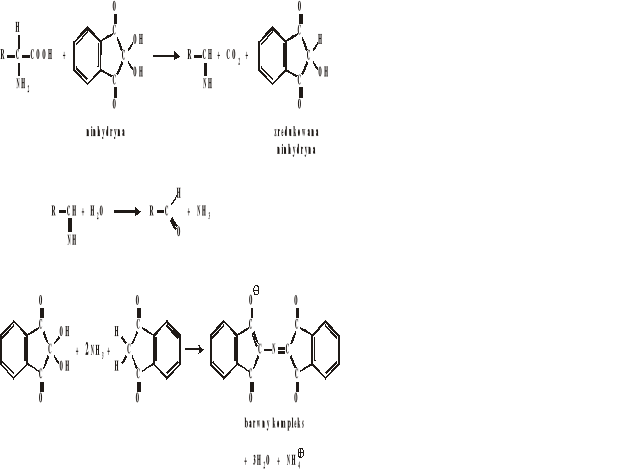
Wykonanie:
Do 1 ml próby badanej dodać 3-4 krople 0,1% roztworu ninhydryny w 50% etanolu. Po wymieszaniu próbę ogrzać do wrzenia. Wszystkie aminokwasy (oprócz proliny) reagują z ninhydryną tworząc niebieskie zabarwienie.
Reakcja ksantoproteinowa
Aminokwasy aromatyczne oraz fenole ulegają reakcji nitrowania w czasie ogrzewania ze stężonym HNO3, dając żółto zabarwione pochodne nitrowe (fenyloalanina wymaga do nitrowania dodatku H2SO4).
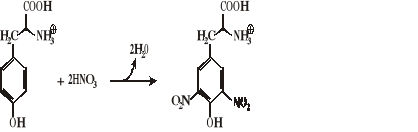
Wykonanie:
Do 1 ml próby badanej dodać 0,5 ml stężonego HNO3 i ogrzewać na wrzącej łaźni wodnej przez 2 min. Wytrąca się żółty osad.
Reakcja Adamkiewicza
Jest to reakcja charakterystyczna dla tryptofanu zawierającego pierścień indolowy. W obecności kwasu siarkowego i formaldehydu (kwas glioksalowy) dwie grupy indolowe ulegają kondensacji z wydzieleniem cząsteczki wody i dają barwny fioletowy związek. Schemat przebiegu reakcji:
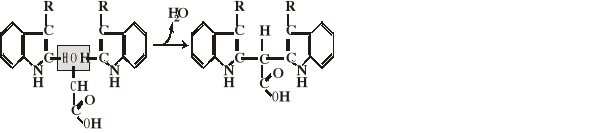
Wykonanie:
Do 1 ml próby badanej dodać kilka kropli formaldehydu. Po wymieszaniu roztwór podwarstwić (po ściance) stężonym H2SO4. Na granicy cieczy powstaje fioletowy pierścień.
Reakcja Millona
Reakcja na wykrywanie tyrozyny jest mało specyficzna, ponieważ dodatni wynik dają również związki zawierające reszty fenolowe.
Wykonanie:
Do 1 ml próby badanej dodać kilka kropli odczynnika Millona. Mieszaninę ogrzewać w łaźni wodnej przez kilka minut. W przypadku obecności tyrozyny pojawia się biały osad, który zabarwia się na żółto, a później na czerwono (lub powstaje czerwone zabarwienie roztworu).
Wykrywanie cysteiny i cystyny
Zawarta w cysteinie i cystynie siarka w silnie zasadowym środowisku ulega uwolnieniu w postaci jonów siarczkowych, które z jonami Pb2+ dają czarny osad PbS. Metionina nie daje dodatniego wyniku w tej reakcji. Schemat przebiegu reakcji:
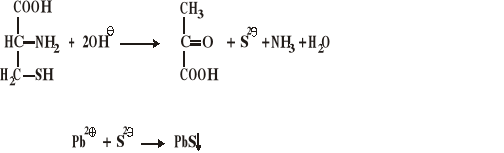
Wykonanie:
Do 1 ml próby badanej dodać 1 ml roztworu octanu ołowiu i 3 ml 10% roztworu NaOH (roztwór powinien być klarowny). Próbkę ogrzewać na łaźni wodnej, po kilku minutach pojawia się czarny osad.
Wykrywanie glutaminy
Próba na obecność glutaminy wykorzystuje obecność w jej cząsteczce ugrupowania amidowego, z którego w warunkach hydrolizy zasadowej uwalnia się gazowy amoniak. Dodatni wynik tej reakcji dają też asparagina i sole amonowe.
Wykonanie:
Do 3 ml próby badanej dodać 3 ml 10% NaOH (roztwór dodać do probówki pipetą, tak aby nie dotknąć jej wylotu). Całość umieścić we wrzącej łaźni wodnej a do wylotu probówki zbliżyć zwilżony uniwersalny papierek lakmusowy. W przypadku obecności glutaminy papierek zmienia zabarwienie na niebieski Uwaga: należy uważać, aby nie dotknąć papierkiem brzegu probówki. wówczas zmiana zabarwienia papierka następuje na skutek obecności NaOH a nie amoniaku.
WF - ćw.1; OML - ćw.1; BL - ćw.1
1
Wyszukiwarka