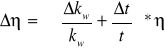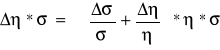FIZYKA H1 - LABOLATORIUM - dr Krystyna Żukowska |
||
Imię i Nazwisko: Krzysztof GĄSIOREK Nr albumu: 117479 |
Ćwiczenie nr 47 |
Wrocław 10 maja 2002 r. |
GRUPA 2/1705 piątek/: Łukasz Szpak Krzysztof Gąsiorek |
TEMAT: ZALEŻNOŚĆ PRZEWODNICTWA ELEKTROLITU OD TEMPERATURY. SPRAWDZENIE REGUŁY WALENDA. |
Ocena: |
Cel ćwiczenia: Pomiar przewodności elektrycznej właściwej (konduktywności) i lepkości elektrolitu w funkcji temperatury. Zapoznanie się z metodami wyznaczania badanych właściwości ciał ciekłych. Sprawdzenie reguły Walenda, która głosi, że iloczyn ση=constans jest niezależny
od temperatury.
Wiadomości wstępne: Stan ciekły zajmuje pośrednie miejsce pomiędzy stanem gazowym
i krystalicznym. Energie oddziaływań pomiędzy cząsteczkami są porównywalne z energią termiczną kT. Wskutek tego, zagadnienia transportu cząsteczek w cieczach są znacznie bardziej skomplikowane
i trudniejsze do teoretycznego ujęcia aniżeli w gazach. Wychodząc z ogólnego modelu kinetycznego Eyringa, każdy proces przepływu trzeba rozpatrywać jako serię przeskoków między stanami równowagi rozdzielonymi barierą energetyczną. Tę zaś, można powiązać z energią oddziaływania między cząsteczkami.
Do elektrolitów ( przewodników II klasy) należą głównie roztwory soli, kwasów i zasad
w wodzie lub w innych rozpuszczalnikach o dużej przenikliwości elektrycznej. Elektrolitami
są substancje o wiązaniach jonowych; grupy atomów o ładunkach przeciwnego znaku przyciągają się siłami kolumbowskimi. Jeżeli siły oddziaływania między jonami zostaną znacznie zmniejszone,
to doprowadzi to do zerwania wiązań. Obojętne elektrycznie cząsteczki ulegną wtedy dysocjacji, czyli rozpadowi na swobodne jony, zdolne do przewodzenia prądu. Przewodzenie prądu przez elektrolity - konduktancja jonowa - jest związana z transportem masy, bowiem nośnikami prądu są jony
o stosunkowo dużej masie. Jonami dodatnimi są jony wodoru i metali, a ujemnymi - jony reszt kwasowych i grup - OH.
Stopniem dysocjacji elektrolitu nazywamy stosunek liczby cząsteczek zdysocjowanych
do ogólnej liczby cząsteczek rozpuszczonych.
Z chwilą przyłożenia do elektrolitu zewnętrznego pola elektrycznego, tzn. z chwilą zanurzenia do roztworu dwóch elektrod połączonych ze źródłem napięcia, na jony działają siły elektryczne:
F=q*E
Pod ich wpływem istniejące w roztworze kationy zmierzają do elektrody o potencjale niższym (katoda), a aniony do elektrody o potencjale wyższym (anody). W elektrolicie następuje uporządkowany ruch ładunków elektrycznych, czyli płynie prąd. Kierunek prądu jest kierunkiem ruchu ładunków dodatnich - kationów. Do prądu tego dodaje się prąd płynący w przeciwnym kierunku ładunków przeciwnego znaku - anionów.
W wiskozymetrze i w naczyniu elektrolitycznym znajduje się ten sam roztwór elektrolitu (NaCl -0,5% w roztworze wody i gliceryny w stosunku 4:1). Zależność temperaturową przewodności można przedstawić za pomocą funkcji wykładniczej 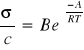
,gdzie:
c - stężenie molowe roztworu (wyrażone w gramorównoważnikach=(masa jednego mola podzielona przez wartościowość), rozpuszczonej substancji na jednostkę objętości roztworu,
![]()
.
B - stała w dość ograniczonym przedziale temperatur,
A - energia aktywacji procesu poruszania się jonów w lepkim, stawiającym opór ośrodku, decydującym o ruchliwości jonów. Wartość tej energii jest zbliżona do energi aktywacji laminarnego przepływu wody i w temperaturze 288K wynosi3,6kcal,
R - uniwersalna stała gazowa.
Do wyznaczenia lepkości wykorzystujemy prawo Stokesa opisujące ruch opadania kuli w ośrodku lepkim. Siłę oporu wywieraną przez ciecz, F. Podczas opadania kulki opisuje równanie![]()
.
gdzie v - prędkość opadania kulki, r - promień kulki.
Podczas stacjonarnego opadania kulki, gdy opór stawiany przez ciecz równoważony jest ciężarem spadającej kulki, pomniejszonym przez siłę wyporu równą ciężarowi ciecz wypieranej przez kulkę. Zależność tą stosujemy, gdy kulka opada swobodnie pionowo w odległości dostatecznie dużej do ścian naczynia, w którym znajduje się ciecz. W wiskozymetrze Höpplera, stosowanym powszechnie w praktyce, warunki te nie są spełnione, gdyż kulka toczy się w rurce nachylonej pod kątem 80°
o średnicy niewiele większej od średnicy kulki. Mamy także wzór, który zawiera jedynie wielkości niezależne od badanej cieczy, można je wyznaczyć, jako wielkość stałą dla danej rurki i kulki.
Jest to tzw. stała kulki.
Ostatecznie do wyznaczenia η stosujemy wzór: ![]()
,
gdzie g,kw, ρk są to wielkośći tablicowe, a r, v, ρc, v, t są to wielkości mierzone.
Główną częścią wiskozymetru Höpplera, pokazanego na rysunku, jest rurka pomiarowa R,
w której umieszcza się badaną ciecz oraz kulkę. Rurka jest umocowana w okrągłym płaszczu szklanym P służącym do termostatowania i wraz z nim przymocowana do pochyłej osi do podstawy. Rurka zaopatrzona jest w trzy nacięcia A,B,C. Zasada pomiaru polega na mierzeniu czasu opadania kulki pomiędzy działkami A i B, po czym wyliczaniu lepkości.
My posługując się sondą miernika wiskozymetru dokonujemy pomiaru metodą pośrednią, mierząc przewodność Gw elektrolitu wzorcowego o znanej przewodności właściwej ρw w tych samych warunkach pomiarowych.
Wówczas możemy przyjmując, że ![]()
określić ![]()
.
W konduktometrie stosowanym w tym ćwiczeniu sonda pomiarowa zawiera również termoopór platynowy, co pozwala równocześnie określić temperaturę elektrolitu.
Schemat pomiarowy.
Przebieg pomiarów.
Zgodnie z instrukcją obsługi wiskozymetru Höpplera zmierzono dwukrotnie lepkość roztworu
w temperaturze pokojowej. Konduktometrem dokonano pomiaru temperatury elektrolitu oraz przewodności, dobierano zakresy tak by odczytać maksymalną liczbę cyfr. Pomiar taki powtarzano dla temperatur wyższych po ustabilizowaniu się równowagi termicznej.
Tabela Pomiarowa.
Temperatura elektrolitu T[˚C] |
26,8 |
31,9 |
35,4 |
40,5 |
45,3 |
Czas opadania kulki t[s] |
153 |
135 |
117 |
100 |
91 |
Przewodność elektrolitu G[S] |
11,91 |
13,54 |
14,67 |
16,4 |
18,1 |
Konduktancja elektrolitu σz[S/m] |
0,516 |
0,586 |
0,635 |
0,709 |
0,784 |
Wyznaczona lepkość η=kw*t[cP=10-3*(Ns/m2)] |
2,6316 |
2,322 |
2,0124 |
1,72 |
1,5652 |
Regula Walenda σz*η=constans[cP*S/m] |
1,3579 |
1,3607 |
1,2779 |
1,2195 |
1,2271 |
|
0,0325 |
0,0307 |
0,0289 |
0,0272 |
0,0263 |
|
0,004 |
0,004 |
0,004 |
0,005 |
0,005 |
|
0,0262 |
0,0271 |
0,0268 |
0,0271 |
0,0283 |
Zakresy pomiarowe G [mS] stałe=19,99;
Zakresy pomiarowe σ [S/m] stałe=1,999;
Stała sondy pomiarowej K=42,7[1/m];
Stała wiskozymetru kw=0,0172 [cP/s];
Δt=±1s; ΔT=±1,5˚C; Δkw=±0,0001[cP/s]; (przyjmujemy ziarno przyrządu mierzącego lub znaczącą cyfrę ewentualnie określony w teorii błąd)
Wykresy poglądowe.
Przykładowe wzory i obliczenia:
![]()
![]()
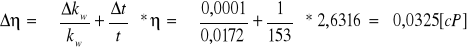
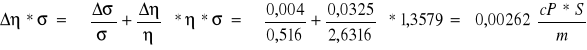
Wnioski końcowe:
Jak widzimy na załączonych wykresach zależność lepkości od temperatury jest wyraźnie liniowa, podobnie jest z zależnością przewodności od temperatury. Gdy temperatura roztworu wzrasta, jego lepkość maleje (dygresja - bardzo ważne w użytkowaniu silników spalinowych, olej silnikowy zapewniający smarność suwu tłoka ma spełniać zadanie w wysokich temperaturach, bo ok. 83 ˚C, czyli interesuje nas jego lepkość w temperaturze pracy, co oznacza, że olej będzie rzadszy, a jego lepkość będzie większa, gdy wystygnie, dążymy więc by temperatura miała najmniejszy wpływ na lepkość, czyli by olej zachowywał smarność w wysokich temperaturach), więc zwiększa się, co za tym idzie ruchliwość jonów i dodatkowo może wzrastać stopień dysocjacji α (dygresja - elektrolity znalazły zastosowanie w ogniwach, którymi są także akumulatory samochodowe; wiemy także, że stężenie roztworu kwasu siarkowego w akumulatorze nie powinno przekraczać określonych przez producenta wartości, ponieważ ono samo będzie hamować przepływ prądu - nadmiar cząsteczek, więc i zderzeń międzycząsteczkowych- oraz będzie powodować nadmierne osadzanie się na płytkach ołowianych zanieczyszczeń oraz ich obsypywanie się, co powoduje obniżenie pojemności akumulatora -zmniejszają się powierzchnie elektrod-). Czyli przewodnictwo jonowe zależy głównie od lepkości roztworu.
Reguła Walenda, czyli stałość iloczynu σ*η winna być nieuzależniona od temperatury, jest spełniona, co nie wynika z zależności przedstawionej na wykresie, ponieważ winna ona być funkcją stałą, ale możemy się pokusić o stwierdzenie, że nawet z naszych pomiarów wynika zachowanie iloczynu Waldena. Nazwa wskazuje jest to już przez uczonych dowiedziona reguła, choć w pomiarach odchyłki są dość znaczne, ale my możemy stwierdzić jedynie, że nasze pomiary zostały wykonane
w niekorzystnych warunkach (np. ze względu na krążenie i podgrzewanie cieczy możemy stwierdzić, że stopień chwilowej dysocjacji nie był stały lub temperatura cieczy w rurce wiskozymetru nieproporcjonalnie się różniła od mierzonej przez nas, oraz pomiar czasu opadania kulki obarczony jest dużym błędem, bo błędem obserwatora). Czyli zależność przewodnictwa jest bardziej złożona i zależy nie tylko od temperatury i lepkości, ale także od stężenia roztworu, stopnia dysocjacji i ruchliwości jonów.
Wyszukiwarka