UNIWERSYTET WARMIŃSKO-MAZURSKI W OLSZTYNIE
WYDZIAŁ NAUK TECHNICZNYCH
Sprawozdanie z ćwiczeń laboratoryjnych z przedmiotu „Materiały budowlane”
TEMAT: Korozja metali i ochrona przed korozją.
Krystian Cekała
Gr. 1b
Olsztyn, grudzień 2007
Korozja - są to wszystkie procesy, w wyniku których metal lub stop użyty jako materiał konstrukcyjny pod wpływem oddziaływania otoczenia przechodzi ze stanu wolnego (metalicznego) w stan związany.
W wyniku procesów endotermicznych podczas otrzymywania metali z ich związków, uzyskują one wyższą energię wewnętrzną. W zetknięciu ze środowiskiem zachodzą reakcje odwrotne, prowadzące do obniżenia energii wewnętrznej. Metal ze stanu wolnego przechodzi w stan związany.
Ze względu na odporność korozyjną metale dzielą się na nieszlachetne
(przeważają w przyrodzie) i metale szlachetne (np. złoto, platyna).
Na podstawie odporności korozyjnej- aktywności chemicznej, metale zostały uszeregowane w tzw. szereg aktywności (elektrochemiczny, napięciowy).
Podstawą do zaszeregowania metali w wyżej wymieniony szereg jest wartość tzw. potencjału normalnego poszczególnych metali wyrażony w V (voltach).
Potencjał normalny metalu ![]()
jest to potencjał tego metalu zanurzonego w roztworze własnych jonów o stężeniu 1-molowym.
Szereg aktywności metali można przedstawić w postaci osi liczbowej:
Możliwość zachodzenia reakcji metali wynikających z jego położenia w szeregu aktywności:
im bardziej ujemny potencjał ma metal tym szybciej reaguje (ulega korozji)
metale mniej szlachetne (bardziej ujemne) wypierają ze związków metale bardziej szlachetne zajmując ich miejsce, np.
![]()
metale znajdujące się w szeregu przed wodorem (ujemne potencjały) wydzielają się w kwasach z wydzielaniem wodoru
Rodzaje korozji:
1. Korozja chemiczna - zachodzi w suchych gazach i cieczach, które nie są elektrolitami. Korozja chemiczna zachodzi na ogół równomiernie na całej powierzchni.
![]()
![]()
![]()
![]()
![]()
reakcja ta zachodzi w podwyższonej temperaturze w kąpielach alkalicznych, nie da się go łatwo spasywować.
Niektóre metale, tak jak aluminium i chrom pokrywają się bardzo łatwo własnym tlenkiem pod wpływem tlenu, a ściśle przylegająca do tych metali warstwa ich tlenków zapobiega dalszej korozji. Metal ulega pasywacji. Pasywacja jest jednym ze sposobów zapobiegania korozji.
Pasywacja Al może zachodzić pod wpływem tlenu z powietrza lub można aluminium pasywować elektrolitycznie (np. blachy)
2. Korozja elektrochemiczna - zachodzi w wyniku zetknięcia metali i ich stopów z elektrolitami (roztworami kwasów, zasad, soli). W wyniku tej korozji na powierzchni metalu powstają mikroogniwa lokalne, które mogą doprowadzić do powstania głębokich wżerów w metalu. Korozja elektrochemiczna jest dużo groźniejsza od chemicznej.
Rodzaje mikroogniw lokalnych:
1) metal 1 elektrolit metal 2
2) metal elektrolit niemetal
3) metal elektrolit tlenek metalu
Zapobieganie korozji:
Pasywacja
Stosowanie metali i stopów odpornych na korozję
dobór kształtu konstrukcji uniemożliwiającej skraplanie pary
poprzez odcięcie powierzchni metali od czynnika korodującego (farby, lakiery, emalie, smary, materiały bitumiczne)
poprzez zmianę właściwości chemicznej powierzchni metalu- fosforowanie, chromianowanie
poprzez zamianę właściwości korozyjnych otoczenia- stosowanie tzw. inhibitorów- katalizatorów ujemnych
powlekanie metali (stali) metalami mniej szlachetnymi (warstwa anodowa) lub bardziej szlachetnymi (warstwa katodowa)
WYKONANIE ĆWICZENIA
1. Badanie korozji aluminium spasywowanego i zaktywowanego.
Aluminium jest metalem o stosunkowo niskim potencjale normalnym.
∏0Al = -1,66V
∏0Fe = -0,44V
∏0Cu = +0,34V
1.1. Aktywowanie aluminium (czyszczenie powierzchni blaszki aluminiowej z warstewki tlenku)
Powierzchnię blaszki aluminiowej należy oczyścić mechanicznie do połysku przy pomocy papieru ściernego, a następnie na minutę zanurzyć do 20% roztworu HCl - chemiczna metoda aktywacji. Równocześnie na 1 minutę w wyżej wymienionym kwasie należy zanurzyć krążek platynowy.
Reakcje, według których zachodzi aktywacja chemiczna:
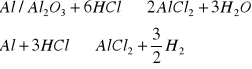
![]()
reakcja nie zachodzi
1.2. Pasywowanie aluminium - jest to pokrywanie powierzchni metalu warstewką jego tlenku (proces odwrotny do aktywacji). Należy oczyścić papierem ściernym powierzchnię blaszki aluminiowej, a następnie zanurzyć ją na 20 minut w 20% roztworze HNO3.
Pasywacja zachodzi zgodnie z równaniami:
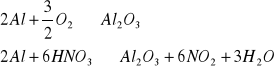
W powyższych reakcjach tlen i kwas azotowy są pasywatorami, pozornie powodują, że glin staje się bardziej szlachetny, niż jest w rzeczywistości., czego dowodem jest zachowanie blaszki zaktywowanej i spasywowanej zanurzonej później w roztworze CuSO4.
1.3. Zaktywowaną i spasywowaną blaszkę oraz krążek platynowy należy zanurzyć równocześnie na 3 minuty do roztworu CuSO4.
![]()
płytka glinowa zaktywowana
![]()
- płytka spasywowana -reakcja zachodzi w znikomy sposób
![]()
reakcja nie zachodzi
Wnioski:
Glin jako metal o niższym potencjale normalnym równym -1,66V wypiera z roztworu soli miedziowej miedz o potencjale +0,34V. Płytka aluminiowa pokrywa się warstewką miedzi (rudawo- bordowy osad). Metal spasywowany zachowuje się jak metal bardziej szlachetny niż jest w rzeczywistości. Reakcja powyższa nie zachodzi lub bardzo minimalnie. Z doświadczenia wynika, że pasywacja metalu jest jednym ze sposobów zapobiegania korozji.
2. Badanie wpływu inhibitora (katalizator ujemny) na rozpuszczalność stali w roztworze H2SO4 - korozja.
Katalizatory są to substancje, które przyspieszają lub opóźniają reakcje. Katalizatory przyspieszające to katalizatory dodatnie, a katalizatory opóźniające to inhibitory lub katalizatory ujemne.
Należy oczyścić do połysku papierem ściernym 2 płytki stalowe. Jedną z płytek zanurzyć w roztworze ![]()
czystym i ![]()
z dodatkiem inhibitora (zanurzyć na 15 minut).
Równania zaobserwowanych reakcji:
![]()
![]()
reakcji nie zachodzi (lub zajdzie lecz w znikomy sposób)
Wnioski:
Przy zanurzeniu płytki stalowej do czystego H2SO4 zauważamy znaczne wydzielanie H2 (wodoru). Po zanurzeniu płytki w H2SO4 z inhibitorem reakcja zachodzi w sposób znikomy (jest praktycznie niewidoczna).
Oznacza to, że w otoczeniu z inhibitorami korozja zachodzi znacznie wolniej, stosowanie ich zapobiega korozji.
.
2
1
Wyszukiwarka