1. omówić budowę atomu:
Główne części każdego atomu to jądro atomowe i elektrony przemieszczające się wokół niego po orbitach. Przestrzeń, w której poruszają się elektrony nazywa się strefą elektronową. Średnica jądra atomowego to zaledwie 1/10000 średnicy całego atomu.
Jądro zwiera dwa rodzaje cząstek elementarnych: protony i neutrony. Masa neutronu jest w przybliżeniu równa masie protonu. Masa całego atomu zleży wyłącznie od masy jądra atomowego, czyli o sumy mas neutronów i protonów w tym jądrze.
Atom jako całość jest układem trwałym. Pomiędzy protonami i elektronami występują jednoczesne siły przyciągani spowodowane tym iż maja one różnoimienne ładunki elektryczne. Protony obdarzone są dodatnim a elektrony ujemnym ładunkiem elektrycznym. Liczba protonów w jądrze równa jest liczbie elektronów krążących wokół jądra, dlatego atom jako całość jest elektrycznie obojętny.
2. Co to jest masa atomowa:
liczba określająca, ile razy masa średniego atomu danego pierwiastka (tj. dla naturalnej mieszaniny izotopów danego pierwiastka) jest większa od pewnej masy wzorcowej: jako masę wzorcową przyjmuje się 1/12 masy atomu izotopu 12C (tzw. skala węglowa) lub (dawniej) 1/16 masy atomu izotopu 16O (tzw. skala tlenowa).
3. Wyjaśnić strukturę elektronową atomów :
W każdym obojętnym atomie ilość elektronów równa jest liczbie atomowej, a więc równa jest ilości protonów w jądrze. Konfiguracja elektronowa np. chromu (Cr) wskazuje na argonowy rdzeń (patrz: Argon) plus pięć elektronów z powłoki 3d i jeden elektron z powłoki 4s. Energia jonizacji oznacza najmniejszą energię niezbędną do oderwania jednego elektronu od atomu i odsunięcia go na nieskończoną odległość.
4. Co to są metale przejściowe:
Metale przejściowe to grupa pierwiastków chemicznych występujących w tzw. bloku d (grupy poboczne) układu okresowego pierwiastków. Pierwiastków tych jest 31.
Nazwa tej grupy pochodzi od tego, że posiadają one pośrednie własności między metalami alkalicznymi a metalami grup głównych. Metale przejściowe posiadają najróżniejsze własności chemiczne. Niektóre (itr, cyrkon) posiadają własności zbliżone do metali alkalicznych i są bardzo reaktywne, zapalając się nawet na powietrzu. Z kolei na drugim końcu skali reaktywności są metale szlachetne, takie jak złoto czy platyna, które nie reagują nawet z bardzo mocnymi kwasami i zasadami. Wspólną cechą prawie wszystkich tych pierwiastków jest zdolność do tworzenia złożonych kompleksów, z których bardzo wiele wykazuje intensywne zabarwienie. Również wiele prostych soli organicznych tych związków wykazuje silne zabarwienie.
5. Co to są elektrony walencyjne:
Elektrony walencyjne to te elektrony, które podczas reakcji chemicznej biorą udział w tworzeniu wiązań chemicznych. Mają najwyższe energie i są słabo związane z atomem. Mają wpływ na właściwości chemiczne pierwiastka.
6. Co to są pierwiastki elektrododatnie i elektroujemne:
Pierwiastki, których atomy w reakcjach chemicznych przyłączają elektrony, przyjmując w związkach ujemne stopnie utlenienia lub tworzą jony ujemne nazywamy elektroujemnymi. Pierwiastki, których atomy w reakcjach chemicznych "tracą" elektrony lub tworzą jony dodatnie, nazywamy elektrododatnimi.
7. Wiązania międzyatomowe:
Pierwiastki mogą występować w trzech stanach skupienia : * gazowym *ciekłym * stałym. Stan skupienia zależy od odległości pomiędzy poszczególnymi atomami. W gazach są to duże odległości, a w cieczach i ciałach stałych są one bardzo małe. Dlatego stan ciekły i stały nazywamy stanami skondensowanymi. Stan skupienia zależy także od temperatury i ciśnienia.
8. Wiązania jonowe:
Wiązanie jonowe to rodzaj wiązania chemicznego. Istotą tego wiązania, jest utworzenie pary jonowej na skutek przeskoku jednego lub więcej elektronów z jednego atomu na drugi. Powstałe w ten sposób różnoimienne jony są z sobą związane zwykłym oddziaływaniem elektrostatycznym.
Wiązania jonowe powstają między atomami o bardzo dużej różnicy elektroujemności, co oznacza w praktyce, że występują one tylko między atomami metali i wodoru a atomami pierwiastków niemetalicznych.
Związki posiadające wiązania jonowe są zdolne do dysocjacji elektrolitycznej, t.j. do rozpadu na wolne jony pod wpływem działania rozpuszczalników polarnych, lub na skutek silnego ogrzewania. Stopy i roztwory związków chemicznych posiadających wiązania jonowe są elektrolitami tzn. są zdolne do przewodzenia prądu elektrycznego.
9. Wiązania atomowe:
wiązania atomowe (kowalencyjne) powstają przez nałożenie się orbitali walencyjnych dwóch atomów. Siłą wiążącą jest wspólnota łączącej pary elektronowej, np. H—H; Cl—Cl. O "czystym" wiązaniu atomowym praktycznie można mówić tylko w przypadku wiązania między atomami tego samego pierwiastka.
10. Wiązania metaliczne:
Wiązania metaliczne - atomy w stanie metalicznym oddają część e- walencyjnych stając się rdzeniami atomu. Tworzy się tzw gaz elektronowy gdzie e- poruszają się w sposób bezwładny, analogicznie do cząstek gazu doskonałego. Istotą wiązań metalicznych są elektrostatyczne siły przyciągające miedzy + ładunkiem rdzenia atomowego a - ładunkiem elektronem swobodnym. Jest to wiązanie bezkierunkowe. Np.: pierwiastki elektrododatnie, stopy metali.
11. Siły van Der Waalsa:
Siły van der Waalsa są wynikiem wzajemnego oddziaływania elektronów i jąder w czasteczkach. A konkretnie polegają one na przyciąganiu się szybkozmiennych albo inaczej falujących dipoli.
W wyniku ruchu elektronów walencyjnych gęstość ładunku ujemnego na zewnętrznej powłoce atomów ulega szybkim fluktuacjom wzbudzając podobną fluktuację w powłoce walencyjnej sąsiednich atomów. Powstają szybkozmienne dipole, które wzajemnie przyciągają się zwiększając, w miarę zbliżania się, wzajemną polaryzację elektronową.
Siły dyspersyjne działają jedynie wtedy, gdy cząsteczki znajdują się bardzo blisko siebie, tak że prawie się stykają.
12.Budowa krystaliczna, a własności metali:
Wytrzymałość mechaniczna ciał stałych jest efektem działania między atomami sił spójności, które zależą głównie od charakteru wiązania, ale także od innych czynników jak typ sieci, kierunek działania sił wzlędem osi krystalograficznych, obecność defektów sieci, temperatura, warunki odkształcenia i inne
13. Elementarne komórki sieci A1, A2, A3 i tetragonalne:
Komórka A1 jako ściennie centrowana jest sześcianem, w którym atomy są rozmieszczone na narożach i na środkach ścian Komórka A2 jako przestrzennie centrowana jest sześcianem, w którym atomy są rozmieszczone na narożach i w środku sześcianu. Komórka elementarna układu heksagonalnego A3 jest graniastosłupem o podstawie rombu z kątami 60° i 120°. Atomy są rozmieszczone na narożach i w połowie wysokości komórki. Na jedną komórkę przypada 2 atomy. Trzy komórki elementarne tworzą komórkę sieciową o symetrii sześciokrotnej
1.Co to jest anizotropia i izotropia:
anizotropia fiz. występowanie różnych własności fiz. danego ośrodka (gł. ciał krystalicznych) w różnych kierunkach (np. inna wytrzymałość drewna na rozerwanie wzdłuż, a inna w poprzek włókna);
izotropia fiz. charakterystyczna cecha ośrodka (gł. ciał niekrystalicznych) polegająca na wykazywaniu jednakowych własności fiz. we wszystkich kierunkach;
2. Defekty punktowe sieci krystalicznej:
Defektem punktowym nazywamy zakłócenia budowy krystalicznej, która umiejscowiona jest wokół punktu. Najczęstszym defektem tego typu jest brak atomu w węźle sieci (naz. Wakanse, luka). Powstają one na skutek drgań cieplnych sieci, które są tym większe im wyższa temperatura.
3. Dyslokacja krawędziowa:
Dyslokacja krawędziowa - stanowi krawędź ekstrapłaszczyzny, tj. półpłaszczyzny sieciowej umieszczonej między nieco rozsuniętymi płaszczyznami sieciowymi kryształu o budowie prawidłowej. Dyslokacje krawędziowe leżące w płaszczyznach najgęściej obsadzonych atomami będących płaszczyznami poślizgu, przemieszczają się pod działaniem naprężenia stycznego. Powstanie dyslokacji krawędziowej można sobie wyobrazić zakładając pewną ściśliwość kryształu, dzięki której przemieszczenie górnej części kryształu, wynoszące na brzegowej jeden odstęp międzyatomowy, w miarę oddalania się od tej płaszczyzny będzie malało, aż wreszcie zanika. Poślizg zachodzi zatem nie na całej płaszczyźnie łatwego poślizgu, ale tylko na jej części (poślizg niejednorodny). Dyslokacja krawędziowa już pod działaniem niewielkich naprężeń łatwo zmienia swoje położenie, a po wyjściu z kryształu tworzy na przeciwległej powierzchni stopień. W zależności od położenia dodatkowej półpłaszczyzny dyslokacje mogą być dodatnie (⊥) lub ujemne (T). Dodatnie jeśli półpłaszczyzna znajduje się nad płaszczyzną poślizgu, ujemne - odwrotnie. Wielkością charakterystyczną dla dyslokacji jest wielkość zaburzenia sieci krystalicznej jakie ona wywołuje, a dokładniej energia związana z tym zaburzeniem. Jako miarę tego zaburzenia przyjęto wektor Burgersa. Wyznacza się go za pomocą tzw. konturu Burgersa (obiegu składającego się z jednakowej liczby odstępów sieciowych w każdym kierunku). Jego długość określa wielkość zaburzenia w dyslokacji krawędziowej. Jest prostopadły do linii dyslokacji, a jego zwrot jest zgodny z kierunkiem. W czasie ruchu dyslokacje krawędziowe mogą na swojej drodze napotkać inne defekty sieciowe
4. Dyslokacja śrubowa:
Dyslokacja śrubowa-defekt liniowy struktury krystalicznej spowodowany przemieszczeniem części kryształu wokół osi, zwanej linią dyslokacji śrubowej. Wektor Burgersa dyslokacji śrubowej jest skierowany równolegle do jej lini. Dyslokacje śrubowe występują wtedy, gdy na materiał działają naprężenia tnące skierowane przeciwnie. Pod działaniem tych naprężeń dyslokacje śrubowe przemieszczają się. Dyslokacja krawędziowa przemieszcza się w kierunku działania naprężenia, natomiast linia dyslokacji śrubowej przemieszcza się w głąb kryształu, prostopadle do kierunku działania naprężenia stycznego. Dyslokacje śrubowe mogą być prawo- lub lewoskrętne.
5.Budowa granic ziarn:
granice ziarn - powierzchnie oddzielające dwa ziarna różniące się orientacją głównych osi krystalograficznych (w metalach), w stopach technicznych także składem chemicznym. Granice wąskokątowe (kąt dezorientacji: 6-10°) charakteryzują się budową dyslokacyjną. Płaszczyzny atomowe w pobliżu styku kończą się w taki sposób, jak w dyslokacjach krawędziowych. Taką nachyloną granicę wąskokątową można uważać zatem za zbiór równoległych dyslokacji krawędziowych ułożonych jedna nad drugą. Odległość D między liniami sąsiednich dyslokacji zależy od kąta dezorientacji i można ją wyznaczyć uwzględniając łuk wyznaczony przez kąt skręcania θ na okręgu o promieniu D. Gdy odstęp między atomami na kierunku prostopadłym do granicy, równy wektorowi Burgersa jest dużo mniejszy niż D, wówczas wektor![]()
jest bardzo bliski długości omawianego łuku. Można więc napisać ![]()
, a stąd: D = b/θ. Kąt dezorientacji może być również kątem o jaki obrócono względem siebie przyległe ziarna. Jeśli kąt ten jest niewielki, to granica taka stanowi ścianę przecinających się podobnie jak w sieci rybackiej linii dyslokacji śrubowych. Granica taka nazywana jest granicą skręconą. Granice szerokokątowe - charakteryzują się dużym kątem (>10°) dezorientacji krystalicznej ziarn, na styku których powstają. Budowa tych granic jest b. złożona i nie w pełni zbadana. Sądzi się, że na granicach ziarn powstaje strefa miejsc koincydentnych, tj. jednoczesnych, tworzących supersieć przestrzenną, nakładającą się na sieć przestrzenną sąsiadujących ze sobą ziarn. Parametr supersieci miejsc koincydentnych jest wielokrotnością parametru sieci ziarn. W strefie granicy ułożenie atomów charakterystyczne dla wnętrza ziarn jest zaburzone. Granica szerokokątowa nie jest przy tym płaska, lecz zawiera liczne dyslokacje oraz protuzje, tj. wybrzuszenia i występy. Szczególnym przypadkiem granic szerokątowych są granice bliźniacze. Tworzą się one przy ściśle określonej orientacji ziarn, gdy płaszczyzna granicy staje się płaszczyzną symetrii. Na granicy takiej zachodzi zatem pełne dopasowanie (koherencja) sieci obu ziarn. Niemal zupełny brak zaburzeń w prawidłowym rozmieszczeniu atomów sprawia, że energia takiej granicy jest małą i wynosi 3-10% energii granic szerokokątowych. Gdy granica bliźniacza odchyli się o mały kąt od płaszczyzny idealnego dopasowania, wtedy dzieli się ona na strefy, w których dopasowanie jest dobre i strefy w których dopasowanie uzyskuje się kosztem niewielkich odkształceń sprężystych (przesunięć atomów poza położenia równowagi) lub okresowo powtarzających się dyslokacji. Pociąga to za sobą zwiększenie się energii takiej granicy, a gdy kąt odchylenia wzrasta, prowadzi to do osiągnięcia takich wartości energii, jaką wykazują granice szerokokątowe.
6. Struktura mozaikowa:
W materiałach polikrystalicznych może też występować t.zw struktura mozaikowa (poligonalna lub podziarnowa). Struktura taka składa się z bardzo małych obszarów krystalicznych oddzielonych od siebie granicami ziarn małego kąta Strukturę ziarnistą można ujawnić za pomocą badań metalograficznych wykorzystując efekt trawienia granic ziarn lub granic poligonów (do wytawiania tych granic trzeba stosować specjalne odczynniki, trawiące selektywnie nawet pojedyncze dyslokacje). Można również wykorzystać metodę badania przełomów czyli fraktografię.
7. Liczba defektów a wytrzymałość:
Wpływ defektów sieci na własności kryształów jest bardzo istotny - często znacznie większy niż wpływ typu sieci krystalicznej. Tak np. wakancje ułatwiają dyfuzję atomów a wiadomo, że dyfuzja jest podstawą prawie wszystkich procesów i przemian zachodzących w materiałach. Z kolei defekty liniowe (dyslokacje) ułatwiają odkształcanie metali i bez nich przeróbka plastyczna byłaby niemożliwa. Bardzo ważne są także granice ziarn jako defekty powierzchniowe , które są czynnikiem umacniającym materiał, ale w pewnych przypadkach mogą odgrywać negatywną rolę. Dlatego znajomość defektów i ich roli w różnych procesach jest bardzo ważna w nowoczesnym materiałoznawstwie.
8. Wpływ ilości dyslokacji na własności metalu:
Z jednej strony defekty sieci krystalicznej osłabiają kryształ, z drugiej jednak wiadomo, że wytrzymałość pojedynczych kryształów jest mocniejsza niż materiałów polikrystalicznych, ponieważ zaburzenia budowy sieciowej na granicach ziaren umacniają metal. Wiadomo że kryształy zawierające dużą liczbę defektów są bardziej wytrzymałe od kryształów z małą liczbą defektów. Dzieje się tak dlatego, że w przypadku dużej liczby defektów sieciowych ruchy dyslokacji jest hamowany na skutek wzajemnego przecinania się dyslokacji, ich grupowanie się, a także obecność obcych atomów, wynika z tego, że wytrzymałość rzeczywista metali zmniejsza się wraz ze zwiększaniem liczby defektów tylko do pewnej granicy po osiągnięciu tzw. krystalicznej gęstości dyslokacji (defektów), wytrzymałość zaczyna ponownie wzrastać. Wynika z tego, że warunkiem podwyższenia wytrzymałości metalu jest o całkowite usunięcie z niego wszystkich nieprawidłowości budowy krystalicznej albo zwiększenie oporu ruchu dyslokacji po przez wytworzenie w nim odpowiedniej liczby defektów.
9. Stopień przechłodzenia ciekłego metalu:
Z początku temperatura się obniża a następnie, w określonej i charakterystycznej dla danego metalu temperaturze, jest stała i następuje proces krzepnięcia metalu. Po czym znowu temperatura ponownie się obniża i następuje stygnięcie metalu.
10. Zarodkowanie homogeniczne i heterogoniczne:
W przypadku zarodkowania homogenicznego, zarodkami krystalizacji są grupy atomów fazy
ciekłej, stanowiące zespoły bliskiego uporządkowania. Muszą one osiągnąć wielkość krytyczną,
co na ogół wymaga dużych przechłodzeń. W ciekłych metalach na ogół występują zbyt małe
przechłodzenia (ok. 1°C), aby możliwe było zarodkowanie homogeniczne.
W przypadku zarodkowania heterogenicznego, powstawanie zarodków następuje na
powierzchniach fazy stałej stykającej się z cieczą. Zarodkowanie następuje na powierzchniach
ścian naczynia, na drobnych cząstkach stałych zawieszonych w cieczy, jak wtrącenia
niemetaliczne, nierozpuszczone zanieczyszczenia itp. Zarodkowanie może następować również
na warstewce stałych tlenków znajdującej się na powierzchni ciekłego metalu. W takich
warunkach krystalizacja przebiega przy znacznie mniejszym przechłodzeniu niż w przypadku
zarodkowania homogenicznego.
11. Co to są dendryty:
Kryształ o rozgałęźnej budowie choinkowej. Kryształy dendrytowe powstają podczas szybkiej krystalizacji z roztworów silnie przesyconych lub stopów.
12. Struktura wlewka stalowego:
Krystalizacja wlewka. Proces krystalizacji przebiegający w warunkach rzeczywistych staje
się bardziej złożony wskutek wpływu różnych czynników ubocznych. Na przykład przy
odlewaniu dużych wlewków stalowych do wlewnicy kryształy rosną najszybciej w kierunku
prostopadłym do jej ścianek, tj. w kierunku najintensywniejszego doprowadzenia ciepła.
Schemat struktury takiego wlewka jest przedstawiony na rys. 2.29. Rozróżnić w nim można trzy
główne strefy: strefę kryształów zamrożonych, strefę kryształów słupkowych i strefę kryształów
równoosiowych.
Kryształy zamrożone powstają na skutek nagłego zetknięcia się ciekłego metalu ze
ściankami wlewnicy, co powoduje raptowny spadek temperatury, znaczne przechłodzenie i
powstanie dużej liczby zarodków. W rezultacie strefa ta ma strukturę drobnoziarnistą.
W trzeciej strefie tworzą się kryształy równoosiowe, gdyż w środkowej części wlewka nie
zaznacza się już określony kierunek odpływu ciepła, a temperatura krzepnącego metalu niemal
całkowicie się wyrównuje.
Wzajemne rozmieszczenie wymienionych trzech stref w objętości wlewka ma duże znaczenie
praktyczne, gdyż wzdłuż miejsc styku np. stref kryształów słupkowych mogą często powstawać
pęknięcia podczas walcowania wlewka.
13. Jakie skutki powoduje odkształcenie plastyczne metalu:
Odkształcenie plastyczne metalu, które powstaje podczas deformacji na zimno, powoduje
znaczną zmianę jego własności fizycznych i mechanicznych. Zmiany te objawiają się przede
wszystkim wzrostem twardości i wytrzymałości przy jednoczesnym spadku własności
plastycznych , oraz obniżeniem przewodności elektrycznej i gęstości. Wzrost twardości i wytrzymałości związany z odkształceniem plastycznym ma duże znaczenie i
w pewnych przypadkach jest wykorzystywany w celu umocnienia materiału.
14. przywrócenie właściwości sprzed odkształcenia plastycznego:
Często jednak zachodzi konieczność przywrócenia materiałom ich własności, jakie miały przed
odkształceniem plastycznym np. w celu obniżenia twardości lub uzyskania odpowiednich
własności fizycznych, takich jak np. dobra przewodność elektryczna (jest to bardzo istotne np. w
procesie ciągnienia drutów miedzianych przeznaczonych na przewody elektryczne). Obniżenie
twardości i zwiększenie plastyczności odkształconego metalu oraz przywrócenie innych
własności "fizycznych można uzyskać przez wyżarzanie, które polega na wytrzymaniu
odkształconego materiału przez pewien okres czasu w podwyższonej temperaturze, zwykle
powyżej jednej trzeciej bezwzględnej temperatury topnienia
15. Procesy zachodzące podczas zdrowienia metalu:
W czasie usuwania skutków odkształcenia plastycznego przez wyżarzanie można wyróżnić
trzy procesy, które kolejno zachodzą w odkształconym plastycznie metalu:
• zdrowienie,
• rekrystalizacja
• rozrost ziarna
Proces zdrowienia związany jest ze zmianą rozmieszczenia i gęstości defektów sieci
krystalicznej, głównie wakansów i dyslokacji. W odkształconym na zimno metalu istnieje gęsta
sieć dyslokacji, która powstała w wyniku poślizgów i wzajemnego oddziaływania dyslokacji. W
czasie zdrowienia następuje przemieszczanie i zmiana uporządkowania dyslokacji, co powoduje
zmniejszenie energii zmagazynowanej w odkształcanej sieci. Proces ten jest aktywowany
cieplnie.
16. Na czym polega rekrystalizacja metalu:
Jeśli odkształcony na zimno metal będzie poddawany dalszemu wygrzewaniu, to w pewnej
określonej temperaturze, wyższej od temperatury zdrowienia, zaczną powstawać zarodki nowych
nieodkształconych ziarn metalu. Nowe ziarna rozrastają się kosztem ziarn odkształconych i po
pewnym czasie wszystkie stare ziarna zostają zastąpione przez nowe.
17. Wyznaczanie temp. rekrystalizacji:
Porównując temperaturę rekrystalizacji z temperaturą topnienia dla różnych metali można
stwierdzić, że zachodzi pomiędzy nimi prosta proporcjonalność. Dla metali technicznie czystych
w przypadku dużych odkształceń plastycznych występuje zależność
Tr = 0,3 ÷ 0,4 Ttop
gdzie: Tr — temperatura rekrystalizacji,
Ttop — bezwzględna temperatura topnienia.
Temperatura rekrystalizacji dla stopów jest wyższa niż dla metali technicznie czystych i w
niektórych przypadkach dochodzi do 0,8 Ttop.. Natomiast dla metali o wysokiej czystości
temperatura rekrystalizacji jest bardzo niska i wynosi 0,1 ÷ 0,2 Ttop . Wartości te są słuszne w
przypadku dużych stopni odkształcenia plastycznego, natomiast dla małych odkształceń
plastycznych mogą być znacznie wyższe.
18. Od czego zależy wielkość ziarna po rekrystalizacji:
Wielkość ziarna powstałego po rekrystalizacji zależy
przede wszystkim od następujących czynników:
• uprzedniego stopnia odkształcenia plastycznego na zimno,
• temperatury wyżarzania,
• czasu wyżarzania.
19. Krytyczne odkształcenie plastyczne:
Dla każdego metalu istnieje w zakresie stosunkowo małych odkształceń plastycznych pewien
charakterystyczny stopień tego odkształcenia, zwany krytycznym odkształceniem plastycznym -
qkr, który powoduje w czasie rekrystalizacji w wysokiej temperaturze wyjątkowo silny rozrost
ziarna.
Krytyczne odkształcenie plastyczne dla większości metali waha się w granicach od ok. l do 10%.
W wielu przemysłowych procesach technologicznych polegających np. na walcowaniu na
zimno i wyżarzaniu międzyoperacyjnym, występowanie krytycznego odkształcenia plastycznego
jest zjawiskiem niepożądanym, gdyż daje materiał o strukturze gruboziarnistej o odpowiednich
własnościach mechanicznych oraz skłonny do pęknięć.
Istotnym czynnikiem wpływającym na wielkość ziarna po rekrystalizacji jest również
20. dlaczego podczas nagrzewania następuje rozrost ziarna:
Wyżarzanie metalu w wysokich temperaturach (już po zakończeniu procesu rekrystalizacji)
powoduje, jak już wspomniano, rozrost ziarna Głównym czynnikiem rządzącym tym procesem
jest napięcie powierzchniowe występujące na granicach ziarn, związane z wyższą energią
swobodną atomów znajdujących się na powierzchni ziarn w porównaniu z energią atomów
znajdujących się wewnątrz nich. W konsekwencji w materiale polikrystalicznym będzie
występowała tendencja do zmniejszenia powierzchni ziarn, a więc do ich rozrostu, gdyż
związane to jest z obniżeniem energii swobodnej materiału. Proces rozrostu ziarna odbywa się
przez pochłanianie małych ziarn przez większe.
21. techniczne znaczenie rekrystalizacji:
Wyżarzanie rekrystalizujące jest szeroko stosowane przy wytwarzaniu takich półwyrobów,
jak: blachy, rury, pręty, druty, kształtowniki itp., które są poddawane obróbce plastycznej na
zimno. Ponieważ odkształcenie plastyczne umacnia metal, nie można w jednej operacji nadać
wyrobom ostatecznego kształtu lub wymiarów. Metal umocniony na skutek odkształcenia
plastycznego tak dalece traci własności plastyczne, że nie odkształca się dalej, lecz pęka.
Dlatego konieczne jest międzyoperacyjne wyżarzanie rekrystalizujące, które zmiękcza i
uplastycznia metal. Jeżeli odkształcenie plastyczne metalu przeprowadza się w temperaturze
wyższej od temperatury rekrystalizacji, to proces taki nosi nazwę obróbki plastycznej na gorąco.
W czasie takiej obróbki zachodzą jednocześnie dwa procesy: odkształcenie plastyczne i
rekrystalizacja. W rezultacie nie następuje umocnienie metalu, który miał strukturę
zrekrystalizowaną.
1. Fazy występujące w stopach metali:
Eazy międzymetaliczne; fazy elektronowe β, γ, ε; fazy Lavesa (ABz); fazy międzywęzłowei o strukturach złożonych; Fazy δ
2. Roztwór stały międzywęzłowy i różnowęzłowy:
roztwór stały międzywęzłowy, gdzie jeden pierwiastek również rozpuszczony jest w drugim. Tu atomy drugiego pierwiastka ulokowane są nie w tych miejscach, gdzie powinny znajdować się atomy pierwszego pierwiastka (czyli w węzłach sieci krystalicznej), lecz pomiędzy tymi atomami (czyli między węzłami). Roztwór stały różnowęzłowy. Zachowany jest charakter sieci. Węzły sieci są obsadzone różnymi atomami. Atomy dodatku stopowego zajmują przypadkowe pozycje
3. Roztwór stały ciągły i ograniczony:
Niektóre pierwiastki tworzą ze sobą roztwory stałe nieograniczone, tzn. rozpuszczają się w
sobie całkowicie niezależnie od składu stopu, inne rozpuszczają się w stanie stałym tylko
częściowo (np. roztwory międzywęzłowe są z reguły ograniczone). W pierwszym przypadku
stopy mają strukturę jednofazową w całym zakresie składów chemicznych, a maksymalny
36 JW
wpływ umacniający pierwiastka stopowego występuje przy zawartości około 50%. W
roztworach stałych zostaje zachowana sieć krystaliczna metalu rozpuszczającego.
Roztwory stałe nieograniczone mogą tworzyć ze sobą tylko te pierwiastki, które mają
jednakowy typ sieci krystalicznej, zbliżone wielkości średnic atomowych (różniące się nie
więcej jak o 10-15%), jednakową wartościowość i są do siebie podobne pod względem
charakteru elektrochemicznego.
Istotny wpływ na własności roztworu stałego wywierają pierwiastki różniące się rodzajem
przestrzennej sieci krystalicznej i średnicą atomową od metalu podstawowego. Jak już
wspomniano, takie pierwiastki mogą tworzyć jedynie roztwory ograniczone, wobec czego w
zależności od składu chemicznego stop może być jednofazowy (jeśli zawartość w nim składnika
stopowego nie przekracza granicznej rozpuszczalności w temperaturze otoczenia) lub
dwufazowy, złożony z mieszaniny kryształów roztworu stałego granicznego składnika B w A i
kryształów roztworu stałego granicznego składnika A w B.
4 Fazy międzymetaliczne:
Składniki stopu w
stanie stałym mogą jednak tworzyć też tzw. fazę międzymetaliczną, charakteryzującą się
odmienną siecią krystaliczną niż sieci krystaliczne jej składników. Z reguły sieć krystaliczna fazy międzymetalicznej jest bardzo skomplikowana, co powoduje
jej dużą twardość i kruchość.
Ogólnie fazę międzymetaliczną określa się symbolem AnBm, co oznacza, że składa się ona z n
atomów składnika A i m atomów składnika B. W rzeczywistości tylko niektóre fazy
międzymetaliczne mają stały stosunek składników, większość ich istnieje w szerszym zakresie
stężeń, tzn. występuje również przy nadmiarze jednego ze składników.
5. Główne grupy faz międzymetalicznych:
fazy Lavesa (ABz); fazy międzywęzłowei o strukturach złożonych; Fazy δ
6. Co to jest analiza termiczna:
Analizą termiczną nazywa się badania polegające na określeniu temperatury początku i końca
krzepnięcia (lub topnienia) oraz temperatury przemian zachodzących w stanie stałym podczas
ochładzania (lub ogrzewania) metali i ich stopów. Badania te mają na celu wykreślenie
krzywych przebiegu ogrzewania lub chłodzenia, na których wszelkie efekty cieplne występujące
podczas zmian fazowych uwidaczniają się w postaci przystanków temperaturowych i załamań. te
z kolei służą do zbudowania tzw. wykresów równowagi układów pierwiastków przedstawiających
położenie granic faz w funkcji temperatury i składu chemicznego.
7. Co to faza, a co to składnik układu:
Faza jest to jednorodna część układu oddzielona od innych jego części (faz) powierzchnią
rozdziału, czyli granicą fazy, po przekroczeniu której własności fizyczne czy też struktura
zmieniają się w sposób nieciągły.
Składnikami układu nazywa się substancje tworzące dany układ. Dla przykładu czysty metal
tworzy układ jednoskładnikowy, stop dwóch metali — układ dwuskładnikowy itd. Fazy
międzymetaliczne uważa się także za składniki, jeśli w rozpatrywanym zakresie temperatury nie
rozkładają się na pierwiastki składowe.
8. Reguła faz:
Przy założeniu, że w rozpatrywanym układzie wszystkie przemiany zachodzą przy stałym i
niezmiennym ciśnieniu, reguła faz wyraża się wzorem
s = m - f + l
gdzie: s - liczba stopni swobody,
m - liczba składników,
f - liczba faz.
Dla rzeczywistych układów wielofazowych liczba stopni swobody wynosi zwykle 0, l lub 2.
Gdy S = 0, układ jest niezmienny, czyli nie można zmieniać ani temperatury, ani składu
chemicznego bez spowodowania zmiany liczby faz w układzie.
Gdy S = l, układ jest jednozmienny. Oznacza to, że nie zmieniając liczby faz w układzie
można zmienić (w pewnych granicach) temperaturę bądź skład chemiczny.
Gdy S = 2, układ jest dwuzmienny. Oznacza to, że nie zmieniając liczby faz w układzie
można zmienić (w pewnych granicach) temperaturę i skład chemiczny.
9.Wykrez z brakiem rozpuszczalności wzajemnej w stanie stałym:
Na rysunku 3.5 przedstawiono wykres równowagi typu I, odpowiadający całkowitej
wzajemnej rozpuszczalności składników w stanie ciekłym i jej brakowi w stanie stałym.
Składniki nie tworzą również związków chemicznych. Linia AEB jest linią likwidusu, a linia
DEC linią solidusu. Na linii AE przy chłodzeniu zaczynają się wydzielać z cieczy kryształy
metalu A, na linii EB — kryształy metalu B. Na linii DEC z cieczy o składzie E wydzielają się
jednocześnie bardzo drobne krysztale A i B tworzące mieszaninę, która nazywa się eutektyką
(po grecku łatwo topliwa) a stop o tym składzie - stopem eutektycznym (stopy o składzie
odpowiadającym zakresowi DE są stopami podeutektycznymi, pozostałe - nadeutektycznymi).
10. Wykres równowagi odpowiadający całkowitej rozpuszczalności wzajemnej
składników w stanie ciekłym i ograniczonej rozpuszczalności w stanie stałym
(z eutektyką):
nie występują fazy będące czystymi składnikami, w sąsiedztwie
linii A i B, odpowiadających czystym składnikom, znajdują się obszary roztworów stałych
granicznych α (składnika B w składniku A) i β (składnika A w składniku B), przy czym
graniczną rozpuszczalność z lewej strony określa linia DF, z prawej — linia CG.
Między tymi liniami znajdują się stopy leżące poza granicami rozpuszczalności i stanowiące
mieszaninę dwóch roztworów stałych granicznych α + β. Jak widać na wykresie, graniczna
rozpuszczalność składnika B w składniku A stała, lecz zmienia się wraz z temperaturą (linia
DF), co prowadzi do wtórnej krystalizacji i wydzielania się z roztworu stałego α kryształów β .
Kryształy te noszą nazwę kryształów wtórnych i dla odróżnienia od pierwotnych kryształów β
oznaczane są zwykle symbolem β". Kryształów wtórnych nie zawierają jedynie stopy o stężeniu
składnika B mniejszym od stężenia odpowiadającego punktowi F.
W przeciwieństwie do tego, graniczna rozpuszczalność składnika A w składniku B nie zależy
od temperatury (linia CG jest linią pionową), toteż wydzielanie się wtórnych kryształów α w
tym przypadku nie zachodzi.
11. Wykres równowagi odpowiadający całkowitej rozpuszczalności wzajemnej
składników w stanie ciekłym i ograniczonej rozpuszczalności w stanie stałym
(z perytektyką):
na wykresie poniżej linii solidusu ADPB można wyodrębnić trzy obszary
(dla uproszczenia linie granicznych rozpuszczalności są na rysunku pionowe): α, α + β i β.
Stopy o stężeniu składnika B mniejszym od stężenia odpowiadającego punktowi F, po
skrzepnięciu składają się z jednorodnych ziarn roztworu stałego α, które podczas dalszego
chłodzenia nie podlegają żadnym przemianom.
Stopy o stężeniu składnika B odpowiadającym stężeniom zawartym między punktem F i
punktem G zaczynają krzepnąć w temperaturze określonej likwidusem, tak że w temperaturze tp
składają się z kryształów α o składzie punktu D i cieczy o składzie punktu C. W tej temperaturze
następuje przemiana perytektyczna, którą ogólnie można przedstawić:
ciecz + α →β
12. Wykres równowagi odpowiadający całkowitej rozpuszczalności wzajemnej składników
zarówno w stanie ciekłym, jak i w stanie stałym:
W tym przypadku eutektyka nie występuje, a wszystkie stopy w stanie stałym: mają jednakową
strukturę złożoną z kryształów roztworu stałego α o składzie odpowiadającym składowi stopu.
13. Wykres równowagi z fazą międzymetaliczną krystalizującą z fazy ciekłej:
Wykres równowagi typu IV (rys. 3.9a) tworzą dwa składniki, które w stanie ciekłym
rozpuszczają się wzajemnie bez ograniczenia, natomiast w stanie stałym bądź nie rozpuszczają
się w sobie, bądź tworzą roztwory graniczne, a ponadto tworzą trwałą fazę międzymetaliczną
AnBm. Taka faza dzieli wykres na dwie nienależne części tak, że w rzeczywistości występują tu
jakby dwa odrębne układy równowagi: metalu A i fazy międzymetalicznej oraz fazy
międzymetalicznej i metalu B, a każdy z tych układów może należeć do jednego z poprzednio
omówionych typów.
Niektóre fazy międzymetaliczne mogą rozpuszczać w stanie stałym składnik A lub B
względnie oba składniki, tworząc omówione już roztwory stałe wtórne. Wykres równowagi
odpowiadający temu przypadkowi podano na rys. 3.9b.
14. Wykres równowagi z fazą międzymetaliczną w postaci wtórnego roztworu
stałego γ, powstającą w wyniku reakcji perytektycznej:
Jeśli faza międzymetaliczna krystalizuje poniżej temperatury początku krzepnięcia stopu, to
powstaje ona zwykle w wyniku reakcji perytektycznej. Wykres równowagi typu V
odpowiadający temu przypadkowi, może mieć różną postać w zależności od wzajemnego oddziaływania składników stopu.
15. Wykres równowagi z fazą międzymetaliczną krystalizującą z fazy stałej:
Jak widać, dla pewnego zakresu składów (od x1 do x2) przy obniżaniu temperatury
zachodzi przemiana roztworu stałego α w fazę międzymetaliczną σ, będącą roztworem stałym
wtórnym obu składników A i B w fazie międzymetalicznej AnBm. W stopie o składzie AnBm
przemiana ta zachodzi w stałej temperaturze t1, w pozostałych stopach podlegających przemianie
— w pewnym zakresie temperatury
16. Wykres równowagi z przemianą
alotrotropową jednego lub obu składników:
1
2
Przyjmując, że składnik A ma dwie odmiany alotropowe Aα i Aβ, a składnik B odmian
alotropowych nie ma oraz że odmiana Aα (istniejąca w niższych temperaturach) i składnik B są
izomorficzne, czyli mogą tworzyć roztwór stały ciągły, otrzymuje się wykres równowagi
przedstawiony na rys.1. Jak widać, wszystkie stopy niezależnie od ich składu chemicznego w
temperaturze otoczenia mają budowę jednofazową α. Różnią się jedynie sposobem powstania tej
fazy, a mianowicie: stopy o składzie od A do x1 krzepną jako stopy β, a faza α powstaje w
wynika przemiany alotropowej w stanie stałym; w stopach o składzie od x1 do x2 faza α
powstaje w wyniku reakcji perytektycznej; w stopach o składzie od x2, do B faza α powstaje
bezpośrednio z fazy ciekłej.
Przyjmując, że składnik A ma dwie odmiany alotropowe Aα i Aβ, a składnik B dwie
odmiany alotropowe Bα i Bβ oraz że odmiany Aα i Bα oraz odmiany Aβ i Bβ. są izomorficzne,
otrzymuje się wykres równowagi przedstawiony na rys. 2. Jak widać, wszystkie stopy po
skrzepnięciu mają strukturę B, wszystkie też podlegają w niższych temperaturach przemianie
alotropowej β w α.
1. reguła dźwigni:
W procesie krystalizacji zarówno pierwotnej, jak i wtórnej (w stanie stałym zmienia się nie
tylko skład poszczególnych faz, ale i ilość każdej fazy. W dowolnym punkcie wykresu
równowagi można w obszarze jednoczesnego występowania) dwóch faz określić ich ilość oraz
ich skład chemiczny. Wykorzystuje się do tego celu tzw. regułę dźwigni.
Przykład zastosowania reguły dźwigni podano na rys. 3.19. Jak widać, aby określić skład
chemiczny współistniejących faz w danej temperaturze ty, należy dla tej temperatury
przeprowadzić linię równoległą do osi składów. Rzuty punktów przecięcia tej linii z krzywymi
ograniczającymi obszar dwufazowy na oś składów, określają skład faz. Na rysunku przez x
oznaczono skład stopu, przez x1 — skład fazy stałej α, a przez x2- skład fazy ciekłej.
Ilościowy stosunek faz określa się za pomocą wzorów:
![]()
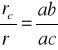
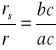
gdzie: rc — ilość fazy ciekłej,
rs - ilość fazy stałej,
r = rc + rs — ogólna ilość stopu,
ab, bc i ac — odcinki wyznaczone przez linię ty oraz likwidus i solidus
Wyszukiwarka