Czworościan spalania - trójkąt spalania + rozgałęzione reakcje łańcuchowe (układ palny).
PALIWO+CIEPŁO+UTLENIACZ+ROZGAŁĘZIONE REAKCJE ŁAŃCUCHOWE
Pożar - efekt cieplny różnych przemian chemicznych i zjawisk fizycznych w określonym układzie termodynamicznym (w ściśle określonym obiekcie np.: objętość gazu wewnątrz zamkniętej przestrzeni) powodujący zmianę stanu równowagi termodynamicznej tego układu.
Pożar przebiega w dużej skali, jego siła nie zależy od reakcji chemicznych ale od wielkości nagrzania się gazów spalinowych tworzących się w środowisku pożarowym. Cała moc pożaru tzn. szybkość jego rozprzestrzeniania zależy od zdolności do rozproszenia (dyssypacji) gazów spalinowych w środowisku pożarowym.
Pożar - niekontrolowana wymiana ciepła i masy,
- sumaryczny efekt cieplny zaistnienia różnych przemian chemicznych i zjawisk fizycznych w określonym układzie termodynamicznym, powodujący zmianę stanu termodynamicznego tego układu. Pożar powstaje tylko wtedy, gdy istnieje przestrzenna i czasowa współzależność czynników warunkujących jego powstanie.
- jest sumą reakcji spalania, jest wielkością addytywną, elementem składowym pożaru jest spalanie, na pożar oddziałuje układ, otoczenie oraz wiele innych czynników.
Każda reakcja spalania wiąże się z redukcją utlenianiem. Spalanie to bardzo szybko przebiegająca reakcja utleniania.
Pożar - jest to spalanie dyfuzyjne w układach heterogenicznych przy turbulentnym przepływie fazy lotnej. Spalanie homogeniczne - zachodzi w warunkach kontrolowanych.
Spalanie: - fizykochemiczny proces łączenia się (utleniania) materiału palnego z utleniaczem (powietrzem) któremu towarzyszy wydzielanie się ciepła i światła oraz produktów spalania,
- egzotermiczna reakcja palnego materiału z utleniaczem, zwykle z towarzyszeniem
płomieni, i/lub żarzenia, i/lub dymu.
Spalanie - zachodzi w ściśle określonej objętości,
- fizykochemiczna reakcja łączenia się materiału palnego z powietrzem, jest to proces kontrolowany. Niezbędne jest paliwo, utleniacz oraz ciepło. Każda reakcja spalania jest reakcją egzotermiczną. Najważniejszy jest materiał palny i jego własności (tlen i ciepło nie muszą koniecznie występować - materiały mają to w sobie). Każdemu spalaniu muszą towarzyszyć reakcje rozgałęzienia łańcuchowego.
Spalanie kontrolowane - typ reakcji chemicznej, w której zarówno ilość paliwa jak i szybkość jego dostarczania jest kontrolowana w danych warunkach wentylacji i w danych warunkach cieplnych.
Spalanie niekontrolowane - taki typ reakcji, który przebiega w układzie palnym w sposób samorzutny bez żadnej kontroli.
Do spalania potrzebne są: - materiał palny, utleniacz, ciepło, obecność w płomieniu pośrednich produktów (rodników - atom lub grupa atomów posiadających wolną wartościowość) warunkujących ciągłość spalania.
Spalanie dyfuzyjne - zjawisko chemiczne zależne od fizycznego zjawiska dyfuzji (powietrza do paliwa). W czasie spalania dyfuzyjnego paliwo i utleniacz są oddzielone od siebie i łączą się tylko na powierzchni. W warstwie rozdzielającej utleniacz i paliwo gazowe, gdzie stosunek powietrza do paliwa osiąga wartość stechiometryczną stabilizuje się płomień dyfuzyjny po którego stronie wewnętrznej występuje mieszanina spalin i gazu palnego a po stronie zewnętrznej mieszanina spalin i powietrza.
W środowisku pożaru kilkadziesiąt % materiały celulozowe (C6H12O6), reszta tw. sztuczne. Płomień powstanie jeżeli paliwo rozkłada się dając odpowiednie stężenie palnej fazy lotnej.
Piroliza = dysocjacja termiczna = rozkład termiczny
Ciecz się nie pali, lecz palą się jej pary.
Rodniki - są bardzo aktywne i nietrwałe. Ich powstanie wymaga doprowadzenia ciepła, bowiem tworzą się w wyniku reakcji endotermicznych. „Atakują” one inne związki udzielając swojej energii do tworzenia nowego związku. Są bardzo aktywne w stanach przejściowych. Reakcja pomiędzy substratami zachodzi etapami. Dlatego trzeba założyć występowanie produktów przejściowych utworzonych przez substraty w pierwszym etapie reakcji. Końcowe produkty reakcji zależą od sposobu przebiegu reakcji.
Utlenianie - reakcja egzotermiczna, przebiega w każdej temperaturze z różną szybkością,
- stanowi każdy proces chemiczny podwyższający wartościowość pierwiastka chemicznego.
O2 → O=O (struktura molekularna) ≡ 400kJ/mol - energia wiązania
-O-O- (struktura mostka tlenowego) ≡ 135kJ/mol
Ze względu na możliwość rozpoczęcia reakcji spalania interesują nas zjawiska o małej energii wiązania. W środowisku pożarowym najbardziej niebezpieczne są te materiały które rozkładają się pod wpływem ogrzewania i które pod wpływem ogrzewania oddają tlen jednoatomowy.
Przykłady związków nietrwałych:
-C≡C- C2H2, -N=O zw. nitrozowe, -C-O-C etery, -C≡N nitryle,
W reakcję spalania wchodzą tylko te cząsteczki, które mają energię większą niż energia aktywacji i mogą wejść w reakcję chemiczną.
Współczynnik aktywacji - najmniejsza porcja energii, przy której związek zaczyna być reaktywny.
Spalanie możemy podzielić ze względu na:
- stan skupienia:
homogeniczne (nie ma rozdziału faz palących się gazów)
heterogeniczne (rozdział faz - spalanie ciecz)
- szybkość spalania:
dyfuzyjne (spalanie powolne) zależy od dyfuzji powietrza do środowiska pożarowego,
kinetyczne (spalanie szybkie) zależy od szybkości przebiegu reakcji chemicznej,
- sposób przepływu fazy lotnej:
powietrzne,
laminarne (stała prędkość spalania),
turbulentne (zmienna szybkość spalania),
- cechy płomienia:
płomieniowe,
bezpłomieniowe
Spalanie homogeniczne - najczęściej jako wybuch:
- dyfuzyjne - ciecz ze swobodnej powierzchni, gaz w rurze,
- kinetyczne
Spalanie heterogeniczne:
- dyfuzyjne - węgiel kamienny, antracyt (96%C), koks,
- kinetyczne - tlenie drewna, tlenie węgla drzewnego.
.............................................................................................................................................
Ogień - ogół zjawisk, towarzyszący spalaniu płomieniowemu (płomień + gazy spalinowe i inne zjawiska). Zjawisko makro, zachodzące w dużej skali (płomień w ściśle określonej objętości).
Płomień (dyfuzyjny) - zasadnicza cecha to oddzielenie paliwa od utleniacza. Spalanie przebiega w tej objętości gdzie paliwo i utleniacz są mieszaniną. Pojawienie się płomienia zależy od typu paliwa i od szybkości jego dopływu.
Szybkość dopływu paliwa do powietrza:
- laminarny - szybkość przepływu paliwa jest niewielka (płomień świecy). Jest to objętość gazowa w której następuje spalanie przy laminarnym przepływie fazy lotnej, tworzy się przy małych powierzchniach spalania (do 50 cm2). Charakteryzuje go stała szybkość spalania.
- turbulentny - szybkość przepływu fazy lotnej jest chaotyczna, przypadkowa.
Płomień - ściśle określona objętość gazowa, w której następuje spalanie palnej fazy lotnej.
W płomieniu wyróżnia się:
- strefę palnej fazy lotnej - przygotowanie paliwa do spalania - duże cząsteczki paliwa (C5OH102) ulegają dysocjacji termicznej na niskocząsteczkowe fragmenty (C2H2) i dopiero one unoszone prądami konwekcyjnymi łączą się w zewnętrznej strefie płomienia z powietrzem, dając produkty spalania (CO2, H2O). Ogrzewanie strefy następuje w wyniku przekazywania ciepła na drodze promieniowania ze strefy spalania do powierzchni paliwa (strumień energii odwróconej). Spalanie płomienia następuje w jego zewnętrznej strefie.
- strefę spalania - spalanie ma miejsce zawsze w stężeniach stechiometrycznych paliwa.
Mało paliwa - strefa spalania przesuwa się do wewnątrz płomienia (nadmiar paliwa).
Mało tlenu - płomień przesuwa się w kierunku powietrza (strefa spalania płomieniowego).
Budowa płomienia:
Chwilę przed zapaleniem:
Płomieniem palą się paliwa, które dają fazę lotną.
Kształt płomienia nie jest stały, ale stężenie zawsze jest stechiometryczne.
W przestrzeni nie wentylowanej (mało powietrza) płomień jest węższy ale wyższy.
Wysokość płomienia jest funkcją szybkości przepływu palnej fazy lotnej w danych warunkach stężenia powietrza. Re > 2300.
Ruch fazy lotnej w środow. pożaru decyduje o sposobie spalania (laminarne, turbulencyjne).
Re = V ⋅ ρ ⋅ d/μ ; ρ - gęstość fazy lotnej [g/cm3], μ - lepkość par [g/cm s],
d - średnica strumienia [cm], V - szybkość przepływu fazy lotnej
Temperatura płomienia - jest funkcją ciepła spalania. Odwrotnie proporcjonalna do ciepła właściwego (entalpii) gazów spalinowych.
![]()
V' - teoretyczna objętość produktów spalania, V” - objętość nadmiaru powietrza,
C' - średnie ciepło właściwe produktów spalania, C” - średnie ciepło właściwe powietrza,
Wyższe ciepło spalania - wyższa temperatura płomienia.
Wyższe ciepło właściwe i entalpia gazów spalinowych - wyższa temperatura płomienia.
Temperatura płomienia w środowisku pożarowym od 550 ÷ 600 do ok. 20000C.
Średnia temperatura pożaru 900 ÷ 10000C.
Najwyższą temperaturę płomienia dają paliwa gazowe (acetylen, wodór).
Najniższa temperatura płomienia - włókna syntetyczne. Średnie - celulozopochodne.
Temperatura płomienia zależy od wysokości - najniższa bezpośrednio nad paliwem, najwyższa w 1/3 wysokości płomienia (mierząc od dołu).
Metale palą się bezpłomieniowo, nie dają fazy lotnej.
W środowisku pożaru tworzy się tylko i wyłącznie płomień dyfuzyjny (turbulentny).
Długość płomienia w laminarnym obszarze dla paliw węglowodorowych określa zależność:
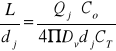
L - długość płomienia [m], dj - szerokość płomienia [m], Qj - objętościowa szybkość przepływu [m3/s], Co - początkowa ilość paliwa [ta ilość paliwa, która bierze udział w spalaniu], Dv - dyfuzyjność [m2/s], CT - wielkość frakcji niezbędnej do stechiometrycznego spalania. Długość płomienia wzrasta ze wzrostem szybkości przepływu paliwa, aż do osiągnięcia krytycznej wartości liczby Re.
Szybkość przejścia ze spalania laminarnego w turbulentne jest min. funkcją masy cząsteczkowej paliwa.
Świecenie płomienia - funkcja składu paliwa. Więcej pierwiastkowego węgla - płomień silniej dymiący, kopcący, świecący. Wszystkie związki które mają ponad 60% węgla dają płomień świecący. Związki które mają poniżej 60% węgla pierwiastkowego dają płomień słabo świecący.
Przyczyny świecenia płomienia: promieniowanie termiczne, promieniowanie typu chemiluminescencyjnego (wzbudzone atomy w wyniku zaniku energii wewnętrznej emitują część ciepła w zakresie 0,4 ÷ 0,7 - co oko odbiera jako świecenie). W 90% wszystkich pożarów płomień jest inicjatorem spalania.
Wysokość płomienia dyfuzyjnego: H = V/2ΠDMρ
V - wydatek objętościowy, ρ - gęstość gazu, DM - współczynnik dyfuzji molekularnej
Straty ciepła płomienia: q = ϕξδT4 ; ϕ - współczynnik konfiguracji, ξ - zdolność emisyjna powierzchni, δ - stała uniwersalna (St. - Boltzmana), T - temperatura [K].
Emisyjność płomienia - zależy od wielkości powierzchni spalania (wzrasta ze zmniejszeniem się średnicy pożaru).
.............................................................................................................................................
Paliwo - (substancja palna, materiał palny) związek, który ma zdolność do utleniania z odpowiednią do warunków otoczenia szybkością. O tym czy substancja jest paliwem decyduje ilość ciepła gromadzonego w stosunku do ciepła odprowadzonego. Wszystkie paliwa występujące w środowisku pożarowym są związkami węgla, oprócz H2, które także jest paliwem. Pożary obejmują paliwa stałe, ciekłe i gazowe. Najwięcej, bo 99% stałe.
Paliwa gazowe - związki w normalnych warunkach są gazami. Gaz + powietrze - mieszanina gazowa (gaz od razu przygotowany do spalenia). Wystarczy iskra by zaszło spalanie kinetyczne (nie dyfuzyjne).
Przejście paliw w stan lotny:
ciało stałe - sublimacja - pary i gazy
ciało stałe - mięknięcie, topnienie, rozkład termiczny - ciecz - parowanie, rozkład - pary i gazy
ciało stałe - rozkład termiczny + parowanie (pary) - pary
Ciecz paruje w temperaturze wrzenia, przy powierzchni gromadzi się (akumuluje) maksymalna ilość par. Następnie pary ulegają dysocjacji termicznej.
Im wyższa temperatura wrzenia, tym inicjacja spalania jest łatwiejsza. Wszystkie paliwa niskocząsteczkowe są niebezpieczniejsze.
Paliwa stałe dzielimy na: nieorganiczne (węgiel), organiczne (naturalne - drewno C6H12O6, polisacharydy C6H10O5, wełna, bawełna, czysta celuloza), włókna (celuloza + CS2), włókna wiskozowe - jeden surowiec sztuczny, drugi naturalny.
Tworzywa sztuczne - anilana, elana - wszystkie składniki sztuczne - otrzymane w wyniku reakcji chemicznych. Dzielimy na termoplastyczne i termoutwardzalne.
Tw. termoplastyczne - miękną, topią się i zachowują jak ciecz (proste łańcuchy węglowe), przechodzą w stan lotny. Na ogół spalają się całkowicie (poliwinid).
Tw. termoutwardzalne - (najczęściej o budowie sieciowej) w środowisku pożarowym ulegają rozkładowi, dając palną fazę lotną oraz dużą pozostałość zwęgloną (winidur). Ten typ rozkładu termicznego decyduje o różnym sposobie spalania się obu grup polimerów.
Pianka poliuretanowa:
Większość tw. termoplastycznych rozkłada się w niższych temperaturach i zapala szybciej w porównaniu z tw. termoutwardzalnymi, które podczas ogrzewania zwęglają się.
Z chwilą powstania płomienia tworzy się strumień ciepła, wypromieniowywany we wszystkich kierunkach. Część tego ciepła jest przekazywana do powierzchni (strumień energii zwróconej lub „energia feedback” - to ona decyduje o ciągłości spalania).
Rozkład termiczny ciał stałych - rozkład ciała stałego pod wpływem strumienia ciepła odpowiedniej mocy na produkty lotne, bardzo rzadkie ciekłe i pozostałość zwęgloną (analiza termograwimetryczna - wyznaczenie temperatury rozkładu oraz ubytki masy w danej temperaturze). Średnia wielkość temp. powierzchni przy której następuje rozkład ≅ 4000C (z wyjątkiem sublimatów). Skład fazy lotnej bardzo skomplikowany (189 różnych produktów). Wynika to z budowy tworzyw (materiały wysokocząsteczkowe - duży ciężar cząsteczkowy). Średnia temp. maksymalnego ubytku masy wynosi 4000C. Wszystkie materiały pochodzenia organicznego ulegają rozkładowi (także węgiel kamienny).
Temp. rozkładu [0C]: Polietylen (320 ÷ 440), Polistyren (340 ÷ 420), PCW (200 ÷ 300), Teflon (510 ÷ 540), Poliwęglowe (350 ÷ 450).
Przykład tworzyw sieciowych: pianka poliuretanowa - plastyczna (bardzo mały stopień polimeryzacji), sztywna (płyty).
Stabilność (termostabilność) paliw - jest to ubytek masy w czasie ogrzewania. Oznacza się ją: temp. max. ubytku, temp. przy której polimer traci 50% w czasie 30 minut.
Termostabilność - zależy od tego jak materiał zachowuje się w czasie spalania - zwęgla się czy nie. Paliwa które ulegają zwęgleniu mają większą termostabilność niż nie zwęglające się. Warstwa węgla na powierzchni paliwa, głębiej położone warstwy ulegają znacznie wolniejszemu rozkładowi termicznemu. Lv (zwęgl) >> Lv (niezwęgl).
ΔHsp/Lv - kinetyka generacji ciepła (HRR) - ilość ciepła [kJ] wydzielająca się z jednostki powierzchni [m2] w jednostce czasu [s].
Dla ciał stałych ΔHsp/Lv zmienia się od 3 ÷ 30.
paliwa alifatyczne > obecność aromatu > aromatyczne > próbki wysoce chlorowane
Największy wpływ z własności fizycznych na palność mają:
gęstość [g], współczynnik przewodnictwa ciepła [λ], ciepło właściwe [Cp].
Bezwładność cieplna - iloczyn trzech ww. wartości. Im jest on mniejszy tym paliwa (stałe i ciecze) mają większą podatność do zapoczątkowania reakcji spalania. Im jest on większy tym paliwo jest trudnozapalne lub nie pali się w ogóle.
Własności termofizyczne decydują o:
- szybkości przemieszczania ciepła od źródła do materiału,
- szybkości rozprzestrzeniania się płomienia po powierzchni materiału.
Ponad to o palności materiału decyduje: czy materiał jest 1-no czy wielowarstwowy, czy jest gruby czy cienki, sposób produkcji, wykończenie powierzchni.
W materiale wielowarstwowym o palności decyduje ilość warstw, sposób ich ułożenia, sposób oddziaływania źródła ciepła. Włókna - sposób tkania.
Ciepło gazyfikacji (Lv) - ilość ciepła którą musimy dostarczyć do jednostki masy paliwa tak aby otrzymać 1g produktu lotnego [kJ/g].
m = (Qpł - Qstraty)/Lv [g/m2s] : m - szybkość spalania,
Qpł - strumień ciepła, który dochodzi z płomienia do powierzchni materiału
dla ciał stałych - temperatura powietrza,
Lv - dla materiałów stałych > niż dla cieczy (PS Lv = 1,76 kJ/g, styren Lv = 0,64 kJ/g)
dla paliw zwęglających się Lv < niż dla nie zwęglających się, czyli m = Qpł/Lv (intensywność spalania w środowisku pożarowym).
W ocenie szybkości spalania paliwa najważniejszy jest strumień ciepła, który dochodzi z płomienia do powierzchni paliwa oraz ciepło gazyfikacji. Ułamek Qpł/Lv im jest większy - paliwo szybciej się zapala i szybciej się spala.
.............................................................................................................................................
Układ - zespół kilku ciał lub jedno, które poddajemy obserwacji, oddzielone od otoczenia wyraźnie ukształtowaną powierzchnią. Materia po drugiej stronie układu - otoczenie.
Układy: niepalne,
palne: układ palny homogeniczny - składniki układu są w jednym stanie skupienia (jednofazowy),
układ palny heterogeniczny - składniki w różnym stanie skupienia (spalanie na granicy faz),
Źródło ciepła (bodziec energetyczny) - dowolny impuls cieplny, mający niezbędny zapas energii cieplnej do zapoczątkowania reakcji spalania.
Punktowe (Q + światło) - które oddziałują na ściśle określoną powierzchnię lub objętość (temp. > 4000C), zaliczamy do nich: płomień zapałki, tlący się papier, żarząca powierzchnia, tlące się cząstki sadzy.
Ciągłe (tylko ciepło) - inicjują samozapłon. Zaliczamy do nich: nagrzane powierzchnie instalacji, mają temp. < 4000C, mają energię, nie świecą.
Inicjator spalania - ilość ciepła dostarczona przez źródło do układu palnego w stosunku do wartości ciepła spalania jednostki masy paliwa.
Niskoenergetyczne - małe q - kilka do kilkunastu hJ.
Wysokoenergetyczne - duże Q - duża moc strumienia ciepła kJ, MJ.
Symulator pożarowy - impulsy cieplne które w warunkach laboratoryjnych odtwarzają warunki pożarowe (moce rzędu od kilkudziesięciu do 100 kJ).
Symulatory pożaru jednorodne - o działaniu okólnym (bezpośrednie zetknięcie ze źródłem płomieni: zapałka, tlący się papieros, rozżarzone cząstki metalu), lokalne efekty (pożar fotela, stosu drewna), duża intensywność pożaru (14 ÷ 17 W/cm2, tzn. 140 ÷ 170 kW/m2).
Symulatory pożaru kombinowane - jednoczesne oddziaływanie źródeł płomieniowych i bezpłomieniowych.
Iskra elektryczna - zjonizowany gaz ogrzany do średniej temp. 6000 ÷ 20000K. Temp. zależy od parametrów obwodu elektrycznego. Zjonizowany gaz występuje w postaci atomowej a nie cząsteczkowej.
Mieszanina palna musi ogrzać się do jej temp. samozapłonu. Aby taki stan zaistniał musi być odpowiedni stan cieplny mieszaniny. Zależy on od: objętości mieszaniny która przejmuje ciepło od iskry, ilości ciepła którą przekazuje iskra, sposobu dystrybucji energii cieplnej w przestrzeni międzyelektrodowej. Im mniejszej objętości mieszaniny jest oddawane ciepło, tym szybciej się ona zapala i ma wyższą temperaturę.
Warunkiem zapłonu mieszaniny od iskry elektrycznej jest relacja między temp. spalania tej mieszaniny a jej temp. samozapłonu. Iskra przeskakując przez mieszaninę - oddaje część ciepła - iskra ochładza się a mieszanina nagrzewa. Warunkiem zapłonu jest zrównoważenie bilansu cieplnego mieszaniny. Temp. iskry osiąga (wewnątrz mieszaniny) temp. zapłonu tej mieszaniny, nie zauważa się strat ciepła, są one równoważone ciepłem redukcji (spalania).
Iskra mechaniczna - oddzielona od podłoża cząstka masy, rozgrzana do takiej temp. że występują zjawiska świecenia i przemieszczająca się w środowisku z określoną prędkością.
Iskrzenie - występowanie krótkotrwałych zjawisk cieplnych i świetlnych, zachodzących w otoczeniu cząstek oderwanych od podłoża na skutek mechanicznego oddziaływania tarcia lub uderzenia nagrzanych do wysokiej temperatury.
Iskrowność - zdolność materiału do wytwarzania iskier mechanicznych o określonej zdolności inicjacji zapłonu mieszaniny palnej.
Iskry mechaniczne dzielimy na:
- iskry tarciowe - tarcie dwóch ciał mechanicznych (metale dobrze przewodzące ciepło - mniej niebezpieczne),
- iskry udarowe - zderzenie się dwóch ciał metalicznych lub ciała metalicznego z niemetalicznym (beton). Nagły kontakt ciał poruszających się ukośnie względem siebie. W chwili zderzenia Ekin zamieniana jest na E odkształcenia sprężystego lub plastycznego. W miejscu uderzenia wytwarza się wysoka temp. (1200 K) - znacznie przewyższająca temp. samozapłonu wszystkich ciał. Czas trwania tego zjawiska oraz ilość wydzielonej energii zależy od wymiarów oderwanej cząsteczki. Własności tej iskry: czas żarzenia, szybkość osiągania wys. temp. rodzaj charakterystyki spektralnej zależy od własności fizykochemicznych materiału, tzn. jego zdolności do utleniania (szybkości redukcji).
Ze względu na własności chemiczne iskry mechaniczne dzielimy na:
- iskry mechaniczne aktywne (czynne) - reagujące z otaczającym je środowiskiem (ze stali węglowych i niskostopowych (w przemyśle) Fe 96%, C 4%. Proces trwa do wyczerpania jednego z reagentów. Powstała na skutek zderzenia Al ze stalą skorodowaną, zachodząca reakcja jest wysoce energetyczna 2Al + Fe2O3 → 2Fe + Al2O3 + Q; Q = 848 kJ/46g. Iskrą czynną jest też odprysk (rozrzut) spawalniczy. W trakcie poruszania się jej temp. rośnie.
- iskry mechaniczne bierne - cząstka materiału oderwana od podłoża, rozżarzona, która nie oddziałuje chemicznie z otaczającym środowiskiem. Temp. takiej iskry jest najwyższa na początku trwania zjawiska i obniża się dość szybko w miarę przemieszczania się iskry. Iskry bierne powstają wtedy, gdy oderwana cząstka nie może reagować z tlenem z powodu: natury chemicznej (sama jest tlenkiem lub ulega pasywacji przez pokrycie się warstwą tlenków), braku tlenu w środowisku (stężenie poniżej 18,14%), wymagają dużej energii aktywacji reakcji utleniania.
- iskry katalityczne - bierne, czynne, których produkty spalania działają katalitycznie na mieszaniny palne (np. platyna, nikiel).
Mała zawartość węgla w stali redukcja utleniania Fe i C wolna, czas ogrzewania oderwanej cząstki stosunkowo długi.
Duża zawartość węgla w stali, węgiel bardziej podatny do utlenienia niż żelazo, ogrzewa zewnętrzną otoczkę oderwanej cząstki. W otoczce znajduje się stały Fe2O3, gazowy CO i CO2. Najwyższą prężność tych związków ma CO, powoduje to że pod koniec lotu iskry na skutek prężności CO wewnątrz zewnętrznej otoczki tworzą się rozpryski, rozerwanie całej cząstki na liczne fragmenty, co znacznie zwiększa ich zdolność zapłonową.
Zapłon od iskry może powstać przy spełnieniu następujących warunków:
- temperatura iskry musi być wyższa od temperatury zapłonu mieszaniny wybuchowej,
- ilość ciepła wytwarzana przy spalaniu iskry musi być większa od strat ciepła do otoczenia,
- stężenie mieszaniny palnej musi być pomiędzy DGW a GGW.
Wielkość cząsteczki zapalającej np. 0,01 ÷ 0,001 mm - iskry szlifierskie.
Minimalna energia zapłonu - dla stechiometrycznych mieszanin gazów i par z powietrzem leży w granicach 0,2 mJ.
.............................................................................................................................................
Spalanie gazów dyfuzyjne (wolne) - np. pożar - szybkość spalania zależy od dyfuzji powietrza do środowiska pożarowego. Rozdział powietrza od gazu, mieszanina powstaje dopiero w strefie spalania.
Spalanie gazów kinetyczne (szybkie) - wybuch, szybkość spalania nie zależy od dyfuzji powietrza, lecz od czynników cieplnych i hydrodynamicznych. Mieszanina gazów, której szybkość spalania zależy od szybkości reakcji chemicznej.
Wybuch - szybki przebieg reakcji chemicznej w płynie (może być także powietrze) z utworzeniem gazowych produktów reakcji, podczas której powstaje fala ciśnienia lub/i uderzeniowa. Fala ciśnienia rozprzestrzenia się w płynie z szybkością dźwięku w danej temp. i danych warunkach ciśnienia (340 m/s). Fala uderzeniowa jest falą ciśnieniową rozprzestrzeniającą się z szybkością naddźwiękową.
Cechy wybuchu: egzotermiczność reakcji, duża szybkość przebiegu reakcji chemicznej, tworzenie się gazowych produktów wybuchu.
Wybuchy fizyczne mogą powstać:
- w następstwie wzrostu ciśnienia wewnętrznego
- spowodowane zetknięciem się wody ze stopami typu Al., Mg oraz stalą
- wyrzut ropy naftowej
- Bleve - wybuch par wrzących cieczy
Bleve - wybuch spowodowany nagłym wyciekiem łatwo zapalnej cieczy o temperaturze wyższej od jej temperatury wrzenia przy normalnym ciśnieniu atmosferycznym, powstały w wyniku dużego wielomiejscowego uszkodzenia zbiornika. Wybuch Bleve jest kombinacją wybuchu fizycznego i chemicznego.
Do powstania zjawiska typu Bleve konieczne jest spełnienie następujących warunków:
materiałem musi być ciecz lub gaz w stanie skroplonym
ciecz musi być magazynowana w zbiorniku bardzo szczelnie zamkniętym
temperatura cieczy w zbiorniku musi być wyższa niż temperatura wrzenia tej cieczy przy ciśnieniu atmosferycznym
Typy wybuchów:
- fizyczny - np. kotła, butli, (przy cieczach - wykipienie, wyrzut)
- chemiczny - szybko przebiegająca reakcja chemiczna:
A) - chemiczny heterogeniczny (wielofazowy) - wybuch przebiega w poruszającej się strefie reakcji.
Detonacja - rozprzestrzenianie się fali uderzeniowej, która powoduje powstanie wysokich temp. i ciśnienia, a strefa reakcji rozprzestrzenia się z szybkością naddźwiękową, Fala uderzeniowa i tuż za nią idąca reakcja spalania. Fala uderzeniowa może powstać w mieszaninie niepalnej (butle CO2 i N2). W odróżnieniu od deflagracji , gdzie występuje pojedyncza fala ciśnienia, tutaj fale nakładają się , tworząc falę uderzeniową. Aby zaistniała detonacja układ musi być jednostronnie zamknięty, musimy dostarczyć tyle ciepła powyżej temperatury zapłonu, aby ciepło mogło ogrzewać biegnącą falę. Na otwartej przestrzeni detonacja nie zachodzi, bo nie ma warunków do zagęszczenia mieszaniny, ciepło ulega dyssypacji.
Prędkość detonacji zależy od:
- początkowej temperatury mieszaniny, początkowego ciśnienia mieszaniny,
- powierzchni przewodów w których rozwija się detonacja,
Prędkość detonacji nie zależy od:
- sposobu zapłonu mieszaniny,
- krzywizn przewodów w których ma miejsce detonacja,
- typu materiału z których zbudowane są ścianki przewodów
Detonację charakteryzuje:
- płomień rozprzestrzeniający się z prędkością naddźwiękową (1500 ÷ 8000 m/s)
- ciśnienie powstałe w fali uderzeniowej jest od 20 ÷ 50 razy większe od początkowego,
- ciśnienie powstałe na czole fali jest od 2 ÷ 8 razy większe od ciśnienia wewnątrz fali
Detonacja gazu:
Płomień rozprzestrzenia się z szybkością naddźwiękową 1500 ÷ 5000 m/s.
Detonacja:
- mechanizm rozprzestrzeniania: sprężanie w fali uderzeniowej
- fala uderzeniowa i wybuch przebiegają razem
- brak efektów dźwiękowych
- prędkość fali uderzeniowej: naddźwiękowa
Deflagracja (spalanie wybuchowe) - rozprzestrzenianie się wybuchu następuje przez lokalne ogrzewanie mieszaniny wybuchowej. Płomień i strefa reakcji rozprzestrzenia się z szybkością poddźwiękową. Zależy tylko i wyłącznie od warunków cieplnych, które mają miejsca w danym układzie palnym.
Deflagracja:
- mechanizm rozprzestrzeniania: transfer ciepła
- prędkość płomienia; poddźwiękowa
- płomień: fala ciśnienia
- fale ciśnienia poprzedzają front płomienia
- fale ciśnienia słyszalne
- fale ciśnienia i płomień oddzielone
Co charakteryzuje wybuch deflagracyjny: sposób przekazywania ciepła (tylko mechanizm przekazywania ciepła ma wpływ na szybkość wybuchu), ciśnienie max. (Pmax), szybkość narastania ciśnienia (ΔP/τ), szybkość rozprzestrzeniania się płomienia, czas trwania wybuchu. Wielkości te odnosimy do wartości stechiometrycznych.
Max. ciśnienie dla różnych mieszanin gazów z powietrzem oraz mieszanin pyłowo-powietrznych otrzymujemy dla stężeń troszkę wyższych od stechiometrycznych.
Szybkość narastania ciśnienia ΔP/τ jest najważniejszą wielkością charakteryzującą skutki wybuchu [400KG/cm2 (dla niskokalorycznych cieczy) - 800KG/cm2]. Największy przyrost otrzymujemy w układach jednofazowych, najmniejszy w mieszaninach wielofazowych.
Od czego zależy wybuch deflagracyjny:
współczynnik dyfuzji - zdolność do tworzenia mieszanin wybuchowych i zależy od:
- zdolności do dyssypacji (zdolność do rozpraszania w atmosferze). Gazy ciężkie nie mają zdolności, czyli nie zawieszają się w powietrzu tworząc mieszaniny wybuchowe.
- możliwości występowania przenośnych źródeł ciepła (może nim być zapalony pyłek od jakiegoś słabego źródła),
- ilości materiału eksplodującego - musi być jego pewna ilość aby spalanie przeszło w wybuch,
- zniszczenie,
Dane używane w ocenie własności wybuchowych mieszaniny:
DGW i GGW,
a) temperatura zapłonu,
b) stężenie tlenu przy którym spalanie zostaje przerwane. Przy 18% O2 w powietrzu
większość substancji palnych nie zawierających tlenu w swojej strukturze przestaje
się palić. Jeżeli materiał nie zawiera w sobie 30% tlenu , to przestaje się palić, gdy
zawartość O2 w powietrzu spada poniżej 14%. Jeżeli materiał ma w sobie 50% O2
lub więcej - pali się bez dostępu powietrza.
c) minimalna energia zapłonu,
d) temperatura samozapłonu i samozapalenia,
e) podatność do samonagrzewania się (tlenia),
f) podatność do zapalenia w wyniku oddziaływania fali uderzeniowej lub tarcia,
g) tendencja do detonacji,
Zasięg wybuchu:
Nadciśnienie powstałe w wyniku wybuchu zależy od miejsca wybuchu. Zasięg określamy ze wzoru: 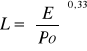
L - zasięg wybuchu [m], Po - ciśnienie [atm], E - energia, która wydzieli się w czasie spalania pary lub gazu, E i L jest zależne od ilości substancji, która wycieka.
B) - chemiczny homogeniczny (jednofazowy) - wybuch całej masy w tym samym czasie.
Eksplozja fotochemiczna - zapoczątkowana przez światło.
Eksplozja termiczna - spowodowana przez samonagrzewanie zimnej masy.
Praktyczne wykorzystanie parametrów wybuchu:
- pomieszczenie zagrożone wybuchem - w którym może wytworzyć się mieszanina
wybuchowa powstała z wydzielających się takich ilości par, gazów, pyłów, której
wybuch spowoduje przyrost ciśnienia w tym pomieszczeniu przekraczający 5 kPa,
- prace niebezpieczne pożarowo - w pomieszczeniach (urządzeniach) zagrożonych
wybuchem mogą być prowadzone wyłącznie wtedy gdy stężenie par, gazów w
mieszaninie z powietrzem w miejscu wykonywania prac nie przekracza 10% ich
DGW.
Mechanizm spalania się fazy gazowej. Reakcje stechiometryczne.
Szybkość każdej reakcji spalania płomieniowego zależy od obecności w płomieniu rodników. Jeżeli w płomieniu są rodniki to w płomieniu następuje szybkie zużycie paliwa.
Rodnik - atom lub grupa atomów posiadających wolną wartościowość (H*, OH*, O*, HO2).
Mechanizm spalania łańcuchowo-rodnikowego podczas spalania fazy gazowej.
Z jednej cząsteczki powstaje jeden rodnik - reakcja łańcuchowa prosta.
Jeżeli powstają dwa rodniki - reakcja łańcuchowa rozgałęziona.
Szybkość reakcji - oznacza jaka masa substancji palnej (jej stężenie) uległo reakcji chemicznej w czasie.
Przebieg reakcji spalania przy pomocy reakcji rodnikowo-łańcuchowej poprzedzony jest ogrzewaniem cząsteczek w wysokiej temp, a następnie ich rozkładem termicznym. Woda jest środkiem gaśniczym, lecz chemicznie może wchodzić w ciąg reakcji, przyspieszając reakcje spalania. CO2 nie wchodzi do reakcji tworząc rodniki CO2 → CO + 0,5O2 natomiast H2O rozkłada się na rodniki przyspieszające reakcje.
Czas indukcji - okres od chwili zapłonu do momentu wzrostu ciśnienia mieszaniny.
Pik ciśnienia - maksymalne ciśnienie mieszaniny.
Tangens kąta nachylenia prostej wzrostu ciśnienia do czasu - szybkość narastania ciśnienia - najważniejsza własność określonego wybuchu.
Piki ciśnienia - uzależnione są od stanu skupienia.
Czas indukcji - zależy od trwałości związku (metan - b. duży, wodór - b. mały).
Szybkość narastania ciśnienia - rząd kilkuset bar/s.
Rozchodzenie się fali ciśnieniowej zależy od gęstości związku (wodór - unosi się w górę, benzyna [fala] - rozchodzi się w poziomie.
Pyły - szybkość wzrostu ciśnienia 100 ÷ 200 bar/s - rozchodzi się wolno, lecz powstają największe szkody.
Mechanizm cieplny rozprzestrzeniania się płomienia.
Przenoszenie ciepła odbywa się na drodze przewodnictwa mieszaniny. Ten typ charakteryzuje wybuch deflagracyjny.
Mechanizm przejściowy rozprzestrzeniania się płomienia.
Rozprzestrzenianie płomienia na drodze cieplnej, jak też w wyniku zachodzących zjawisk hydrodynamicznych (sprężanie mieszaniny). Typ niestabilny, przejściowy, który po pewnym okresie czasu staje się typowym wybuchem deflagracyjnym, albo jeśli będą warunki (bardzo długa rura) samoprzyspieszenie się płomienia przechodzi w spalanie detonacyjne.
Mechanizm powstania fali uderzeniowej (wybuchowej).
Szybkość spalania zależy od procesów hydrodynamicznych zachodzących w rurze. Procesy cieplne nie odgrywają żadnej roli. Taki typ rozprzestrzeniania się płomienia nazywa się detonacją i charakteryzuje się dużą szybkością.
Normalna prędkość rozprzestrzeniania się płomienia - liniowa prędkość rozprzestrzeniania się frontu płomienia [cm/s], przy założeniu że front płomienia jest prostopadły do kierunku rozprzestrzeniania. Stała wielkość fizykochemiczna dla danej mieszaniny.
Obserwowana szybkość rozprzestrzeniania się płomienia - przemieszczanie się frontu płomienia w stosunku do ścian rury, zbiornika w którym znajduje się mieszanina palna.
Szybkość obserwowana jest zawsze większa od normalnej. Byłyby sobie równe gdyby front płomienia był płaski (jest wypukły).
Granice wybuchowości (zapalności).
Dysocjacja termiczna jest procesem endotermicznym - obniża temperaturę.
Mieszanina uboga - mieszanina gazu (pary) z powietrzem, w której stężenie składnika palnego jest poniżej stężenia stechiometrycznego (nadmiar powietrza).
Mieszanina bogata - mieszanina gazu (pary) z powietrzem, w której stężenie składnika palnego jest powyżej stężenia stechiometrycznego (nadmiar składnika palnego).
GGW - max. stężenie składnika palnego w mieszaninie z powietrzem, przy którym zapłon jeszcze powoduje rozprzestrzenienie się płomienia na całą mieszaninę.
DGW - palny gaz ulega zapłonowi od iskry i rozprzestrzenia się na całą objętość mieszaniny.
Prężność pary - zdolność pary do przechodzenia ze stanu ciekłego w gazowy.
Zależność granic wybuchowości od ciśnienia.
Wzrost ciśnienia - gaz jest bardziej niebezpieczny - związek z energią kinetyczną cząstek.
Spadek ciśnienia - schodzenie się granic wybuchowości, DGW rośnie, GGW maleje -
mieszanina przestaje być wybuchowa. Przy 200 mmHg - minimalne stężenie
graniczne, przy którym w ogóle substancje nie palą się i nie wybuchają.
Przyczyny zmian granic wybuchowości w zależności od ciśnienia:
- termostabilność substancji - rozkład substancji w wysokiej temperaturze, np. metan
jest bardzo termostabilny,
- prędkość rozprzestrzeniania się płomienia - na ogół wraz ze wzrostem ciśnienia
wzrasta prędkość rozprzestrzeniania się płomienia.
Wpływ czynników na granice wybuchowości:
- temperatura - wzrost zakresu wybuchowości. Zmiana temp. powoduje wzrost
szybkości reakcji, a tym samym rozszerzenie się granic. Zmiana temperatury spalania 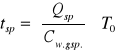
- położenie bodźca energetycznego - zapłon dolny, górny, środkowy. W
doświadczeniach stosuje się dolny zapłon, bo wtedy następuje wymiana ciepła na
wszystkie 3 sposoby - w górnym nie ma konwekcji.
wprowadzenie gazu obojętnego - zawęża granice wybuchowości.
.............................................................................................................................................
Zapłon - zapalenie mieszaniny palnej punktowym bodźcem energetycznym tylko w bardzo ograniczonej przestrzeni wokół której powstaje czoło płomienia przemieszczające się następnie już samoczynnie na całą pozostałość mieszaniny.
Samozapłon - równomierne ogrzanie materiału do takiej temperatury w której zapala się on samorzutnie w całej masie bez udziału tzw. punktowego bodźca energetycznego.
Samozapalenie - proces samorzutnego nagrzewania się materiałów palnych zachodzący w wyniku egzotermicznej reakcji materiału palnego i utleniacza bez udziału bodźców.
Temperatura samozapłonu (zapalenia) - najniższa temp. ścianek naczynia w której w danych warunkach i dla danej mieszaniny następuje samorzutnie zapalenie cieczy w całej masie bez udziału tzw. zewnętrznego bodźca energetycznego.
Temperatura samozapalenia - najniższa temp. materiału w której następuje jego samozapalenie w określonych warunkach badania.
Temperatura zapłonu - najniższa temp. cieczy w której wytwarza ona pary wystarczające do zapłonu od zewnętrznego bodźca energetycznego.
Temperatura zapłonu charakteryzuje tylko ciecze palne. Nie charakteryzuje się gazów palnych przez podanie temp. zapłonu ponieważ ulegają one zapłonowi od płomienia w każdej temp.
Wyrzut - natychmiastowe, równoczesne przejście w parę wody znajdującej się na dnie zbiornika, powstanie podwyższonego ciśnienia i wyrzucenie całej masy paliwa istniejącej nad warstwą wody.
Spalanie cieczy - jest możliwe gdy nad powierzchnią cieczy utworzy się mieszanina par z powietrzem zdolna ulec zapłonowi, samozapłonowi lub samozapaleniu. Warunkiem jest:
- stężenie par musi zawierać się w przedziale między DGW i GGW
- odpowiednia ilość utleniacza (co najmniej 12%)
- odpowiednia temp. (nie mniejsza niż temp. zapłonu cieczy)
- właściwa energia cieplna źródła ciepła
Temp. źródła ciepła > temp. zapalenia
Temp. cieczy > temp. zapłonu cieczy
Po zapaleniu gdy temp. górnej warstwy cieczy jest wyższa od temp. zapłonu ustala się spalanie ciągłe.
W płomieniu ma miejsce przygotowanie par cieczy do spalania (ogrzanie, dysocjacja termiczna), a następnie mieszanie z powietrzem, utleniaczem i spalania (w strefie spalania).
Ciepło potrzebne do ciągłego spalania przekazywane jest na drodze promieniowania.
Szybkość spalania ciągłego zależy od:
- budowy cieczy, początkowej temp. cieczy (im wyższa tym szybciej zachodzi)
- średnicy zbiornika w którym się znajduje (do pewnego momentu)
- ilości cieczy w zbiorniku, szybkości wiatru,
- rośnie wraz ze wzrostem temp. i obciążenia cieplnego
- maleje wraz ze wzrostem parowania ciepła i ciepła właściwego
- max. wartości - przy temp. początkowej cieczy (przed spalaniem) - równy temp.
wrzenia
- min. wartości - przy temp. początkowej cieczy (przed spalaniem) - równej temp krzepnięcia
Obciążenie cieplne powierzchni parowania cieczy - ilość ciepła przekazywana z płomienia na jednostkę powierzchni spalania w jednostce czasu [kJ/m2⋅h]. Jest to wielkość stała dla danej cieczy niezależnie od sposobu ogrzania cieczy. Największe wartości mają ciecze które podczas spalania dają silnie kopcący płomień (duża zdolność promieniowania ciepła).
Spalanie mieszanin cieczy - Sposób spalania się cieczy w małych zbiornikach
Jest zróżnicowany i zależy od typu cieczy. W ogrzewaniu cieczy bierze udział przewodnictwo konwekcją, a w niewielkim stopniu promieniowanie. Ciecze w trakcie spalania pod warstwą powierzchniową ogrzaną do temp. wrzenia dają tzw. warstwę przegrzaną - o temp. wyższej niż temp. wrzenia tej cieczy. Grubość tej warstwy (kilka mm) w miarę spalania się cieczy tzn. przesuwania się lustra cieczy w dół, nie ulega zmianie. Jest ona stała i nie ma wpływu na szybkość spalania cieczy w czasie pożaru. Aby ciecz spalała się w takich warunkach musi mieć odpowiednie właściwości:
- musi być to ciecz jednorodna
- musi mieć małą lepkość
- musi być mały zbiornik (∅<20 m)
Sposób spalania się cieczy w dużych zbiornikach ∅>20 m
Jest zróżnicowany i zależy od typu cieczy. W ogrzewaniu cieczy biorą udział wszystkie typy przenoszenia ciepła. Jeśli ciecz jest pochodną ropy lub węgla (mieszanina różnych substancji) wówczas trakcie spalania pod warstwą powierzchniową ogrzaną do temp. wrzenia dają tzw. warstwę przegrzaną - o temp. wyższej niż temp. wrzenia tej cieczy. Grubość tej warstwy rośnie w trakcie spalania i w miarę obniżania się lustra cieczy i spalania się jej może spowodować różne zjawiska wtórne - wykipienie i wyrzut.
Ropa naftowa - mieszanina różnych zw. chemicznych takich jak:
- węglowodory nasycone o łańcuchach prostych
- gazowe - metan do butanu
- ciekłe - pentan do pentadekanu
- stałe - od heksadekanu wzwyż
- węglowodory rzędu naftenowego, aromatyczne, szeregu olefinowego
- zw. tlenowe np. kwasy naftenowe
- związki siarkowe np. S2, H2S
- związki azotowe np. zasady pirydynowe
- żywice i asfalteny
Każda surowa ropa naftowa zawiera wodę niekiedy do kilku %.
Podstawowe parametry ropy naftowej:
- temp. zapłonu poniżej minus 210C
- temp. samozapłonu (zapalenia) 2500C
- granice wybuchowości w powietrzu DGW 0,7% obj. 40g/m2
- temp. wrzenia 350C (początek)
- ciepło spalania 9400 ÷ 10600 kcal/kg
- gęstość par 3 razy większa od powietrza
Szybkość spalania ropy naftowej zależy od:
- czasu trwania procesu spalania
- od średnicy naczynia (małe naczynie ma względnie dużą szybkość spalania)
- prędkości wiatru (wyższa temp).
.............................................................................................................................................
Ciała stałe.
Tlenie - wolno przebiegające zjawisko spalania materiału, podczas którego nie tworzy się płomień. Spala się tylko węgiel.
≅ Spalanie bezpłomieniowe produktu rozkładu termicznego (węgla). Inaczej jest to świecenie. Taki węgiel świecąc utlenia się (spala) do CO lub CO2. Tlić się może tylko węgiel. Jakie materiały się tlą:
- wszystkie celulozowe (bawełna, włókna wiskozowe)
- materiały porowate zwęglające się
- tworzywa termoutwardzalne (żywice).
Fala tlenia - ogrzana i świecąca, podczas spalania bezpłomieniowego, warstewka materiału.
Trzy strefy w materiale ulegającym tleniu:
1. strefa pirolizy - podczas której następuje rozkład i wydzielają się części lotne,
opuszczające materiał palny, szybki wzrost temperatury
2. strefa zwęglenia - temp. osiąga max. Wydzielone produkty lotne - zaczyna się
świecenie węgla - max. szybki proces utleniania się węgla
3. strefa bardzo porowatego węgla lub/i popiołu - który nie tli się bo nie ma zdolności
do utleniania się, spadek temperatury
Szybkość rozprzestrzeniania się warstwy tlącej: ![]()
q - strumień ciepła przesuwający się w kierunku rozprzestrzeniania się tlenia [W/m2]
δ - gęstość [kg/m3]
h - entalpia - ciepło wymagane aby nastąpił wzrost temperatury od temp. początkowej
do temp. tlenia [J/kg].
Tlenie jest spalaniem kinetycznym.
Czynniki wpływające na szybkość tlenia:
wyższej od ich temp. skroplenia. Również dla materiałów stałych nie wykorzystuje się temp. zapłonu gdyż zapłon ciała stałego zachodzi w warunkach ogrzewania samej powierzchni a więc nie może charakteryzować temperatury całej masy materiału. Proces rozkładu termicznego ciał stałych jest procesem nieodwracalnym, a temp. zapłonu wymaga aby w chwili zapłonu miała miejsce równowaga termodynamiczna pomiędzy fazą lotną a innymi fazami. Zapłon odnosi się więc do wszystkich faz skupienia lecz temp. zapłonu charakteryzuje tylko ciecze.
Temperatura spalania - maksymalna temperatura strefy płomienia.
Temperatura samozapłonu - temperatura przy której samorzutnie pojawia się płomień.
Warunkiem aby mieszanina w całej objętości nagrzała się do temp. samozapłonu jest aby promień mieszaniny był równy lub większy od: ![]()
δm - grubość czoła płomienia (cienka zew. warstewka płomienia mająca najwyższą temperaturę w płomieniu). Warunek spełniony gdy rkr >>10 δm. Wtedy temp. spalania, czyli nagrzania mieszaniny jest tak duży, że ulega ona samozapłonowi.
Szybkość reakcji (W): ![]()
ko - stała szybkości reakcji chemicznej utleniania,
p - ciśnienie cząsteczkowe par lub gazów palnych w mieszaninie z powietrzem,
n - rząd reakcji chemicznej,
e-E/RT - funkcja Arheniusa, określająca wpływ temp. na szybkość reakcji chemicznej,
R - stała gazowa, E - energia aktywacji, t - czas, T - temp. reagującej mieszaniny palnej.
Temperatura samozapłonu (zapalenia): ![]()
To - temp. ścianki naczynia,
Tz - temp. samozapłonu (zapalenia).
Ciała stałe - 200 ÷ 4000C; Ciecze - 300 ÷ 5000C; Gazy - 400 ÷ 6500C.
Temperatura samozapłonu zależy od:
- ciśnienia (wzrost ciśnienia - temperatura samozapłonu maleje),
- typu materiału zbiornika i atmosfery - wszystkie materiały mające temp. samozapłonu poniżej 1000C są związkami samozapalającymi się. Platyna jest najlepszym katalizatorem reakcji samozapłonu (także kwarc), temperatura samozapłonu maleje w miarę wzrostu stężenia tlenu w powietrzu oraz wtedy, gdy mieszanina styka się z tzw. promotorem reakcji spalania (kwarcem, platyną) lub też podnosi kiedy styka się z inhibitorem reakcji spalania.
- typu detonatora - antydetonatory podnoszą temp. samozapłonu mieszanin,
- objętości naczynia - małe naczynie - ścianki odbierają dużo ciepła, w miarę wzrostu objętości maleje powierzchnia właściwa odbioru ciepła. przy b. małej objętości naczynia substancja palna może w ogóle się nie zapalić lub też paląca się substancja gaśnie.
.............................................................................................................................................
Zapłon cieczy - inicjacja procesu spalania przy pomocy punktowych bodźców energetycznych (powyżej 5000C) np. płomienie, rozżarzone elementy. Wprowadzamy płomień (> 5000C) lub element rozżarzony (Q + światło). Mamy więc ułatwiony proces inicjacji spalania w porównaniu z samozapłonem.
Zapłon trwały - bodziec musi ogrzać mieszaninę do temperatury samozapłonu, aby proces mógł rozprzestrzeniać się na całą mieszaninę.
Zapłon chwilowy - bodziec rozgrzewa mieszaninę, która się spala (w temp. zapłonu) tylko przez czas, kiedy bodziec jest w mieszaninie.
Zapłon tym różni się od zapalenia, że zapalenie wywołuje ciągły bodziec energetyczny. Zapłonowi ulegają tylko ciecze.
Temperatura zapłonu - najniższa temp. cieczy, w której ciecz ogrzewana w normatywnych warunkach wydziela taką ilość par, że wytworzą one mieszaninę palną z powietrzem, zdolną zapalić się od płomyka gazowego (DGW).
W przepisach ciecze palne to te ciecze, które mają temp. zapłonu poniżej 1000C.
Ciecze niebezpieczne pożarowo to te, które mają temp. zapłonu poniżej 550C.
I kl. niebezpieczeństwa pożarowego < 210C,
II kl. niebezpieczeństwa pożarowego 21 ÷ 550C
III kl. niebezpieczeństwa pożarowego 55 ÷ 1000C
W mieszaninie cieczy palnej z niepalną temp. zapłonu będzie niższa niż temp. cieczy palnej.
Przyrządy do pomiaru temperatury zapłonu:
- metoda Marcussona - tygiel otwarty (open cup „OC”)
- metoda Martensa-Pensky'ego - tygiel zamknięty (close cup „CC”)
- metoda Abla-Pensky'ego - tygiel zamknięty (close cup „CC”)
- Flashpoint - chwilowy zapłon
- Firepoint - trwały zapłon - najniższa temp. cieczy przy której zapalenie par
punktowym bodźcem energetycznym następuje w otwartym naczyniu w sposób
trwały.
Szybkość parowania: ![]()
m - masa par opuszczających powierzchnię
Lv - ciepło parowania
QE - szybkość dostarczania ciepła przez źródło zapalenia
QL - szybkość strat ciepła na m2 jednostki parującej
Jeżeli płomień jest ustabilizowany przy powierzchni to szybkość parowania równa się szybkości spalania.
Warunki stężeniowe podczas flashpoint i firepoint:
Jeżeli stężenie par nad powierzchnią cieczy jest >>mniejsze od stężenia stechiometrycznego to wtedy następuje zapłon chwilowy (flashpoint), ponieważ straty ciepła są większe niż 30% tworzącego się ciepła spalania.
Jeżeli stężenie par nad powierzchnią cieczy jest >>wyższe od stężenia stechiometrycznego to wtedy następuje zapłon trwały (firepoint), w czasie zapłonu wydzieli się taka ilość ciepła, że ogrzeje powierzchnię cieczy do temperatury wrzenia.
Najniższe temp. zapłonu mają te ciecze, które:
- mają mały ciężar cząsteczkowy
- małą lepkość
- niską temp. wrzenia i wysoką prężność par
- prostą budowę łańcucha
Szybkość spalania cieczy - jest to ubytek masy cieczy w czasie. Może to być szybkość liniowa [mm/min] lub wagowa [kg/m2h].
Kipienie - jednoczesne przejście w parę większej ilości wody (w warunkach
pożarowych), znajdującej się w produkcie naftowym i powstanie piany na powierzchni cieczy, która może przelewać się przez ściany zbiornika, rozprzestrzeniając pożar.
daje wodę i
węgiel. Tworzący się węgiel posiada słabe przewodnictwo cieplne i silne właściwości adsorpcyjne dlatego też ulega intensywnemu utlenianiu co powoduje wzrost temp. do 280 ÷ 3000C (zwartość rośliny). Jeżeli straty ciepła są małe to roślina może się zapalić.
4) roślina ulega samozapaleniu Qzmagazynowane >> Qstrat
Mechanizm samonagrzewania fizycznego (węgiel kamienny):
w wyniku adsorpcji gazów przez materiał palny, a następnie reakcji chemicznej (utleniania). Adsorpcja gazów daje efekty cieplne tylko wtedy, gdy materiałem palnym są zwykłe węgle kamienne, tzn. takie które mają w swym składzie ok. 60% węgla pierwiastkowego a resztę stanowią domieszki rudy żelaza (siarczki żelaza, siarczany żelazawe).
Szybkość utleniania się węgla a następnie szybkość samozapalenia zależy min. od:
- początkowej temperatury (im większa tym szybciej węgiel się utlenia)
- stężenia tlenu w otoczeniu
- stopnia rozdrobnienia węgla (drobny 320 ÷ 3400C, gruby 4000C)
O właściwościach adsorpcyjnych węgla decyduje typ zanieczyszczenia (siarka).
W warunkach normalnych nie adsorbuje się ani azot ani tlen.
Największy efekt energetyczny daje adsorpcja pary wodnej. Pochłonięcie 0,01 g pary wodnej daje 25 kJ ciepła, 0,01 g Cl2 daje strumień do 18 kJ, a 0,01 O2 daje 7,5 kJ. Stąd też temp. węgla podnosi się do 70 ÷ 800C. Powyżej tej temp. następuje proces desorpcji - wydzielanie się gazów z powierzchni węgla. W temp. powyżej 700C zaczyna się proces utleniania węgla i jego zanieczyszczeń, szczególnie siarki koloidalnej, która występuje samoistnie w węglu lub powstaje na skutek rozpadu pirytu.
Adsorpcja - osadzanie się pewnych substancji na powierzchni cieczy i ciał stałych, bez wiązania chemicznego. Ciało adsorbujące nazywa się adsorbentem, substancję adsorbowaną adsorbatem. Adsorpcja uwarunkowana jest siłami przyciągania.
Mechanizm samonagrzewania reakcji chemicznej - oleje i tłuszcze.
- materiały które ulegają samonagrzewaniu pod wpływem powietrza (oleje roślinne,
fosfor, siarczki, węgliki alkalicznych metali np. N2S),
- materiały które ulegają samonagrzewaniu pod wpływem wilgoci (Na),
- materiały które ulegają samonagrzewaniu w mieszaninach między sobą (H2S + HNO3).
Oleje dzieli się na roślinne i mineralne. Do samonagrzewania zdolne są tylko oleje roślinne. Są to mieszaniny glicerydów wysokocząsteczkowych kwasów tłuszczowych. Cząstki tych glicerydów kwasu oleinowego mają podwójne wiązania, które warunkują zdolność do samonagrzewania.
1. R - CH = CH - R + O2 → R - CH - CH - R
↑
400 kJ/mol - energia O _ O
wiązania O = O
energia wiązania C = C >> C - C
O_O
(mostek nadtlenkowy 100kJ/mol energia wiązania O - O , bardzo reaktywny)
2. R - CH - CH - R →R - CH - CH - R + -O-
O _ O O
w chwili powstania bardzo aktywny tlen. Im więcej wiązań podwójnych tym szybciej się nagrzewa. 1 i 2 reakcje egzotermiczne.
3. Polimeryzacja.
R - CH = CH - R + R - CH - CH - R → R - CH - CH - R
O _ O O O
R - CH - CH - R
Z 2 tworzy się jedna całość. Proces egzotermiczny.
Samonagrzewanie zależy od:
- ilości wiązań nienasyconych w oleju,
- własności zaoliwionego materiału (im mniejsza gęstość materiału tym szybciej się samozapala),
- stosunku ilości oleju do ilości materiału,
- sposobu składowania materiału (najlepiej zapalają się bele, sterty, pryzmy - duża
akumulacja ciepła). W przypadku olei najbardziej niebezpieczny układ gdzie stosunek
materiału włóknistego do masy oleju wynosi 1:2 - duża powierzchnia utleniania, a
mała strat cieplnych.
Z gatunków zwierzęcych tylko tran ma zdolność do samozapalenia. Największą zdolność do samozapalenia pod wpływem oleju mają materiały o bardzo małej dyfuzyjności czyli małej λ, ρ, Cp - czyli materiały porowate. Własności samozapalające olejów i tłuszczów określa się wyznaczając tzw. liczbę jodową.
Liczba jodowa (LI) - ilość gramów jodu którą może przyłączyć 100 g oleju. Im wyższa liczba jodowa , tym olej szybciej się samozapala.
Aby układ był samozapalający się musi być duży dostęp tlenu, małe straty ciepła i olej musi stykać się z materiałem porowatym o małej dyfuzyjności cieplnej, tzn. takim który ma małą gęstość, mały współczynnik przewodnictwa cieplnego i małe ciepło właściwe. Ciepło z oleju gromadzi się w materiale a nie jest odprowadzane do otoczenia stąd też przy odpowiednio dużym stosunku oleju do materiału, materiał może ulec samozapaleniu.
Samozapalanie siarczków żelaza:
Siarczki - sole kwasu siarkowodorowego (H2S) i metali. W przyrodzie występują FeS lub Fe2S3, FeS*S - siarkosiarczek żelazawy (piryt - b. duża zdolność do samonagrzewania w wyniku dużej adsorpcji tlenu z otoczenia). Piryty są jednymi z najsilniejszych związków samozapalających się. Najbardziej wrażliwe na utlenianie siarczki żelazowe (FeS) powstają pod wpływem siarkowodoru zawartego w ropie na produkty korozji żelaza. Szybkość samonagrzewania siarczków zależy od szybkości dopływu powietrza, aktywności siarczków żelaza. Woda jest katalizatorem reakcji samozapalania siarczków, przyspiesza szybkość tworzenia się Fe(OH)3, jeśli zawartość wody (wilgoci) jest zbyt duża staje się on wtedy inhibitorem reakcji. Aby nastąpiło samozapalenie siarczków obecność tlenu w powietrzu musi być wyższa niż 6%.
Samozapalenie innych związków chemicznych:
1. Związki samozapalające się pod wpływem powietrza - temp. zapłonu poniżej 1000C, w warunkach pokojowych tak aktywują tlen z powietrza, że zapalają się na ogół w temp. 40 ÷ 800C. Zaliczamy do nich: fosfor biały (żółty), PH3, P2H4, pyły Zn, Al., Mg. Wszystkie one pod wpływem O2 natychmiast się zapalają.
CaC2 + H2O → Ca(OH)2 + C2H2 ⇒ (czysty 3100C, zanieczyszczony 1100C) - temperatury samozapłonu. Decyduje o tym duże powinowactwo do tlenu.
Al + O2 → Al2O3 (w przemyśle Al. pokrywany jest tłuszczem),
CaO + H2O →Ca(OH)2 + 1 MJ/mol ciepła (t = 7000C)
a) grubość materiału - cienkie na ogół nie ulegają tleniu. Wartość graniczna 5 mm
(pyłu). Warstwy cieńsze mają zbyt duże straty ciepła Vsm = g2 (kwadrat grubości materiału).
b) temp. którą ma strefa tląca (ok. 800 ÷ 9000C, a też 4000C - nawinięty papier)
c) kierunek rozwoju fazy tlącej: ↑ → ↓. Największa ↑ ponieważ bierze udział prąd
konwekcyjny.
Inicjacja spalania bezpłomieniowego materiałów porowatych:
a) następstwo spalania płomieniowego - przede wszystkim drewno
b) przez kontakt ze źródłem cieplnym (bezpłomieniowym)
c) przez równomierne ogrzewanie
d) w wyniku samonagrzewania się substancji
e) przez niesymetryczne ogrzewanie (np. pyłu od gorącej powierzchni)
Źródło ciepła musi spowodować powstanie węgla i zapoczątkować jego utlenianie. Spalanie bezpłomieniowe nie rozwija się jeżeli źródło ciepła jest zbyt silne. Tlenie powstaje tylko wtedy gdy ogrzewany materiał tworzy „sztywny węgiel”.
Charakterystyczne aspekty tlenia:
Zbyt miękki węgiel lub smoła nie tli się. Struktura molekularna i sposób degradacji termicznej materiału stałego decydują o zachowaniu się materiału. Tlenie związane jest ze zmianami strukturalnymi materiału który ulega tleniu. Te które się tlą dają tzw. „sztywny węgiel” - taki który tworzy przestrzenną strukturę. Tworzą się w niej tzw. ośrodki zarodkowe o bardzo dużej zdolności do utleniania, a więc i do tlenia. Tworzenie tych ośrodków jest uzależnione od typy zanieczyszczeń istniejących w materiale. Są związki chemiczne tzw. „promotory tlenia” (celulozopochodnych - LiCl, RbCl, LiOH, CsCl, NaCl - tworzenia struktury węgla sztywnego) które przyspieszają to zjawisko oraz takie które je opóźniają - „inhibitory tlenia” (celulozowych - S, AlCl3, SbCl3, CaCl2, - blokowanie tworzenia aktywnych centów silnie utleniających się).
Temperatura tlenia jest parametrem określającym podatność materiału na zachodzenie w nim procesów egzotermicznych, mogących doprowadzić do spalania bezpłomieniowego. Jest zależna od:
- grubości warstwy materiału tlącego się - ruchu i wilgotności powietrza,
- wielkości cząsteczek substancji tlącej się - skład substancji,
- wielkości powierzchni zewnętrznych i wewnętrznych materiału,
- stężenia tlenu w atmosferze,
- sposobu i szybkości ogrzewania materiału
Żarzenie - świecenie powierzchni materiału nieorganicznego który nie uległ rozkładowi termicznemu, lecz ogrzał się w wyniku różnych zjawisk i przemian chemicznych. Świecenie powierzchni nie rozłożonej ok. 1/3 energii akumuluje się w ciele stałym podczas spalania bezpłomieniowego, a 2/3 do fazy lotnej. Przy żarzeniu nie mamy fazy lotnej. Żarzy się grafit, antracyt, odprysk metalu. W żarzeniu 100% energii (ciepła spalania) idzie na ogrzanie materiału.
Początek spalania można osiągnąć przez:
- zapłon - punktowy bodziec energetyczny
- samozapłon - ciągły bodziec cieplny
- samozapalenie - bodziec cieplny musi wytworzyć się sam
Samozapalenie - jeden z typów reakcji zapoczątkowania reakcji spalania płomieniowego lub bezpłomieniowego. Polega na tym, że materiał sam z siebie lub w połączeniu z innym materiałem wytwarza silny strumień ciepła, prowadzący do jego samorzutnego zapalenia się przy braku zewnętrznego bodźca energetycznego. Wszystkie materiały samozapalające mają temp. samozapłonu < 1000C. Związki takie w temp. < 1000C mają bardzo dużą szybkość utleniania tak, że ciepło reakcji utleniania przewyższa straty ciepła, w wyniku czego materiał się samozapala.
Samonagrzewanie - poprzedza samozapalenie i jest to proces charakteryzujący się tym, że temp. układu palnego podwyższa się w wyniku generacji ciepła wewnątrz samego układu, niezależnie od dopływu strumienia ciepła z zewnątrz.
Jeśli wzrost szybkości wydzielania się ciepła jest b. duży to zjawisko samonagrzewania przyspiesza się z możliwością przejścia w proces spalania (samozapalenia).
Temp. układu palnego przy której zaczyna się już samoprzyspieszanie reakcji i akumulacji ciepła nazywa się temp. krytyczną samonagrzewania.
Czas od momentu ogrzewania się substancji do pojawienia się płomienia to czas indukcji.
Samonagrzewanie materiałów może zachodzić w różny sposób i być:
- procesem biologicznym (rozmnażanie, oddychanie komórek roślinnych)
- procesem fizycznym (adsorpcja)
- reakcjami chemicznymi ( 3 podgrupy związków: 1) oleje i tłuszcze, 2) siarczki żelaza, 3) substancje jednorodne i mieszaniny zw. chemicznych)
- proces biologiczny - spalanie płomieniowe
- proces fizyczny
samonagrzewanie
samozapalenie
- reakcja chemiczne materiału - tlenie
Mechanizm samozapalenia biologicznego.
Do samozapalenia mają zdolność tylko niektóre rośliny i materiały: siano, koniczyna, otręby, mokre liście, chmiel.
Warunkiem samozapalenia jest:
- nagromadzenie dużej ilości materiału - stóg - mała powierzchni strat ciepła w
stosunku do powierzchni właściwej utleniania (rozdrobnienie),
- wegetacja rośliny nie zakończyła się i pod wpływem bakterii zaczynają się procesy
fermentacyjne i gnilne, które podnoszą temperaturę dając początek tzw. ogniskom
samoutleniania
- obecność wilgoci w roślinie - umożliwia rozmnażanie mikroorganizmów - proces egzotermiczny.
Proces samonagrzewania produktów roślinnych dzielimy na 4 etapy:
1) pod wpływem wilgoci zaczynają się procesy wegetacyjne (egzotermiczne - max. 700C),
2) pod wpływem temp. (700C) giną mikroorganizmy, białkowe produkty rozpadają się
tworząc tzw. żółty węgiel porowaty, charakteryzujący się silnymi właściwościami
adsorpcyjnymi par i gazów z otoczenia,
3) w wyniku adsorpcji utleniacza przez węgiel temp. wzrasta do 1300C. Zaczynają się
rozkładać elementy roślinne, a w temp. 2000C rozkładają się wszystkie komórki
roślinne i ich główny składnik celuloza C6H10O5. Rozkład celulozy
Plastyki charakteryzują się tylko częściową odwracalnością własności fizycznych, włókna natomiast charakteryzują się minimalną rozszerzalnością, są bardzo wytrzymałe na rozciąganie.
Wszystkie plastyki dzielą się na:
tworzywa termoplastyczne - w podwyższonej temperaturze ulegają deformacji plastycznej, czyli topią się (jest to proces nieodwracalny), palą się jak ciecz (np. PE, PP, PVC, PMM),
tworzywa termoutwardzalne - pod wpływem ogrzewania dają dużą warstwę zwęgloną ze względu na zmianę struktury tworzywa. Proces ten jest nieodwracalny (np. NŻ, PES, żywice fenolowe, mocznikowe, silikony).
Chemiczna klasyfikacja ze względu na typ łańcucha decyduje o ich reaktywności i zachowaniu się w warunkach pożarowych:
A) zawierające tylko węgiel (homo atomowe):
- polietylen (-CH2-CH2-CH2), polipropylen (-CH(CH3)-CH2), - opakowania, powłoki
- dieny - podwójne wiązanie w cząsteczce - poliizopren, polibutadien (gumy, kauczuk),
B) zawierające różne atomy (hetero atomowe): silikony (zawierają Si, O).
Dieny łączą się z innymi polimerami tzw. kopolimery dienowo-styrenowe, najlepsze gumy. Część polimerów termoplastycznych używana jest jako pianki np. polistyren (ciało stałe) → ciecz → styropian
C) zawierające tlen:
- polimekrylan etylu (PMMA) CH2-C(CH3)-CO-O-CH3 - szkło organiczne (plexi)
- poliestry - włókna - elana, anilana
- poliwęglany - opakowania, włókno, szkło
D) zawierające azot:
- nylony (-CO-NH-)n
- polimetany (NH-COO-)n - pianki polimetanowe
- poliakrylo-nitryle (CH2-CH2-CH-)n - włókno anilana
E) zawierające chlor:
winidur -(CH2-CHCl)- - najbardziej popularne tworzywo na świecie.
Sztywny, nie plastyczny (rury, powłoki osłony domów - siding)
Elastyczny - izolacje (polwinit) włókna, powłoki, folie, zabawki.
Różni się od twardego tym, że zawiera plastyfikatory (zmiękczacze)
Są również polichlorki półtwarde (chlorowane) - rury instalacji tryskaczowych
F) zawierające fluor:
teflon - politerafluoro-etylen (PTFE)
Spalanie tworzyw sztucznych to proces który obejmuje wiele przemian fizycznych i chemicznych.
Wyróżnia się 3 podstawowe etapy spalania:
- ogrzewanie materiału
- rozkład termiczny - piroliza
- zapalenie
Stabilność termiczna polimerów (I etap) - odporność lub wytrzymałość termiczna, odporność cieplna - jest to max. temperatura długotrwałej stabilności polimeru przy której dane tworzywo nie zmienia w sposób istotny swoich właściwości. Długotrwała stabilność termiczna klasycznych polimerów nie przekracza 1300C.
Polimery o dużej stabilności termicznej charakteryzują się:
- wyższą temperaturą topnienia
- wyższą temperaturą mięknienia i termicznego rozkładu
- mniejszy ubytek masy podczas ogrzewania w podwyższonej temperaturze
- wyższą temperaturą ugięcia pod obciążeniem
- mniejsze zmiany właściwości fizycznych, chemicznych i mechanicznych
Stabilność termiczna polimerów wiąże się ściśle z ich budową chemiczną a przede wszystkim z energią wiązań pomiędzy atomami tworzącymi makrocząsteczkę i czynnikami makroskopowymi.
Temperatura czasu półtrwania polimeru (Th) - temperatura w której próbka ogrzana w czasie 45 min. traci 50% swej masy pierwotnej.
Czynniki wpływające na termiczną stabilność polimeru:
- rozgałęzienie łańcucha, obecność tlenu w łańcuchu (-)
- obecność w polimerach niektórych ugrupowań np. OH, Cl, RCO, NH2, które
stosunkowo łatwo odszczepiają się (-)
- wiązania wielokrotne w łańcuchu głównym (+)
- wprowadzenie pierścieni aromatycznych i heterocyklicznych do łańcucha głównego (+)
- duży ciężar cząsteczkowy (wyjątek nylony) (+)
- zastąpienie atomów wodoru przez atomy fluoru (+)
- zwiększenie stopnia stereoregularności poprzez wprowadzenie do łańcucha głównego
grup które przeszkadzają w jego swobodnej rotacji np. wprowadzenie grup polarnych,
grup dużych objętościowo (+)
Pod wpływem energii cieplnej i promieniowania UV polimery reagują z tlenem i innymi związkami chemicznymi. Wynikiem tego może być zmiana składu chemicznego, degradacja lub destrukcja. Powstają produkty zdolne do dalszych reakcji. Inicjujące reakcje depolimeryzacji.
Spalanie tworzyw poprzedzone jest zawsze rozkładem termicznym tworzywa.
Energia aktywacji rozkładu termicznego tworzyw (Ea) zależy od:
- szybkości grzania tworzywa
- temperatury rozkładu - niższa temp. - niższa energia aktywacji
- ciężaru cząsteczkowego - niższy ciężar - niższa energia aktywacji
- zawartości tlenu - więcej tlenu - niższa energia aktywacji
Wielkość temperatury rozkładu określa termostabilność tworzyw.
Termostabilność - ubytek masy tworzywa w czasie ogrzewania lub temperatura w której następuje ubytek 50% masy tworzywa (czas połowicznego rozkładu) w czasie 30 minut.
Ilość ciepła wydzielona w procesie spalania: ![]()
[kW]
Qp - ilość wydzielonej energii [kW]
X - współczynnik całkowitości spalenia (ok. 70%) - tzw. skuteczność spalenia
m - szybkość spalania [g/m2s] produktów lotnych - masy idącej z powierzchni do płomienia
ΔHc - ciepło spalania materiału [kJ/g]
Fpow - powierzchnia spalania [m2]
Szybkość pirolizy (rozkładu termicznego, II etap) zależy od:
- temperatury, szybkość przepływu powietrza w układzie
- energii aktywacji reakcji rozkładu
- termicznej stabilności polimeru i jego właściwości fizycznych
- szybkości reakcji chemicznych rozkładu
Rozkład termiczny czy piroliza jest procesem endotermicznym i nieodwracalnym.
Zapalenie (III etap) - tworzyw sztucznych występuje gdy powstałe z rozkładu termicznego gazy osiągną stężenie w zakresie granic zapalności i temperaturę równą temperaturze zapalenia chociaż jednego składnika.
CH4 + OH- → CH3 + H2O; CH4 + H- → CH3 + H2
Tworzywa sztuczne dzielimy pod względem temperatury na:
2. Substancje samozapalające się pod wpływem wody - np. Na, K, Rb, Cs, CaC2, NaC2.
Na + 2H2O → 2NaOH + H2(↑) (wodór zapala się (5900C))
NaHS + H2O (wilgoć) → NaOH + S (koloidalna)
Ca3P2 + 6 H2O → 3 Ca(OH)2 + 2 PH3
Tylko wybitnie egzotermiczne reakcje mogą zachodzić w ten sposób.
3. Mieszaniny samozapalające się.
Mieszanina - układ kilku składników, które zachowują swoje właściwości - nie zachodzi między nimi reakcja. W mieszaninach samozapalających musi być część która utlenia (utleniacz na ogół powietrze) i część która utlenia się - materiał palny.
4. Substancje które szybko samozapalają się w mieszaninach z innymi.
Aby substancja samozapaliła się w mieszaninie z utleniaczem musi mieć:
stosunkowo niską temperaturę samozapłonu
występować w stanie dużego rozdrobnienia (pył)
ciała stałe lite (nie rozdrobnione) muszą mieć małą gęstość - źle przewodzić ciepło.
Wszystkie ciała porowate (słoma, siano, bawełna) polane HNO3 - samozapalają się; ciecze o niskich temp. samozapłonu - 1000C, gazy H2S, pyły KclO3.
.............................................................................................................................................
Spalanie ciała stałego (dotyczy też polimerów).
Zapłon ciała stałego - najniższa temp. ogrzewanej powierzchni przy której nastąpi zapłon produktów rozkładu termicznego od punktowego bodźca energetycznego.
Wpływ własności fizykochemicznych materiałów na ich palność:
gęstość - wielkość określająca masę substancji zawartej w objętości jednostkowej - mała gęstość materiału palnego sprzyja samonagrzewaniu się materiału wskutek stosunkowo mniejszego przewodnictwa cieplnego materiału, gęstość maleje - materiał szybciej się spala
ciepło właściwe - ilość ciepła jaką trzeba dostarczyć do ogrzania 1 kg materiału aby jego temperatura wzrosła o 10, ![]()
, temperatura materiałów o wysokim Cp wzrasta wolniej niż materiałów o niskim Cp np. tworzywa sztuczne.
Przewodnictwo cieplne.
Przewodzenie ciepła przebiega na ogół zgodnie z prawem Fouriera.
Gęstość przewodzonego strumienia ciepła jest wprost proporcjonalna do gradientu temperatury na określonej długości ![]()
λ - współczynnik przewodzenia ciepła (przewodność cieplna) wyrażony w [W/mK]
znak - oznacza że ciepło płynie zgodnie ze spadkiem temperatury
Pojemność cieplna - jest to iloczyn gęstości ζ, współczynnika przewodzenia ciepła λ i ciepła właściwego Cp: ![]()
[W2 ⋅ s/m4 ⋅ K2]
Im materiał ma niższą pojemność cieplną tym szybciej się ogrzewa i szybciej zapala się (mniej ciepła potrzeba do akumulacji wewnątrz materiału).
Ciepło spalania - maksymalna ilość ciepła, jaka może się wydzielić podczas spalania się jednostki materiału. Podczas spalania w pożarach woda pozostaje w stanie lotnym (para) - stąd częściej używa się wartości opałowej.
Spalanie płomieniowe: ![]()
m - szybkość spalania [g/m2⋅s]
qz - strumień ciepła dostarczany z zewnątrz do materiału [kW/m2]
qp - strumień ciepła dostarczony z płomienia do powierzchni materiału [kW/m2]
qs - strumień ciepła tracony z powierzchni materiału w wyniku promieniowania [kW/m2]
L - ciepło gazyfikacji [kJ/g]
Spalanie bezpłomieniowe: qp - brak
Ciepło gazyfikacji - ilość ciepła [kJ] niezbędna do powstania 1 g substancji lotnej. Charakteryzuje podatność materiałów do przejścia do fazy lotnej. ![]()
φ - strumień ciepła padający na jednostkę masy paliwa
mgw - strumień masy lotnych produktów pirolizy z jednostki powierzchni paliwa [m2]
Im ciepło gazyfikacji większe tym szybkość spalania mniejsza. Ciepło gazyfikacji maleje to substancja jest łatwo zapalna. Dla ciał stałych ciepło gazyfikacji decyduje o szybkości pirolizy i w konsekwencji o szybkości spalania.
Kinetyka generacji ciepła - ilość ciepła (kJ) która wydziela się podczas spalania jednostki powierzchni materiału (m2) w jednostce czasu (s) [kW/m2].
Klasyfikacja materiałów stałych pod względem palności:
- materiały stałe celulozopochodne (także tworzywa naturalne tzn. otrzymywane w procesie naturalnej polikondensacji,
- tworzywa.
Proces łączenia się małych, prostych cząstek w duże cząsteczki z wydzieleniem się H2O (NH3, HCl) nazywamy jako polikondensacja (drewno, płyty pilśniowe) - materiały celulozopochodne są polikondensatami.
Tworzywa - dzielimy na:
- sztuczne - otrzymane z produktów naturalnych i sztucznych (wiskoza, celuloza)
- syntetyczne - wszystkie substraty, tzn. materiały przed reakcją, są otrzymywane w wyniku reakcji chemicznej.
Proces łączenia się małych cząsteczek (merów) w duże cząsteczki nazywa się polimeryzacją a materiały otrzymywane w wyniku tego procesu polimerami.
Klasyfikacja polimerów ze względu na ich własności fizyczne:
- moduł elastyczności
- stopień wydłużenia
Ze względu na ww. własności fizyczne polimery dzielimy na:
- elastomery 105 - 106 N/m2 (moduł elastyczności)
- plastyki 102 - 108 N/m2
- włókna 109 - 1010 N/m2
W zależności od zdolności do wydłużenia dzielimy na:
- elastomery 500 - 1000%
- plastyki 100 - 200%
- włókna tylko 10 - 3%
Elastomery charakteryzują się bardzo dużą rozciągliwością (zdolnością do rozszerzania się) która jest procesem całkowicie odwracalnym w temperaturze pokojowej.
Polimery termoplastyczne - o strukturze liniowej lub rozgałęzionej, ze względu na brak grup funkcyjnych zdolnych do sieciowania nie utwardzają się podczas ogrzewania, zachowują swoją budowę (poniżej temp. rozkładu), w wyższych temp. ulegają deformacji - topią się, spalają jak ciecze
Polimery termoutwardzalne - tworzywa w których pod wpływem podwyższonej temp. następuje nieodwracalny proces powstawania struktury usieciowionej, pod wpływem ogrzewania tworzą warstwę zwęgloną, spalają się homo i heterogenicznie.
Poliolefiny - łatwopalne
Początek pirolizy - ok. 3000C, rozkład termiczny - ok. 1500C.
Spalają się do CO, CO2, H2O. Tworzące się dymy i gazy pachną woskiem i parafiną.
Dym mało kopcący - mało węgla. Podczas rozkładu pęka łańcuch C - C i tworzą się małe, średnie i długie elementy łańcucha: definy, parafiny, cykliczne węglowodory np.
2 PE Ⴎ C2H4, C2H6, C6H6.
Mała różnica między temperaturami zapłonu a temperaturami samozapłonu.
Polistyreny - PS, SAN (kapolimer, styrenoakrylonitryl), ABS.
Bardzo żółty dym, silnie kopcący > 90% węgla w cząsteczce. Charakterystyczny zapach palącej się gumy. Rozkład termiczny - depolimeryzacja: monomery, dimery, trimery.
Temperatura zapłonu 4100C, temperatura samozapłonu 4600C.
Poliestry - PMMA (pleksi) - łatwopalny
Spala się żółtym płomieniem, powoli z łańcucha polimeru przechodzi w sieciowany, co powoduje tworzenie dymu. Niska zdolność do dymienia. Pod wpływem temperatury mięknie i pirolizuje dając tylko substancje lotne bez pozostałości zwęglonej. Gazy spalinowe pachną jak owoce. W ogóle nie ulega zwęglaniu. Pod wpływem temperatury matowieje, a później spływa.
Poliwęglany - PW - trudno zapalny.
Pod wpływem temperatury tworzą piankę (CO2), węgiel, aldehydy, ketony oraz CO. Pod wpływem ogrzewania wydziela się CO2 - co powoduje trudno zapalność. Powstałe z rozkładu aldehydy i ketony, jako związki palne nie zapalają się (duże stężenie CO2). Powstają w wyniku polimeryzacji pochodnych organicznych węglanów. Duża przezroczystość.
Teflon - czterofluoro etylen - mięknie i rozkłada się w temperaturze > 5000C Przy rozkładzie wydziela się fluorowodór, który całkiem eliminuje wolne rodniki (inhibituje proces spalania). Jedno z bardziej termostabilnych tworzyw. Rozkłada się tylko w obecności bardzo silnych płomieniowych źródeł ciepła, lub pod wpływem silnego strumienia ciepła 70 Ⴘ 80 kW/m2.
Poliamidy (PA) - Nylon (włókna) = stylon (trudno zapalne).
Są to włókna termoplastyczne, mogą się zwęglać. Najbardziej znane: PA6, PA66, PA610.
Spalają się żółtym płomieniem, w wyniku sieciowania tworzą się w polimerze bąbelki a później węgiel. Dym pachnie amoniakiem. Rozkład termiczny PA przebiega poprzez pękanie łańcucha co powoduje obecność w fazie lotnej NH3, HCN, CH3CN, amidy, ketony cykliczne, estry, CO, CO2, H2O. Poliamidy SO2 są to głównie włókna. najbardziej znane: nylon, stylon, perlon. Podczas ogrzewania miękną, topią się a następnie przechodzą w stan lotny. Silny strumień ciepła powoduje ,że pęka łańcuch węglowy i tworzą się różnego typy związki (w fazie lotnej) amoniak, pochodne kwasu cyjanowodorowego oraz w dużych ilościach CO2 i H2O (powodują trudno zapalność). Faza stała wypełnia się gazami (bąbelki), które z tej masy ulatują do otoczenia, a w samym tworzywie rozpoczyna się powolny proces zwęglania. Średnia dymotwórczość. Spala się żółtym płomieniem.
Polichlorek winylu - PCW - trudno zapalny
Może być bez plastyfikatorów (twardy) lub z plastfikatorami.
Mechanizm rozkładu PCW:
1) podgrzanie polimeru - doprowadzenie ciepła ze źródła zewnętrznego lub strefy spalania
2) mięknięcie (70Ⴘ900C) - dla polimeru nie modyfikowanego lub niżej dla modyfikowanego
3) piroliza (200Ⴘ3000C) - odszczepieniem HCl z utworzeniem wiązań podwójnych sprzężonych, tworzy się pozostałość zwęglona z fragmentami aromatycznymi powstałymi przez cyklizację. Gazy powstałe podczas pirolizy po zmieszaniu z powietrzem są zdolne do zapalenia od zewnętrznego bodźca energetycznego.
Temperatura zapłonu produktu nie modyfikowanego PCW - 3900C
Temperatura zapłonu produktu modyfikowanego PCW - 4500C
Ciepło spalania 20000 kJ/kg
Mechanizm spalania PCW zawiera 3 elementy zmniejszenia palenia:
- przerywanie łańcucha rodnikowego (działanie w fazie gazowej)
- utrudnianie dostępu ciepła i tlenu do polimeru poprzez tworzenie zwęgliny (działanie
w fazie stałej)
- działanie fizyczne wydzielonego chlorowodoru który rozcieńcza gazy palne i utrudnia dostęp tlenu
Zagrożenia pożarowe jakie powoduje PCW:
- wydzielanie przy spalaniu toksycznych produktów, dioksyny
- korozyjność powstałych gazów
- wydzielanie dużych ilości gęstego i żrącego dymu
Utylizacja:
- trudności z recyclingiem
- wydzielanie podczas utylizacji szkodliwych związków szczególnie dioksyn
- nadmierna ilość energii do utylizacji
- niemożność stosowania biologicznych metod do utylizacji
Eksploatacja:
wydzielanie szkodliwych substancji
Badania w pełnej skali: wykazały, że podstawowym produktem toksycznym jest tlenek węgla nie zaś chlorowodór. Wynika to z:
- chlorowodór jest gazem bardzo reaktywnym
- higroskopijnym
- cięższym od powietrza (sedymentacja)
Żywice - tworzywa termoutwardzalne - nie są plastyczne w podwyższonej temperaturze, lecz stają się twarde. Mogą mieć budowę liniową (łańcuchową) jak i sieciową. Większość ma budowę sieciową. Aby otrzymać dobre właściwości użytkowe dodaje się do nich różnego typu dodatki, które zmieniają ich jakość własności użytkowych. Są to min.:
- wypełniacze mineralne (piasek marmurowy)
- mączka drzewna
- włókna organiczne (węglowe)
- masy szklane (szczególnie dla pokryć dachowych). Ze względu na budowę sieciową - w warunkach pożarowych nie miękną i nie topią się. Rozkładając się dają niewielką ilość produktów lotnych i dużą ilość węgla. Zwęglona warstwa, jako dobry izolator nie przenosi ciepła w głąb do warstwy podpowierzchniowej, ale trzyma ciepło w węglu, co powoduje, że częściowo łączy się on z tlenem z powietrza, tworząc warstewkę tlenku CO2. Przy silnie egzotermicznej reakcji utleniania, która ma miejsce na powierzchni węgla, tlenki te ulegają rozkładowi. W wyniku tego węgiel zaczyna tlić się i świecić.
Żywica fenolowo-formaldehydowa (bakelit) - trudno zapalna, otrzymywana w środowisku kwaśnym. Podczas ogrzewania rozkłada się na NH3 (stąd zapach). Struktura sieciowa bardzo sztywna i twarda. Płomień bardzo jasny, mała zdolność dymotwórcza. Spala się płomieniowo tylko wtedy gdy jest całkowicie rozłożona. Najczęściej spala się krótkim płomieniem, a w zasadzie tli, czas spalania płomieniowego bardzo krótki. Do temperatury 4500C wydziela się max. 15% substancji lotnych. Podstawowa masa substancji lotnych (ok. 50%) tworzy się w temperaturze ponad 12000C (średnia temp. pożaru 9000C) - wtedy pali się płomieniowo.
Żywica epoksydowa - łatwo zapalna. Budowa bardzo skomplikowana. Charakteryzują się max. podatnością do zapalenia, ponieważ maja niską tendencję do zwęglania. Gęstość ok. 1,20g/cm3 - lekka. Termicznie stabilna do 1400C. Największy rozkład w temp. 240Ⴘ3500C - w zależności od budowy. Palą się żółtym płomieniem, dają bardzo dużo dymu, nie dają warstwy węglowej. handlowe żywice epoksydowe mają wypełnienie nieorganiczne - są bardziej odporne termicznie (1550C) od tych które nie zawierają wypełniaczy.
Pianki - układ dyspersyjny (rozproszony) w którym fazą rozpraszającą jest tworzywo, a fazą rozproszoną - gaz (polistyren, poliuretan, polichlorek winylu - powietrze, CO2, N2). Palność pianki zależy od jej struktury i stopnia rozwinięcia - czyli tzw. liczby spienienia. Najbardziej palne są te pianki których stosunek powierzchni do masy (F/m) jest największy, ponieważ w tych warunkach zachodzi najszybciej piroliza tworzywa i w konsekwencji najszybciej zachodzi spalanie. Wszystkie pianki, które są bardzo spienione (duża liczba spienienia) mają gęstość mniejszą niż 15 kg/m3.
W zależności od polimeru z którego są zrobione dzielimy na:
1) termoutwardzalne (PE, fenolowe)
2) termoplastyczne (styropian, PS, PCW, poliestry PE)
3) elastyczne (gumy)
W zależności od budowy dzielimy na:
1) sztywne (zamknięte komórki piany) - izolacje termiczne
2) elastyczne (otwarte komórki piany) - meble, materace, miękkie izolacje.
Pianka polistyrenowa (styropian) - komórki zamknięte, gęstość ၲ = 15Ⴘ30 kg/m3. Pod wpływem płomienia struktura styropianu niszczy się zaczyna się stapiać i przy dużej masie spala się na żółto, jak gdyby cofając się. Bardzo mała termostabilność. Styropian jest odporny tylko do 1000C. W temp. 2000C rozkłada się całkowicie.
Pianka poliuretanowa (PU) - łatwo zapalna. Główna reakcja otrzymywania pianek:
Tego typu piankę wypełnia się CO2, by jak najmniej wydzieliło się HCN. Występują tutaj zarówno pianki sztywne jak i elastyczne. Sztywna pianka - ၲ = 30Ⴘ35 kg/m3 - spala się jasnym płomieniem. Jest odporna do temp. 1200C, rozpad w temp. 2200C, dając: alkohole, CO, CO2, H2O, HCN. Jeżeli ma budowę sieciowaną jest bardziej stabilna.
Pianka elastyczna - ၲ = 20Ⴘ45 kg/m3. Jest stabilna do temp. 1000C - tylko częściowo sieciowana mięknie. Pianki poliuretanowe zachowują się w pożarze różnie w zależności od tego czy są to pianki elastyczne czy twarde (sieciowane). O ile temp. rozkładu pianek elastycznych PU jest ok. 2200C o tyle sztywnych PU wynosi o ok. 1500C więcej. W produktach rozkładu występują CO, CO2, H2O, C i HCN - bardzo palny i wybuchowy gaz, jedna z najniebezpieczniejszych trucizn.
Środki ogniochronne - zmniejszenie palności tworzyw - inhibitory, antypireny.
Ze względu na sposób działania dzielimy na:
A) środki o działaniu fizycznym - mechanizm opóźnienia zapłonu (samozapłonu) oparty jest na zjawisku fizycznym (parowanie, topnienie, zwiększanie wilgoci itp.)
- chłodzenie (wszystkie hydraty np. Na2SO4, 2 H2O)
- tworzenie pokrywy ochronnej MgCO3 - zmniejsza palność i ilość dymu,
- rozcieńczanie - rozkładając się wytwarzają gazy obojętne, rozcieńczające mieszaninę palną tworzącą się w wyniku rozkładu nad powierzchnią tworzywa
- sole, najczęściej kwasu węglowego, które pod wpływem ciepła rozkładają się z wydzieleniem CO2 (mogą być siarczany - wydzielają SO2)
- tworzy spulchnioną masę
B) środki o działaniu chemicznym - modyfikują sam polimer tzn. są wbudowywane w łańcuch lub w sieć polimerową:
- inhibicyjne działanie antypirenu w fazie gazowej - wiążą rodniki O, H, HO2, OH w płomieniach. Proces spalania jest hamowany , bo QT spada - polega na dezaktywacji aktywnych atomów i rodników, tworzących się w płomieniu i decydujących o szybkości spalania.
- dołożenie takich substancji do tworzywa, które spowodują szybkie zwęglanie tworzywa, a szczególnie zwęglanie powierzchni (taka powierzchnia ma bardzo małe przewodnictwo cieplne),
- zmiana wytrzymałości powierzchniowej (pęka powierzchnia, dzięki czemu oddziałuje cała powierzchnia a nie sam materiał)
Działalność zmniejszająca palność może mieć miejsce w fazie stałej, ciekłej lub gazowej.
Główne cechy środków ogniochronnych:
1) podnoszą temp. rozkładu polimeru (opóźniają zapłon, samozapłon)
2) tworzą na powierzchni grubą warstwę zwęgloną (utrudniają spalanie)
3) środki ochronne o działaniu inhibicyjnym - zmniejszają szybkość spalania w płomieniu
Są trzy typy oddziaływania mieszanin środków ogniochronnych:
1) działanie addytywne - sumuje się oddziaływanie ogniochronne poszczególnych środków
2) działanie synergetyczne - mieszanina poszczególnych środków ma wzmocnione działanie, niż suma oddziaływań poszczególnych środków,
3) działanie antagonistyczne - jeden składnik niszczy działanie drugiego składnika
Środki o działaniu chemicznym są lepsze i skuteczniejsze niż fizyczne, ale obydwa typy oddziaływań nakładają się .
Najważniejsze grupy środków ogniochronnych:
1) reaktywne środki płomieniowe - wbudowane w strukturę polimeru w czasie jego otrzymywania - najczęściej żywice termoutwardzalne
2) środki addytywne - nie są wbudowane w polimer ale dodawane do niego (głównie do tworzyw termoplastycznych)
Halon
H+O2 Ⴎ OH+O; O+H2 Ⴎ OH+H // te rodniki są usuwane przez halony
np. CH3CL Ⴎ R+Cl ; Cl+RH Ⴎ R+HCl ; HCl+H Ⴎ H2+Cl ; HCl+OH Ⴎ H2O+Cl
CH3Cl - środek ogniochronny. Wysokoenergetyczne rodniki O, OH, H. Po dodaniu halonu rodniki te w wyniku reakcji zachodzących w płomieniu zostają eliminowane tzn. łączą się w cząsteczki obojętne, a na ich miejsca wchodzą obojętne rodniki chloru (bromu).
Antypireny halogenowe - zw. alifatyczne, cykloalifatyczne i aromatyczne (o najmniejszej stabilności termicznej).
HBr+OH' ႮH2O+Br' ; HBr+H' Ⴎ H2+Br' ; HBr+CH3 Ⴎ CH4+Br' ; H'+Br'+MႮHBr+M
I > Br >Cl > F wymagania: brak toksyczności, stabilność termiczna (2700C), zawartość chloru > 50%, brak zabarwienia, lotności, dobra mieszalność z polimerem, ciężar cząsteczkowy < 600mol/gram.
Nieorganiczne związki ogniochronne.
Wypełniacze, plastyfikatory (zmiana temp. rozkładu polimeru, rozcieńczanie fazy lotnej w reakcjach endotermicznych lub tworzenie warstwy zeszklonej np. związki boru).
Al.(OH)3 Ⴎ Al2O3+3H2O 298 kJ/mol
2H3BO3 Ⴎ 2HBO2 Ⴎ B2O3 - dehydratacja
W wyniku odparowania wody na powierzchni materiału tworzy się biały proszek, który doskonale odbija promieniowanie i chłodzi środowisko spalania.
Halogen - związki antymonu.
Sb : Cl = 1 : 3 oddziaływanie synergistyczne polega na katalizowaniu reakcji syntezy lotnego trójhalogenu antymonu SbX3, który silnie wpływa na przebieg reakcji chemicznych w płomieniu.
Sb2O3+2HCl Ⴎ 2SbOCl+H2O , 5SbOCl Ⴎ Sb4O5Cl2+SbCl3
Związki antymonu przyspieszają dehydratację, dehydrohalogenizację i odwodorowienie co w konsekwencji prowadzi do tworzenia warstwy zwęglonej na powierzchni polimeru i zaniku spalania.
SbCl2+H' Ⴎ SbCl+HCl ; Sb+OH'+M Ⴎ SbOH+M , HCl+H' Ⴎ H2+Cl
Związki fosforanowe.
Fosfor odmiana czerwona w polimerach zawierających tlen - prowadzi do tworzenia usieciowionych struktur poliaromatycznych, które prowadzą do produktu skarbonalizowanego. Na powierzchni polimeru tworzy warstwę ochronną złożoną z poli(kwasów fosforowych) o dużej lepkości. Lotne produkty rozkładu związków fosforowych zalicza się do najbardziej skutecznych inhibitorów spalania.
(C6H5)3POႮPO, P, P2 - różne oznaczenia fosforu
H+PO+H Ⴎ HPO+H ; OH+PO Ⴎ HPO+O ; HPO+H Ⴎ H2+PO
Następuje rekombinacja atomów H w cząsteczki H2.
Związki dające warstwy pęczniejące (piany powierzchniowe) - związki nieorganiczne - mery, które zawierają kwasy nieorganiczne, bądź sole kwasów nieorganicznych. Pod wpływem ciepła związki te rozkładają się tworząc na powierzchni materiału warstwę pęczniejącą zawierającą niepalne gazy. Masy te nie zapalają się lecz zwęglają (żywice mocznikowe, fenolowe, chlorofiny - uwalniają HCl, NH3, tworzy się warstwa węgla na materiale chronionym).
Mechanizm działania:
I etap: rozkład soli nieorganicznych: NH4H2PO4 Ⴎ NH3+H3PO4
II etap: składniki zw. pęcznieją, pod wpływem ciepła zaczynają mięknąć. Powstały kwas powoduje estryfikację zw. alkoholowych: C5H8(OH)4+H3PO4 Ⴎ C5H8OH4ႷH3PO4
III etap: powstały kompleksowy zw. pod wpływem ciepła rozkłada się i powstałe gazy spieniają masę: C5H8OH4ႷH3PO4 Ⴎ H3PO4+H2O+C
IV etap: w tym samym czasie pod wpływem ciepła śr. pianotwórczy rozkłada się i tworzące się gazy spieniają masę.
Własności dobrego środka ogniochronnego:
- stabilny - nie powinien zmieniać swoich własności w czasie
- prosta technologia wprowadzania do polimeru
- bezbarwny
- musi być odporny na działanie światła
- nie może hydrolizować (rozpuszczać się w wodzie)
- musi rozpocząć swoje działanie poniżej temp. rozkładu danego tworzywa
- ani on ani jego produkty rozkładu nie mogą dawać zw. korozyjnych, nie może dawać dużo - dymu ani produktów toksycznych.
Wybiera się antypiren do odpowiedniego tworzywa i do konkretnego zastosowania. Antypiren z innymi dodatkami (plastyfikatory, wypełniacze) muszą mieć własności synergetyczne lub addytywne ale nie antagonistyczne.
Przykładowe zastosowanie środków ogniochronnych:
1) Addytywne: do pianek poliuretanowych, tworzyw poliestrowych, poliamidowych
2) Reaktywne: wszystkie żywice termoutwardzalne, bądź w postaci tlenków, bądź chlorowcopochodnych kwasów organicznych
3) Chlorowcopochodne: środki organiczne - warunek 30Ⴘ70% chlorowca
4) Bromopochodne: bardzo dobre lecz brom jest toksyczny (tetrabromobisfenol A)
5) Fosforowe: tlenki, chlorki, fosfor czerwony, fosfiny, fosforany (do termoplastów)
.............................................................................................................................................
Drewno - konglomerat kilku wielkocząsteczkowych związków organicznych.
1) Węglowodany typu wielocukrów (polisacharydów)
- celuloza (C6H10O5) - 40 Ⴘ 60%
- hemiceluloza - związki niejednolite - 18 Ⴘ 35%
2) Lignina - substancja o charakterze aromatycznym, zawierająca grupy metoksylowe OCH3, karbonylowe CO, wodorotlenowe OH - 26 Ⴘ 30%.
Pod względem funkcjonalnym w drewnie można wyróżnić:
- substancję szkieletową, zbudowaną głównie z celulozy, która nadaje jej dużą wytrzymałość
- lepiszcze reprezentowane głównie przez ligninę
- substancje towarzyszące - żywica, barwniki, garbniki
Obok substancji organicznych w drewnie występują także substancje mineralne, które po spaleniu dają popiół.
Chemiczna budowa drewna:
50% - węgiel; 43% - tlen, 6,1% - wodór, 0,04 Ⴘ 0,26% - azot,
0,30 Ⴘ 1,2% - składniki mineralne
Temperatura rozkładu pod wpływem ciepła:
hemiceluloza - 200 Ⴘ 2600C, celuloza - 240 Ⴘ 3500C, lignina 280 Ⴘ 5000C.
Temperatura przy której następuje zwęglanie powierzchni drewna zależy od szybkości ogrzewania:
- szybkość ogrzewania 200C/min - zwęglanie w temperaturze 1200C
- szybkość ogrzewania 100C/min - zwęglanie w temperaturze 200 Ⴘ 2500C
Cztery główne etapy spalania drewna:
1) do 2000C. W temp. 150 Ⴘ 2000C w produktach rozkładu i utleniania przeważa H2O i
CO2, dlatego nie obserwuje się reakcji spalania.
2) 200 Ⴘ 2800C. W temp. 2000C rozpoczyna się rozkład termiczny hemicelulozy osiągając max. szybkości ubytku masy w temp. 2600C. Początek rozkładu celulozy ma miejsce w temp. 2400C a max. w temp. powyżej 2800C. Częściowo etap 3.
3) 280 Ⴘ 5000C. W temp. ok. 2800C na powierzchni drewna pojawiają się pierwsze pęknięcia, które w miarę wzrostu temp. i zwiększania się warstwy węgla poszerzają się i ułatwiają migrację lotnym produktom rozkładu. Zaczyna rozkładać się lignina. W takich warunkach w produktach pirolizy przeważają niskocząsteczkowe lotne
węglowodory i wodór. Jeśli szybkość emisji produktów lotnych jest wystarczająca do utworzenia mieszaniny, w której składniki palne są w granicach zapalności, wtedy może nastąpić zainicjowanie reakcji spalania. Jest to tzw. płomieniowa faza spalania drewna. Główna masa gazowych produktów rozkładu wydziela się w temp. 200 Ⴘ 4000C.
4) Tworzenie się warstwy węgla zmniejsza szybkość emisji gazów pirolitycznych aż do całkowitego ustania emisji w temp. powyżej 5000C. W temp. 400 Ⴘ 4500C wydziela się mniej niż 1% całkowitej ilości substancji lotnych.
Konsekwencją powyższych zmian jest zanik fazy spalania płomieniowego drewna i przejście w drugą fazę spalania - spalania bezpłomieniowego - (tlenie węgla drzewnego).
Podczas pożarów w czasie spalania drewna 55-60% ciepła wydziela się w fazie spalania płomieniowego a 40-45% w drugiej fazie spalania.
Ponieważ hemiceluloza rozkłada się w najniższej temp. a lignina w najwyższej zatem gatunki które zawierają więcej ligniny są bardziej odporne na działanie ciepła.
Czynniki zewnętrzne wpływające na inicjację reakcji spalania:
- intensywność strumienia cieplnego padającego na drewno i jego zmiana w czasie ogrzewania
- szybkość ogrzewania
- czas oddziaływania strumienia cieplnego
- szybkość przepływu powietrza nad powierzchnią drewna, wielkość powierzchni na który oddziałuje strumień ciepła
Czynniki wewnętrzne wpływające na inicjację reakcji spalania:
- termiczne własności drewna (ciepło właściwe, współczynnik przewodzenia ciepła)
- gęstość
Przewodnictwo cieplne drewna zależy głównie od:
- budowy anatomicznej drewna (iglaste palą się znacznie lepiej niż liściaste)
- gęstości drewna - w miarę wzrostu gęstości rośnie proporcjonalnie przewodnictwo cieplne drewna. Niższe przewodnictwo cieplne - niższa temp. zapłonu (produktów palnych) zapalenia.
Kierunek przebiegu włókien (anizotropia) - przewodnictwa cieplnego drewna polega na tym, że współczynnik przewodnictwa cieplnego jest wzdłuż włókien ok. 1,8 razy większy niż w kierunku prostopadłym do przebiegu włókien.
Wilgotność - przyjmuje się że w przedziale 5 Ⴘ 35% wilgotności wzrost wilgotności o 1% powoduje wzrost przewodnictwa cieplnego o 0,7 Ⴘ 1,8%, średnio o 1,25%.
Temperatura drewna - w miarę wzrostu temp. przewodnictwo cieplne drewna rośnie tym bardziej im większa jest gęstość drewna. Wypełnione powietrzem pory powodują obniżenie przewodnictwa cieplnego. Istotną rolę odgrywa wilgotność drewna. Gdy drewno jest suche wpływ temp. jest niewielki. Inaczej w przypadku drewna wilgotnego.
Szybkość zwęglania - podaje się w [mm/min] i oznacza ile w czasie 1 min powstało węgla. Zależy głównie od gęstości drewna. Gęstość większa - szybkość zwęglania mniejsza.
Wilgoć - jeżeli drewno ma w sobie ponad 60% wilgoci - nie pali się (8-10% - suche drewno).
Płyty wiórowe - wytworzone przez sprasowanie w formach pod ciśnieniem 25 atm. i w temp. 130 Ⴘ 1500C wiórów drzewnych powleczonych koloidalnym roztworem wodnym żywicy termoutwardzalnej. Palność płyt wiórowych zależy od:
- typu żywicy użytej do powlekania
- wykończenia płyt (lakier, laminat)
Własności palne zależą przede wszystkim od masy wiórów nasączonych żywicą a nie od pokrycia laminatem. Płyta wiórowa ma niskie własności termokinetyczne - ma niską kinetykę generacji ciepła.
Płyty pilśniowe - spilśnianie polega na wzajemnym przesuwaniu w kierunku poprzecznym i podłużnym poszczególnych włókien osnowy i wątku w celu ich szczepienia i splątania. Spilśnianie ma na celu zwiększenie gęstości materiału, jego wytrzymałości mechanicznej oraz izolacyjności termicznej. Płyty pilśniowe dzielimy wg gęstości na płyty miękkie (porowate) i twarde (gładkie). Płyta miękka zapala się łatwiej i dłużej się pali niż twarda.
Jest to materiał intensywnie dymiący. Obydwie płyty wykazują zdolność do tlenia szczególnie w stosie.
.............................................................................................................................................
Dym - dyspersyjny układ aerozolowy, składający się z ośrodka gazowego (faza rozpraszająca) i fazy rozproszonej w stanie ciekłym i gazowym.
Tworzenie się dymu:
- spalanie płomieniowe - cząstki stałe sadza, średnica od 10 Ⴘ 100 nm (mikrona)
- spalanie bezpłomieniowe - kropelki smoły i cieczy o wielkości średnicy 1 mikrona
W płomieniu składniki lotne mogą podlegać szeregowi reakcji pirolitycznych, prowadzących do utworzenia molekularnych struktur, takich jak policykliczne węglowodory i poliacetyleny, będących zaczątkami sadzy.
Właściwości dymu zależą od:
- rodzaju ośrodka gazowego
- fazy dyspersyjnej tzw. stężenia liczbowego i masowego, rozmiaru cząstek, pierwotnego kształtu cząsteczek nie zaglomerowanych, stopnia ich agregacji, kształtu agregatów i ładunku elektrycznego cząsteczek.
Stężenie liczbowe dymu - liczba cząstek dymu zawarta w jednostce aerozolu dymowego
![]()
Zdi - liczba czasteczek dymu wytworzonego w czasie rozkładu termicznego i spalania
V - objętość aerozolu dymowego
Stężenie masowe dymu - masa dymu zawarta w jednostce objętości aerozolu dymowego
![]()
W dymie nie występują siły przeciwdziałające łączeniu się cząsteczek między sobą i ciałami makroskopowymi podczas zderzeń, co
Wielkość ładunku powstałego podczas elektryzacji zależy od:
- stopnia rozdrobnienia, im większy stopień dyspersji (rozdrobnienia) tym większy ładunek
- stężenia pyłu - większe stężenie - większy ładunek
- wielkości ruchu mieszaniny pyłowej - szybszy ruch - większy ładunek
- wilgotności powietrza - większa wilgotność - mniejszy ładunek
Aglutynacja - sklejanie się ziaren pyłu w wyniku czego tracą one własności wybuchowe.
Pyły pochodzenia nieorganicznego (siarka, glin, ołów, cynk, chrom, czysty węgiel) - nie rozkładają się podczas ogrzewania w warunkach pożarowych, mają najczęściej duże ၬ.
Dzielimy je na:
- pyły metali - o szybkości spalania decyduje ciepło spalania
- pyły nie metali - o szybkości spalania decyduje czystość pierwiastków np. czysty C (grafit, sadza, pył antracytu) nie wybuchają.
Minimalna objętość fazy lotnej pyłu węglowego wynosi 10%, dla materiałów wybuchowych 25%. Pyły węglowe tworzą mieszaniny hybrydowe (pył węglowy + metan).
Pyły pochodzenia organicznego (węglowodory) - rozkładają się podczas ogrzewania w warunkach pożarowych, dają palną fazę lotną.
Charakterystyka pożarowa pyłów:
1) temp. samozapłonu pyłów - najniższa temp. ziaren pyłu w której ulega on samorzutnemu zapaleniu się płomieniem. Przy samozapłonie dostarczany jest
strumień ciepła (bez płomienia).
2) temp. zapłonu pyłu - najniższa temp. ziarna pyłu przy której produkty rozkładu termicznego tego ziarna zapalają się od płomieniowego źródła ciepła.
3) temp. tlenia pyłu - najniższa temp. pyłu przy której osiadła swobodnie warstwa pyłu ulega zatleniu (nie może być ubita) dotyczy pyłów które się zwęglają podczas ogrzewania a nie topią się.
Pyły pochodzenia nieorganicznego mają na ogół wyższe ၬ (metale) mają wyższą temp. samozapłonu (nie charakteryzują się temp. zapłonu - nie ulegają rozkładowi termicznemu w środowisku pożarowym, charakteryzują się temp. żarzenia - tlenie dotyczy spalania bezpłomieniowego węgla pierwiastkowego).
Pyły pochodzenia organicznego mają małe ၬ, niskie temp. samozapłonu. Wielkość temp. zapłonu pyłów organicznych zależy od struktury chemicznej ziarna pyłu. Temp. tlenia mają pyły pochodzenia organicznego nie będące termoplastycznymi.
Wybuchowość pyłów.
Wybuch - b. szybka reakcja spalania podczas której wydziela się ciepło oraz wykonywana jest praca mechaniczna poprzez rozprężające działanie gazów spalinowych powstałych w wyniku wybuchu. Efektem tej pracy jest poza ciepłem wzrost ciśnienia.
DGW - określa najmniejszą ilość pyłu w mieszaninie z powietrzem przy której zapłon jest już możliwy [g/m3] rzadko w [% obj].
DGW nie jest wielkością stałą dla jednego rodzaju pyłu, lecz zmienia się w zależności od:
- stopnia rozdrobnienia (dyspersji) pyłu
- wilgotności pyłu i powietrza
- substancji lotnych tworzących się podczas rozkładu termicznego, cech inicjatora
wybuchu
- składu i stanu mieszaniny wybuchowej
- max. ciśnienia, które tworzy się podczas wybuchu
- szybkości narastania ciśnienia
- max. stężenia O2 przy którym możliwy jest wybuch
- prędkości rozchodzenia się płomienia w mieszaninie pyłowo-powietrznej
Wybuchają tylko te pyły które można trwale zawiesić w powietrzu.
Zapłon od iskier mechanicznych następuje w wyniku:
- zaistnienia zjawisk mechanicznych
- występowania zatarcia
- wirujące części obcych elementów metalowych (szczególnie skorodowanych).
Zagrożenie wybuchem - tworzenie przez palne pary i pyły w różnych warunkach mieszanin z powietrzem które pod wpływem czynnika inicjującego ulegają gwałtownemu spalaniu połączonemu ze wzrostem ciśnienia czyli wybuchem.
Pomieszczenie zagrożone wybuchem - w którym może wytworzyć się mieszanina wybuchowa powstała z wydzielającej się takiej ilości gazów palnych i pyłów w której przyrost ciśnienia przekracza 5kPa.
.............................................................................................................................................
Materiał wybuchowy - zw. chemiczny lub mieszanina, która pod wpływem zewnętrznych bodźców różnego typu zdolna jest do samorzutnej przemiany przebiegającej z bardzo dużą szybkością z jednoczesnym wydzieleniem dużych ilości ciepła i dużej ilości produktów gazowych. Aby był zdolny do samorzutnej przemiany musi mieć określoną budowę która ma wpływ na ciepło tworzenia danego związku.
Ciepło tworzenia - ilość ciepła którą musimy dostarczyć do układu reagującego aby powstał 1 mol danego związku. W termochemii znakiem „+” oznaczamy przemiany endotermiczne a znakiem „ိ” egzotermiczne.
Związkami niestabilnymi - które są zdolne do samorzutnej przemiany pod wpływem zewnętrznych bodźców energetycznych to te które mają:
- endotermiczne ciepło tworzenia
- egzotermiczny rozkład
- reaktywne grupy w swoim składzie
Grupa reaktywna - która szybko rozpada się i wchodzi w reakcję
-CႺC- aceton
-N=O zw. nitrozowe
2HNO3 Ⴎ H2O Ⴎ N2O5 Ⴎ 2NO2 + -O-
Niestabilnymi grupami są grupy w których tlen występuje z pojedynczymi wartościami a nie podwójnymi. Do takich związków zalicza się:
- wiązanie epoksydowe
- mostek nadtlenowy
- niektóre połączenia azotowe
Tylko te materiały są zdolne do samorzutnej przemiany które mają niskie energie dysocjacji i w związku z tym łatwo ulegają rozkładowi termicznemu. Reakcje samorzutne przebiegają wykorzystując tlen zawarty w swojej strukturze (bez wpływu z zewnątrz).
Reakcje wybuchu materiałów wybuchowych można wywołać następującymi bodźcami:
- cieplnymi (ogrzewanie płomieniem)
- mechanicznymi (uderzenie, tarcie, kucie)
- elektrycznymi (wyładowanie elektryczne)
- wybuchowymi (wybuch innego materiału)
Wrażliwość materiałów wybuchowych - minimalna ilość energii danego bodźca niezbędna do wywołania reakcji wybuchowej.
Ilość ciepła wydzielanego przez materiał wybuchowy jest znacznie mniejsza od ciepła spalania typowych paliw nie będących materiałami wybuchowymi i wynosi 3762 Ⴘ 7254 kJ/kg podczas gdy włókno syntetyczne 10 Ⴘ 12000 kJ/kg.
Wszystkie materiały wybuchowe spalają się kinetycznie.
powoduje jego niszczenie. Znikanie dymu następuje drogą sedymentacji, dyfuzji, koagulacji i wyparowania cząsteczek dymu.
Właściwości optyczne dymu.
Natężenie wiązki światła przechodzącego przez warstwę dymu ulega osłabieniu
I = Io თ exp/ၤL/
Io - natężenie wiązki światła padającego
I - natężenie wiązki światła po przebyciu drogi L w ośrodku absorpcyjnym
ၤ - współczynnik tłumienia
Optyczna gęstość dymu: ![]()
log - dziesiętny
Io - natężenie wiązki światła wchodzącej w dym
I - natężenie wiązki światła po przejściu przez dym
Właściwa gęstość optyczna dymu - gęstość optyczna warstwy dymu o grubości 1m wytworzonego w objętości 1m3 w czasie rozkładu termicznego i spalania materiału o powierzchni 1m2 ![]()
V - objętość komory dymowej, A - powierzchnia próbki,
L - grubość mierzonej warstwy dymu
Masowa gęstość optyczna dymu - gęstość optyczna warstwy dymu o grubości 1m wytworzonego w objętości 1m3 w czasie rozkładu termicznego i spalania 1 kg materiału
![]()
m - ubytek masy próbki w wyniku spalania lub bezpłomieniowego rozkładu termicznego w komorze.
Ilość wydzielonego dymu zależy od:
- budowy chemicznej spalonych związków (więcej węgla - więcej dymu)
- rodzaju spalania (spalanie bezpłomieniowe - zazwyczaj więcej dymu)
- warunków wytwarzania dymu (stężenie O2, gdzie jest materiał - podłoga, ściany)
- zastosowanych środków ogniochronnych
Warunki wytwarzania dymu:
- stężenie O2 w atmosferze
- temperatura otoczenia
- szybkość rozkładu termicznego materiału i czasu zapalenia się produktów tego
rozkładu
- warunki budowlano-instalacyjne w których rozwija się pożar
Współczynnik osłabienia kontrastu jest wielkością charakteryzującą własności dymotwórcze materiału. Zgodnie z definicją współczynnik osłabienia kontrastu to wielkość określająca odwrotność zasięgu widzialności wzorca optometrycznego, obserwowanego przez warstwę dymu o grubości 1m, wytworzonego w obj. 1m3 w czasie rozkładu termicznego i spalania 1 kg masy materiału - inaczej - zmniejszanie kontrastu między tłem przedmiotem i tłem w dymie w określonych warunkach badania. Współczynnik osłabienia kontrastu Y wyznacza się wg wzoru: ![]()
![]()
VK- obj. pomiarowej próbki dymowej, L- grubość warstwy dymu; mp- masa początkowa próbki; L0- luminacja początkowa przedmiotu; L- luminacja przedmiotu; Lt0- luminacja początkowa tła; Lt- luminacja tła.
Szybkość zmian współczynnika kontrastu Y określa przyrost wartości współczynnika kontrastu w jednostce czasu 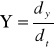
[m2/kg*s].
W zależności od powyższych parametrów materiały dzielimy na:
-o małej intensywności dymienia ![]()
![]()
-o średniej intensywności dymienia![]()
![]()
-o dużej intensywności dymienia ![]()
![]()
-materiały łzawiące - takie których produkty rozkładu termicznego i spalania pozo-stałe w niewielkich ilościach w przewentylowanej komorze (50 wymian powietrza) powodują drażnienie oczu.
.............................................................................................................................................
Pyły - układy dyspersyjne (rozproszone) w której fazą rozproszoną jest ciało stałe a rozpraszającą powietrze (gaz).
Dyspersja - stopień rozdrobnienia pyłów, określa średnicę ziaren tworzących daną mieszaninę pyłową (0,001 Ⴘ 1000 mikrona).
Ze względu na wielkość ziaren pyły dzielimy na:
monodyspersyjne - wszystkie ziarna mają jednakową średnicę
polidyspersyjne - ziarna mają zmienną wielkość
Ze względu na sposób występowania pyłów w warunkach przemysłowych rozróżnia się
- pyły osiadłe, zwane aerożelami - drobne cząstki ciała stałego które zgromadziły się na powierzchni, tworząc warstwę pokrywającą tę powierzchnię (stan statyczny)
pyły zawieszone zwane aerozolami - drobne cząstki ciała stałego zawieszone w powietrzu, tworzące z powietrzem mieszaninę pyłowo-powietrzną (układ dynamiczny)
Ogólne zasady spalania pyłów:
- zależność pyłu od stanu w jakim się znajduje (statyczny, dynamiczny)
- stopień dyspersji pyłu - stopień rozwinięcia przestrzeni międzyfazowej
Analiza możliwości przejścia pyłu ze stanu statycznego w dynamiczny:
- przepływ powietrza
- wilgotność pyłu
- stopień rozdrobnienia
Analiza możliwości przejścia pyłu dynamicznego w stan statyczny:
- zdolność pyłu do sedymentacji
- zdolność ziaren pyłu do elektryzacji
- zdolność do aglutynacji (sklejanie)
Sedymentacja - samorzutne osiadanie pyłu pod wpływem sił grawitacyjnych (średnica ziaren pyłu poniżej 10ၭ)
Własności elektrostatyczne - tworzą się w wyniku ruchów pyłu względem siebie oraz tarcia pyłu o powietrze, im większy jest stan dynamiczny pyłu tym bardziej się elektryzuje i może powstać zapłon chmury jak i samozapłon warstwy pyłu.
Mechanizm przenoszenia wybuchu jest różny i może być:
- wybuch deflagracyjny - mechanizm przenoszenia wybuchu o prędkości poniżej 330 m/s
- wybuch detonacyjny - hydrodynamiczny mechanizm przenoszenia wybuchu o prędkości ponad 330 m/s
- eksplozja - tzn. wybuch o nieustalonej prędkości
Pod względem chemicznym materiały wybuchowe dzieli się na:
- mat. wybuch. będące zw. chemicznymi (reakcje alkoholi z kwasami - najczęściej kwas azotowy, piorunianowy, pikrynowy, rzadziej azydki)
- mieszaniny różnych zw. składających się z 3 różnych części:
Ⴗ cząść palna
Ⴗ flegmatyzator - rola jego polega na spowalnianiu przemiany wybuchowej
Ⴗ stabilizator - rola jego polega na utrzymaniu ściśle określonej szybkości przemiany
Co się dzieje podczas wybuchu materiału wybuchowego
Podczas wybuchu powstała energia zostaje wykorzystana w formie pracy mechanicznej, wykonanej przez rozprężające się gazy, będące produktami wybuchu, ogrzane do wysokiej temperatury i sprężone do bardzo wysokich ciśnień.
Pracę mechaniczną przemiany wybuchowej określa się na podstawie:
- ciepła wybuchu
- objętości i składu produktów lotnych.
Niszczące działanie wybuchu jest powodowane przez:
- rozprężanie się produktów wybuchu odśrodkowo z dużą prędkością, podczas którego powstałe gazy przesuwają otaczające powietrze, czyli wywierają nacisk na otoczenie, co powoduje wzrost ciśnienia,
- powstanie fali uderzeniowej, rozchodzącej się z prędkością naddźwiękową które w miarę wzrostu odległości od miejsca wybuchu stopniowo wytraca energię i przechodzi w falę akustyczną.
Użytkowy podział materiałów wybuchowych:
- materiały wybuchowe kruszące
- materiały wybuchowe miotające
- materiały wybuchowe inicjujące
- masy pirotechniczne
Materiały wybuchowe kruszące - wybuch zachodzi w ośrodku bezpośrednio stykającym się z ładunkiem wybuchowym. Powstała fala swoje działanie burzące dokonuje w pewnej odległości od ładunku. Podczas przemiany wybuchowej ulegają tylko detonacji. Bardzo mała wrażliwość na uderzenia. Największa prędkość detonacji (ponad 9 km/s) i najwyższe ciśnienie fali uderzeniowej (heksogen, tetryt, dynamit, trotyl, nitrogliceryna, TATB, sorgyl, oktogen).
Bardzo duże ilości ciepła oraz duża objętość produktów wybuchu (fala uderzeniowa o ogromnym ciśnieniu na czele - oddziaływanie nadciśnienia). W celu wydłużenia czasu tworzenia tego nadciśnienia dodaje się pyłu aluminiowego.
Pył aluminiowy powoduje:
- wzrost temp. wybuchu o ok. 1000K,
- wzrost koncentracji energii o ok. 3000 kJ/dm3,
- zmniejszenie prędkości detonacji o ok. 1000 m/s,
- zmniejszenie ciśnienia na czole fali detonacyjnej o ok. 5 bar,
- zmniejszenie objętości właściwej produktów wybuchu
Materiały wybuchowe miotające - prochy, które w ogóle nie detonują, tylko spalają się kinetycznie. Dzielimy je na:
- prochy będące mieszaninami różnych związków o działaniu mechanicznym (proch czarny, mocno utlenione NH4KclO4).
- prochy koloidalne (bezdymne) - spalające się bez dymu. Zawierają materiały o dużym stopniu rozdrobnienia, które podczas inicjacji dają chmurę pyłu spalającego się bez dymu.
Materiały wybuchowe inicjujące (detonatory, spłonki) - są to związki lub mieszaniny które są zdolne do wybuchu pod wpływem bardzo słabych bodźców energetycznych np. płomień zapałki, ciepło tarcia, niewielkie uderzenie. Charakteryzują się tym, że po zapaleniu błyskawicznie spalają się kinetycznie i natychmiast przechodzą do detonacji.
Piorunian rtęci - kwas piorunowy HONC Ⴎ H+ + ONC- - Hg(ONC)2 Ⴌ piorunian
Azydek ołowiu - pochodna kwasu azotowodorowego (HN3) - Pb(N3)2
Masy pirotechniczne - mieszaniny różnych związków o następujących własnościach:
a) część palna (pierwiastki S, P, Al., Mg)
b) część utleniająca (sól Bertholeta KclO3)
c) część barwiąca (pierwiastki 2 gr. ukł. okresowego Sr, Cs, Rb, Bar, Cu, Na, K)
Bilans tlenowy (BO) - forma zapisu analitycznego który pokazuje czy dana substancja wybuchowa ma za mało czy za dużo tlenu w stosunku do reakcji jej całkowitego spalania.
Jeżeli tlenu w strukturze materiału wybuchowego jest za mało, wtedy część węgla i wodoru nie spala się obniżając tym samym entalpię spalania materiału.
Jeżeli tlenu w strukturze materiału wybuchowego jest za dużo w stosunku do węgla i wodoru wtedy część tlenu nie zostaje zużyta i materiał wybuchowy staje się bardzo niebezpieczny.
27
Wyszukiwarka