PNOM
kol. 1
Cząstki elementarne
Według współczesnej wiedzy materia jest zbudowana z 6 kwarków i 6 leptonów. Są one
cząstkami elementarnymi niepodzielnymi, wchodzącymi (w grupach lub pojedynczo) w skład innych cząstek materii.
Kwarki to cząstki elementarne, które nie są trwałe samodzielnie, lecz wchodzą w skład innych cząstek po dwa lub trzy. Kwarki są utrzymywane w grupach przez
oddziaływania silne przekazywane przez tzw. gluony - kwanty energii spajające kwarki. Rozróżnia się następujące kwarki: u (up - górny), d (down - dolny), c (charm - powabny), s (strange - dziwny), t (top - wierzchołkowy lub true - prawdziwy), b (beauty - piękny lub bottom - denny) i antykwarki, np. antygórny, antydziwny. Kwarki znacznie różnią
się masą, np. kwark t jest 30000 razy cięższy niż kwark d. Charakteryzuje je ładunek elektryczny oraz liczby kwantowe zapachu i koloru
Nukleony to składniki jądra atomowego. W otaczającej nas materii znaczenie mają dwa kwarki: górny u o ładunku +2/3 i dolny d o ładunku -1/3. Kwarki te wchodzą w skład nukleonów, tj. protonów i neutronów. Proton składa się z 2 kwarków u i 1 kwarka d. Jego ładunek wynosi +1 (2/3 + 2/3 - 1/3). Neutron składa się z 2 kwarków d i 1 kwarka u i jest elektrycznie obojętny (- 1/3 - 1/3 + 2/3 = 0)
Leptony to cząstki elementarne, na które nie wpływają oddziaływania silne.
Cząstki te to elektron e-, mion μ- i tauon τ- (tau) - podlegające oddziaływaniom
elektromagnetycznym i słabym - oraz odpowiadające im neutrina: elektronowe νe,
mionowe νμ i tauonowe ντ - podlegające tylko oddziaływaniom słabym (tabl. 2.2).
Powszechnie występującym leptonem w otaczającej nas materii jest elektron
o ładunku -1.
Atomy
Zakaz Pauliego. W jednym atomie nie może być dwóch elektronów o identycznej kombinacji liczb kwantowych. Maksymalna liczba stanów energetycznych w danej powłoce elektronowej wynosi 2n2.
Wiązanie:
kowalencyjne - chmury elektronów łączą się, stając się wspólnymi dla dwóch atomów; elektrony walencyjne pierwotnie różnych atomów tworzą pary elektronów należące wspólnie do jąder dwóch atomów.
jonowe - gdy brakuje/występuje nadmiar elektronów (różnica ładunków); Gdy elektrony walencyjne jednego atomu elektrododatniego są przyłączane przez drugi atom elektroujemny
metaliczne - atomy oddają elektrony na rzecz całego zbioru; występuje w dużych skupiskach atomów pierwiastków
metalicznych, które po zbliżeniu się na wystarczająco małą odległość, charakterystyczną
dla stałego stanu skupienia, oddają swoje elektrony walencyjne na rzecz całego zbioru atomów. Elektrony walencyjne przemieszczają się swobodnie
Układ okresowy. Pierwiastki chemiczne uporządkowano według wzrastającej liczby atomowej. Pierwiastki o zbliżonych własnościach znajdują się obok siebie w tzw. układzie
okresowym pierwiastków (tabl. 2.6). Układ ten został podzielony na siedem poziomych okresów. W każdym okresie są zgrupowane pierwiastki o stanie energetycznym elektronów w atomach swobodnych opisanych taką samą główną liczbą kwantową. Kolumny pionowe układu, których jest szesnaście, nazwano grupami. Pierwiastki chemiczne należące do tej samej grupy charakteryzują się podobną strukturą podpowłok elektronowych na ostatniej powłoce, co decyduje o zbliżonych własnościach tych pierwiastków.
Materiały.
Polimery. Polimery, nazywane także tworzywami sztucznymi lub plastikami, są materiałami organicznymi, złożonymi ze związków węgla. Polimery są tworzone przez węgiel, wodór i inne pierwiastki niemetaliczne z prawego górnego rogu układu okresowego (rys. 2.8). Polimery są makrocząsteczkami i powstają w wyniku połączenia wiązaniami kowalencyjnymi w łańcuchy wielu grup atomów zwanych monomerami jednego lub kilku rodzajów (rys. 2.9). W skład polimerów wchodzą również dodatki barwników lub pigmentów,
katalizatorów, napełniaczy, zmiękczaczy (plastyfikatorów), antyutleniaczy i innych.
Wiele z polimerów jest giętkich i odkształcalnych, lecz nie nadają się do pracy w podwy-ższonej temperaturze.
Polimery charakteryzują się:
-małą gęstością,
-izolacyjnymi własnościami cieplnymi i elektrycznymi
-słabo odbijają światło i zwykle są przezroczyste.
Ceramika. Ceramikę stanowią materiały nieorganiczne o jonowych i kowalencyjnych
wiązaniach międzyatomowych, wytwarzane zwykle w wysokotemperaturowych procesach związanych z przebiegiem nieodwracalnych reakcji, chociaż do tej grupy materiałów zaliczane są również szkła oraz beton i cement, pomimo że przy ich wytwarzaniu zachodzą nie wszystkie z tych procesów.
Kompozyty. Materiały kompozytowe są połączeniami dwóch lub więcej odrębnych i nierozpuszczających się w sobie faz, z których każda odpowiada innemu podstawowemu
materiałowi inżynierskiemu, zapewniającymi lepszy zespół własności i cech strukturalnych,
od właściwych dla każdego z materiałów składowych oddzielnie. Materiały kompozytowe, dzielą się ze względu na osnowę metalową, polimerową lub ceramiczną.
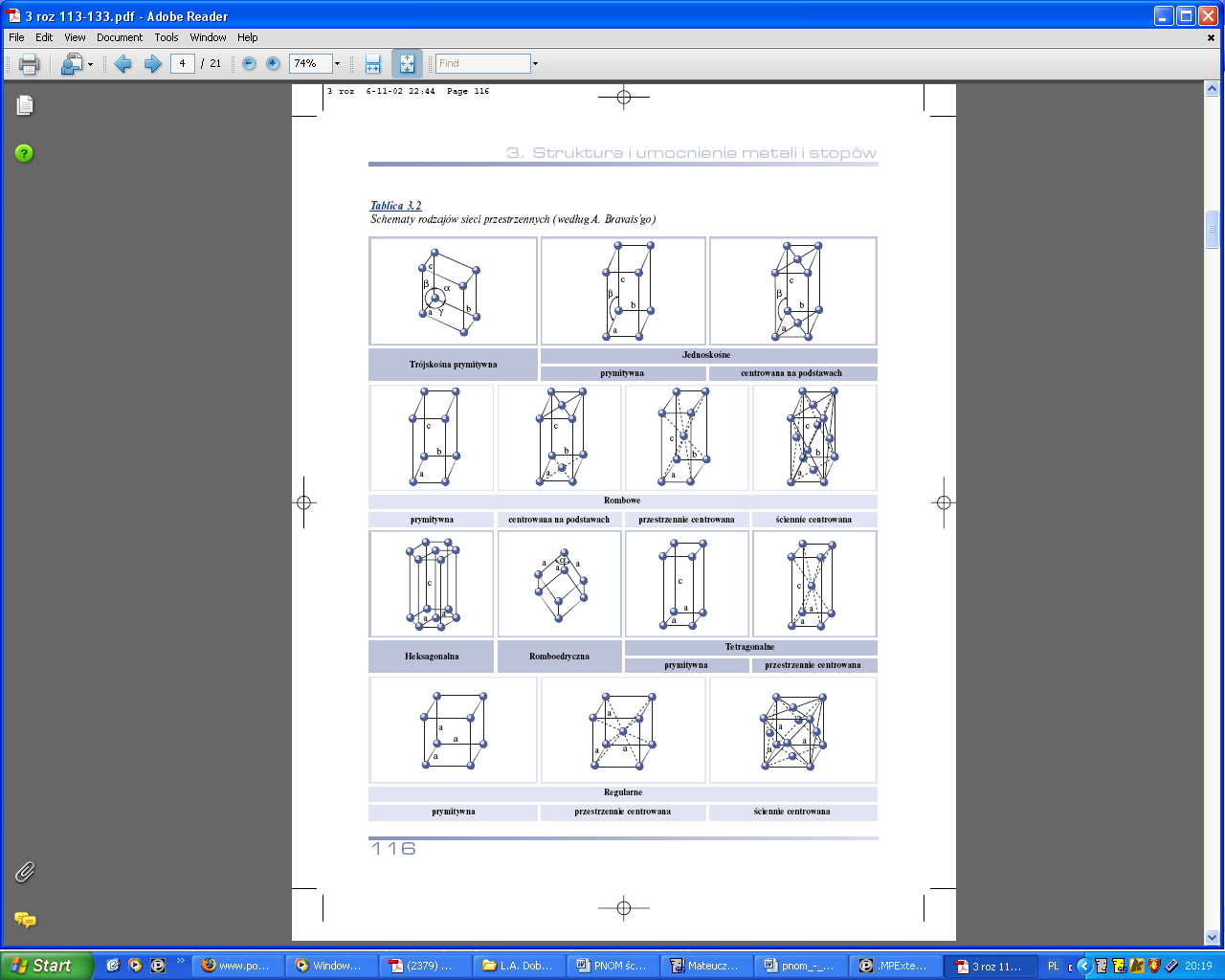
Krystaliczna struktura metali.
Każda prosta łącząca środki dowolnych dwóch atomów w krysztale jest nazywana prostą sieciową. Najbliższa odległość atomów na prostej sieciowej w sieci prymitywnej nosi nazwę parametru sieci. Przesunięcie, tzw. translacja prostej sieciowej, o period identyczności w kierunku różnym od kierunku prostej powoduje znalezienie płaszczyzny sieciowej. Płaszczyzna sieciowa poddana translacjom w kierunku do niej nierównoległym tworzy sieć przestrzenną. Elementami sieci: płaszczyzny sieciowe,
proste sieciowe, będące śladami przecięcia płaszczyzn sieciowych, węzły sieci, stanowiące punkty przecięcia prostych sieciowych; węzły sieci prymitywnej odpowiadają położeniu środków atomów kryształu.
A1- ściennie centrowana. Komórkę tworzy 14 rdzeni atomowych. 8 usytuowanych w narożach, 6 - w środku geometrycznym ścian bocznych sześcianu. Sieć ta należy do najgęściej wypełnionych rdzeniami atomowymi. Liczba koordynacyjna wynosi 12, a liczba rdzeni przypadających na jedna komórkę sieciową - 4. 8 płaszczyzn, 3 kierunki, 12 systemów poślizgu.
A2- przestrzenie centrowana. W komórce tej znajduje się 9 rdzeni atomowych, w tym 8 na narożach sześcianu, jeden zaś w jego środku geom. Liczba koordynacyjna wynosi 8. Liczba rdzeni przypadających na jedna komórkę sieciową - 2. 6 płaszczyzn, 2 kierunki, 12 systemów poślizgu.
A3- heksagonalna. 3 elementarne komórki sieciowe są złożone z 17 rdzeni atomowych, z których 12 znajduje się w narożach prostopadłościanu o podstawie sześciokąta foremnego, 2 - w środku geom. podstaw, a 3 pozostałe są usytuowane symetrycznie we wnętrzu komórki. 2 płaszczyzny, 3 kierunki, 6 systemów poślizgu.
Wady i krystaliczna budowa.
Wakanse i atomy międzywęzłowe - punktowe.
Defektem Schottky'ego, polega na przemieszczaniu się atomu w miejsce sąsiadującego wakansu, w wyniku czego powstaje wakans w innym miejscu sieci.
Defektem Frenkla i polega na przemieszczaniu się rdzenia atomowego z pozycji węzłowej do przestrzeni międzywęzłowej.
Samodyfuzja. Wakanse, utworzone m.in. w wyniku omówionych procesów, mogą się przemieszczać w sieci krystalicznej metalu. W istocie ruch wakansów jest związany z ruchem atomów, opuszczających pozycje węzłowe. Zjawisko przemieszczania się atomów we własnej sieci krystalicznej jest nazywane samodyfuzją.
Dyslokacja krawędziowa. stanowi krawędź ekstrapłaszczyzny, tj. półpłaszczyzny
sieciowej umieszczonej między nieco rozsuniętymi płaszczyznami sieciowymi kryształu
o budowie prawidłowej (rys. 3.13). W zależności od położenia dodatkowej półpłaszczyzny dyslokacje mogą być dodatnie, oznaczane ⊥, lub ujemne. Wokół dyslokacji krawędziowej występuje jednocześnie postaciowe i objętościowe odkształcenie kryształu.
Wektor Burgersa. Wielkość dyslokacji i wywołane nią odkształcenie charakteryzuje wektor Burgersa. Wektor ten wyznacza się tworząc tzw. kontur Burgersa Wykreślony w krysztale idealnym kontur Burgersa zamyka się tworząc równoległobok Gdy w krysztale występuje dyslokacja, czworobok konturu Burgersa wykreślonego wokół linii dyslokacji nie zamyka się Niezależnie od sposobu poprowadzenia konturu Burgersa jego niezamknięta część będzie taka sama i równa wektorowi Burgersa. Dyslokacja krawędziowa ma wektor Burgersa prostopadły do swej linii.
Dyslokacja śrubowa. to defekt liniowy struktury krystalicznej spowodowany przemieszczeniem części kryształu wokół osi, zwanej linią dyslokacji śrubowej Wektor Burgersa dyslokacji śrubowej jest równoległy do jej linii. Wokół dyslokacji śrubowej występuje jedynie postaciowe odkształcenie sieci krystalicznej. Dyslokacje śrubowe mogą być prawoskrętne lub lewoskrętne
Granice międzyfazowe można podzielić na:
koherentne, półkoherentne, niekoherentne.
Międzyfazowe granice koherentne charakteryzują się dobrym dopasowaniem sieci sąsiadujących faz, w przeciwieństwie do granic niekoherentnych. Częściowe dopasowanie wykazują granice półkoherentne, cechujące się występowaniem dyslokacji na granicy.
Szkła metaliczne. W szczególnych przypadkach - po zastosowaniu bardzo dużej szybkości chłodzenia podczas krzepnięcia - metale mogą uzyskiwać strukturę amorficzną,
tj. bezpostaciową. Otrzymane w taki sposób materiały są nazywane szkłami metalicznymi.
Szkło metaliczne, tak jak inne ciała amorficzne, ma strukturę pośrednią między stanem krystalicznym a stanem ciekłym. W szkle metalicznym są uporządkowane jedynie najbliżej sąsiadujące ze sobą atomy. Nie występuje natomiast wówczas pełne prawidłowe rozmieszczenie przestrzenne wszystkich atomów, charakterystyczne dla kryształów. Szkła metaliczne cechują się więc własnościami różnymi od kryształów metali, nie wykazując wszystkich cech dla nich charakterystycznych. Szkła metaliczne powstają w stopach metali z udziałem niemetali, utworzonych z atomów o zróżnicowanych wielkościach, pod warunkiem ochłodzenia cieczy metalowej do temperatury niższej od temperatury zeszklenia, która w przypadku ciał krystalicznych odpowiada temperaturze krystalizacji.
Stopy metali.
Faza międzymetaliczna. są połączeniami metali lub metali z niemetalami i wykazują
własności metaliczne ze względu na częściowy lub całkowity udział wiązania metalicznego między atomami wchodzącymi w skład fazy. Charakterystyczne cechy faz międzymetalicznych opisują cztery zasady: struktura krystaliczna faz międzymetalicznych różni się od struktury każdego ze składników, atomy każdego ze składników wykazują uporządkowane rozmieszczenie w sieci krystalicznej, w oddziaływaniach między atomami występuje przewaga wiązania metalicznego, wzajemne stosunki ilościowe atomów składników rzadko odpowiadają wartościowościom chemicznym pierwiastków, jakie wykazują one w związkach chemicznych, chociaż fazom można przypisać wzory podobne do wzorów związków chemicznych.
Reguła faz Gibbsa, zależność pomiędzy liczbą faz w układzie wielofazowym, a liczbą stopni swobody tego układu: f = k - s + 2,
gdzie: f - liczba faz, k - liczba niezależnych składników, s - liczba stopni swobody.
Na podstawie reguły faz Gibbsa (J.W. Gibbs) i odpowiednich diagramów fazowych można przewidzieć ewolucję układu pod wpływem zmieniających się warunków (parametrów zewnętrznych i składu).
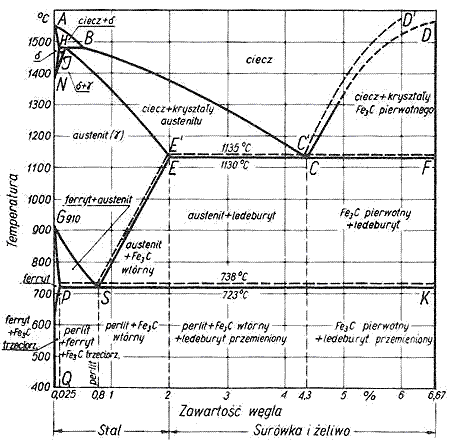
Eutektyk (eutektyka, mieszanina eutektyczna) - mieszanina dwóch lub więcej faz krystalicznych o określonym składzie, która wydziela się z roztworów ciekłych lub stopów w określonej temperaturze, zwanej temperaturą eutektyczną. Jest ona na ogół znacznie niższa od temperatury krzepnięcia czystych składników. Kryształy eutektyku są czystymi kryształami składników lub roztworami stałymi o różnych składach. W tym ostatnim przypadku mówi się o eutektykach roztworów stałych. Eutektyki są stałymi odpowiednikami mieszanin azeotropowych. Przykładem eutektyku jest ledeburyt, który powstaje w układzie żelazo-cementyt przy stałej temperaturze. Przemiana układu żelazo-cementyt zachodzi we wszystkich stopach żelaza z węglem zawierających powyżej 2,11% węgla (żeliwach).
Alotropia - zjawisko występowania różnych odmian krystalograficznych tego samego pierwiastka chemicznego. Alotropia jest szczególnym przypadkiem polimorfizmu czyli różnopostaciowości substancji.
Odmiany alotropowe żelaza:
- α (trwała w temperaturze do 768oC, ma własności ferromagnetyczne),
- β (trwała w temperaturze 768-910°C, paramagnetyczna),
- γ (trwała w temperaturze 910-1400°C),
- δ (trwała w temperaturze powyżej 1400°C).
Polimorfizm (różnopostaciowość) - zjawisko występowania różnych odmian krystalograficznych tej samej substancji. Występuje ono wtedy, gdy ta sama substancja może występować w dwóch lub nawet kilku formach krystalicznych.
Ferryt, roztwór stały węgla w żelazie α. Ferryt jest strukturą niemalże czystego żelaza (zawartość węgla do 0,03 %), powstaje w skutek rozpadu austenitu podczas studzenia stopu. Ferryt jest składnikiem strukturalnym stali i żeliw.
Perlit, składnik strukturalny stopów żelazo-węgiel. Perlit jest mieszaniną eutektoidalną, składającą się z ułożonych na przemian płytek ferrytu i cementytu, powstającą w wyniku rozpadu austenitu w temperaturze 723°C. Po wypolerowaniu i wytrawieniu przypomina masę perłową - stąd nazwa.
Cementyt, węglik żelaza Fe3C, kruchy, odporny chemicznie i bardzo twardy składnik stali i żeliw białych. Do temperatury 2100C wykazuje właściwości ferromagnetyczne, powyżej - paramagnetyczne.
Ledeburyt, stop eutektyczny, składnik strukturalny żeliw i surówek białych (surówka) o eutektyce złożonej z cementytu i austenitu. Ledeburyt wydziela się z ciekłego roztworu żelazo-węgiel (przy zawartości węgla powyżej 2,06%).
Ferromagnetyzm - zjawisko, w którym materia wykazuje własne, spontaniczne namagnesowanie. Jest jedną z najsilniejszych postaci magnetyzmu i jest odpowiedzialny za większość magnetycznych zachowań spotykanych w życiu codziennym. Razem z ferrimagnetyzmem jest podstawą istnienia wszystkich magnesów trwałych (jak i zauważalnego przyciągania innych ferromagnetycznych metali przez magnesy trwałe).
Stal, stop żelaza z węglem (do 2,06% C) i in. pierwiastkami wprowadzonymi w celu uzyskania żądanych własności, najczęściej mechanicznych, technologicznych, elektrycznych, magnetycznych, chemicznych i in., obrabialny plastycznie, otrzymywany w procesach stalowniczych w stanie ciekłym.
Staliwo, stal w postaci lanej w gotowych odlewach budowlanych, maszynowych lub in. W zależności od składu chemicznego rozróżnia się staliwo: węglowe (zawierające do 2% węgla oraz in. pierwiastki pochodzące z przerobu hutniczego) i stopowe (zawierające, oprócz węgla i składników pochodzących z procesu metalurgicznego, składniki stopowe, np. chrom, nikiel, mangan, krzem - wprowadzone w celu uzyskania żądanych własności mechanicznych, technologicznych i in.).
Żeliwo, odlewniczy stop żelaza z węglem (zawartość węgla - 2-4,5%), krzemem, manganem, fosforem, siarką i innymi składnikami, otrzymywany przez stopienie w żeliwiaku surówki wielkopiecowej z dodatkiem złomu żeliwnego i stalowego oraz żelazostopów. W zależności od postaci, w jakiej występuje węgiel rozróżnia się żeliwa: szare (węgiel w postaci grafitu), białe (węgiel w postaci węglika żelaza - cementytu) oraz połowiczne (w pewnych skupieniach węgiel występuje jako grafit, w innych jako cementyt). Dodanie krzemu, niklu i aluminium, jak również powolne chłodzenie sprzyjają wydzielaniu się grafitu, natomiast domieszki manganu i siarki oraz szybkie chłodzenie - tworzeniu się cementytu.
Surówka, produkt redukcji rudy żelaza w wielkim piecu, będący stopem żelaza m.in. z węglem, krzemem, manganem, siarką, fosforem. Można wyróżnić tzw. surówkę białą - gdy węgiel występuje głównie w formie cementytu (Fe3C), twarda lecz trudna do obróbki oraz surówkę szarą - gdy węgiel występuje głównie w formie grafitu, mniej wytrzymała.
2
Wyszukiwarka