Wstęp
Szybkość procesu enzymatycznego zależy od łatwości tworzenia kompleksu enzymu z substratem (powinowactwo enzymu do substratu). Zależność tę przedstawia równanie matematyczne L. Michaelisa i M.L. Menten, zawierające tzw. stałą Michaelisa charakterystyczną dla danego enzymu.
Stała Michaelisa Km to wielkość liczbowa, określająca stężenie substratu (w molach na litr roztworu), przy którym szybkość reakcji enzymatycznej jest równa połowie szybkości maksymalnej, osiąganej przy wysyceniu enzymu substratem i niezależnej już od dalszego wzrostu jego stężenia.
Model Michaelisa - Menten opiera się na następującej koncepcji katalizy enzymatycznej:
Km dla poszczególnych substratów danego enzymu mają różne wartości; prawdopodobnie w żywych komórkach stężenie danego substratu jest bliskie jego wartości Km (10-3 - 10-7), gdyż wówczas szybkość reakcji jest wprost proporcjonalna do stężenia substratu, co ułatwia utrzymanie stałej, właściwej dla komórki wartości tego stężenia.
Szybkość reakcji zależy nie tylko od stężenia enzymu i substratu, lecz także od:
- temperatury (optimum działania enzymu zwykle mieści się w granicach 30-40°C),
- stężenia jonów wodorowych (optymalne pH reakcji jest różne dla różnych enzymów, np. dla pepsyny wynosi 1, dla arginazy — 10)
- obecności enzymatycznych aktywatorów i enzymatycznych inhibitorów.
Istnieje wiele typów cząsteczek , które są zdolne do zakłócania aktywności danego enzymu. Każda cząsteczka działająca bezpośrednio na enzym w kierunku zmniejszenia jego aktywności katalitycznej jest określana jako inhibitor.
Czynniki wpływające na aktywność enzymów - temperatura i pH.
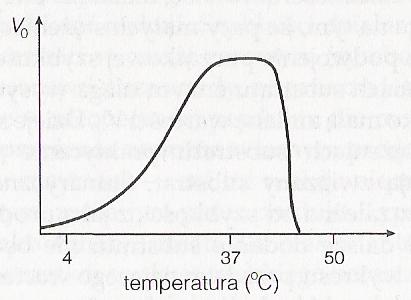
Temperatura - wpływa na szybkość reakcji katalizowanych enzymatycznie w dwojaki sposób. Po pierwsze wzrost temperatury zwiększa energię termiczną cząsteczek substratu. To powoduje zwiększenie proporcji cząsteczek substratu mających dostateczną ilość energii, aby przekroczyć ∆G++ energię aktywacji, a przez to zwiększa szybkość reakcji (energia aktywacji równa jest różnicy w energii swobodnej między stanem przejściowym, a substratem). Równocześnie jednak w wyższych temperaturach ujawnia się drugi efekt; wzrastająca energia termiczna cząsteczek, które tworzą strukturę samego białka enzymatycznego, zwiększa szansę zerwania licznych słabych wiązań niekowalencyjnych (wiązania wodorowe, siły van der Wasala itd.) utrzymujących trójwymiarową strukturę enzymu. W końcowym efekcie będzie to prowadzić do denaturacji (rozfałdowania) enzymu, a nawet małe zmiany trójwymiarowego kształtu enzymu mogą zmienić strukturę miejsca aktywnego i doprowadzić do spadku aktywności katalitycznej. Ostateczny wpływ podwyższenia temperatury na szybkość reakcji enzymatycznej jest wynikiem równowagi między tymi dwoma przeciwnymi działaniami. Dlatego też wykres zależności Vo od temperatury będzie miał kształt krzywej o wyraźnie zaznaczonym optimum termicznym. Dla wielu enzymów ssaków przypada ono na około 37°C, ale istnieją organizmy, których enzymy zaadoptowały się do działania w temperaturach zarówno znacznie wyższych, jak i niższych.
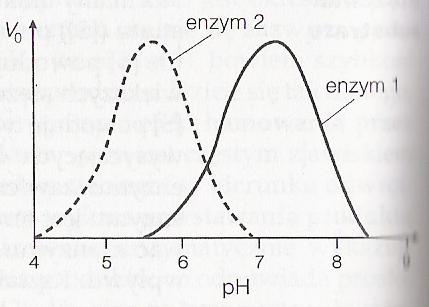
pH - każdy enzym ma optymalne pH działania, w którym szybkość katalizowanej przez niego reakcji jest maksymalna. Małe odchylenia pH od wartości optymalnej powodują spadek aktywności, wywołany zmianami jonizacji grup w aktywnym miejscu enzymu. Większe odchylenia pH prowadzą do denaturacji samego białka enzymatycznego w wyniku zakłócania licznych słabych oddziaływań niekowalencyjnych, utrzymujących trójwymiarową strukturę białka. Wykres Vo jako funkcji pH daje zazwyczaj krzywą o kształcie dzwonu. Wiele enzymów wykazuje optimum aktywności w pobliżu pH 6,8, ale ogólnie istnieje duże zróżnicowanie optimum pH enzymów, wywołane różnicami środowiska, w którym enzymom przyszło działać. Na przykład enzym trawienny pepsyna jest przystosowany do działania w kwaśnym pH żołądka
(około pH 2,0).
Co to jest allosteria? Podaj przykład enzymu allosterycznego i wymień jego efektory.
Allosteria - zmiana konformacji łańcuchów polipeptydowych dużych cząsteczek białka pod wpływem przyłączenia małej cząsteczki substratu.
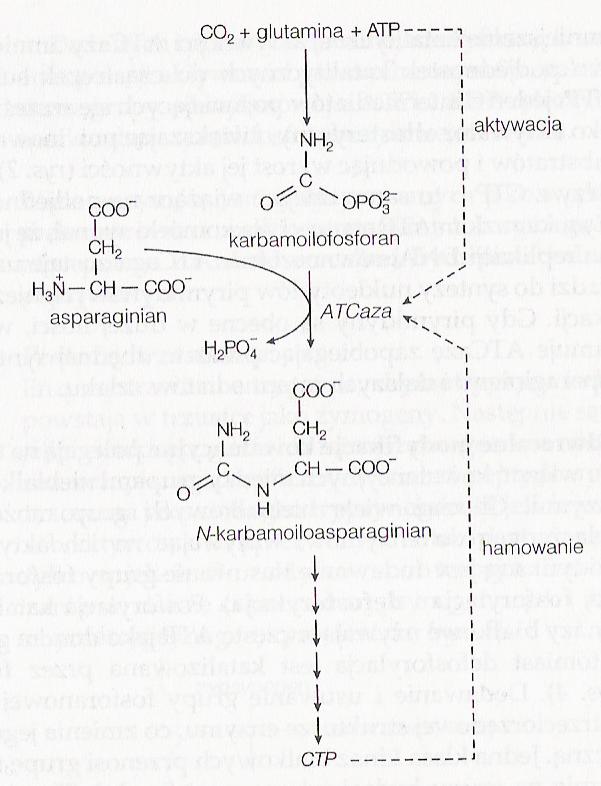
Oprócz enzymów z jednym centrum aktywnym mamy także enzymy allosteryczne. Są to związki mające więcej niż jedno miejsce aktywne, które to miejsca kooperatywnie wiążą cząsteczki substratu, dzięki czemu związanie substratu w jednym miejscu aktywnym indukuje w enzymie zmianę konformacyjną, zmieniającą powinowactwo do substratu w innych miejscach aktywnych. Ten typ enzymów może występować w formie białka złożonego z wielu podjednostek, z których każda ma miejsce aktywne. Poza tym enzymy allosteryczne mogą być kontrolowane przez cząsteczki efektorowe (aktywatory i inhibitory), które wiążą się do innych miejsc niż miejsca aktywne i zmieniają szybkość aktywności enzymatycznej.
Regulacja allosteryczne (ATCazy)
Karbamoilotransferazy asparaginowej
Zymogeny
Zymogeny, proenzymy - nieaktywne formy enzymów, nieczynne prekursory enzymów, głównie proteolitycznych preteazy, ulegające aktywacji najczęściej z udziałem innego enzymu, w efekcie jedno- lub kilkustopniowej hydrolizy wiązań peptydowych; dotyczy to szczególnie enzymów trawiennych, pepsyny, trypsyny i chymotrypsyny oraz innych białek, np. insuliny i kolagenu; przedwczesna aktywacja proenzymów trawiennych powoduje ostre zapalenie trzustki.
Inhibicja
Istnieje wiele typów cząsteczek , które są zdolne do zakłócania aktywności danego enzymu. Każda cząsteczka działająca bezpośrednio na enzym w kierunku zmniejszenia jego aktywności katalitycznej jest określana jako inhibitor.
Pewne inhibitory enzymów są normalnymi metabolitami komórkowymi, które hamują dany enzym w ramach naturalnej metabolicznej kontroli odpowiedniego szlaku. Inne inhibitory mogą być substancjami obcymi dla organizmu, takimi jak toksyny i leki, i w tym przypadku hamowanie enzymu może mieć działanie terapeutyczne , ale również letalne.
Rozróżnia się dwa główne typu inhibicji :
- nieodwracalną
- odwracalną
Inhibicję odwracalną można podzielić na:
Kompetycyjną
Niekompetycyjną
Inhibicja nieodwracalna polega na wiązaniu się inhibitora i enzymu w sposób trwały , nieodwracalny, często tworząc wiązania kowalencyjne z resztami aminokwasów, znajdującymi się w miejscu aktywnym lub jego pobliżu i w ten sposób inaktywują enzym na stałe. W wiązaniu tym biorą udział reszty Ser i Cys mające, odpowiednio, reaktywne grupy -OH i -SH .
struktura i mechanizm działania DIPF (diizopropylofluorofosforanu)
struktura i mechanizm działania amidu kwasy jodooctowego.
Inhibitor kompetycyjny jest zazwyczaj strukturalnie podobny do normalnego substratu danego enzymu. Dzięki temu współzawodniczy z cząsteczkami o wiązanie się z miejscem aktywnym. Enzym może się wiązać albo z cząsteczkę substratu, albo cząsteczkę inhibitora, ale nie z obiema jednocześnie. Inhibitor kompetycyjny wiąże się z miejscem aktywnym odwracalnie.
Przy dużych stężeniach substratu działanie inhibitora kompetucyjnego zostaje przezwyciężone , ponieważ duże stężenie substratu będzie z powodzeniem współzawodniczyć z cząsteczką inhibitora o wiązanie się w miejscu aktywnym. Nie nastąpi więc żadna zmiana w wartości Vmax enzymu , ale w obecności inhibitora kompetycyjnego zmniejsza się powinowactwo enzymu do jego substratu i dlatego wratośc Km wzrasta.
Inhibitor niekompetycyjny wiąże się odwracalnie w innym miejscu enzymu niż jego miejsce aktywne i powoduje zmianę przestrzennego kształtu enzymu, co prowadzi do zmniejszenia aktywności katalitycznej. Ponieważ inhibitor wiąże się w innym miejscu niż substrat, enzym może wiązać albo inhibitor, albo substrat równocześnie.
Efektu inhibitora niekompetycyjnego nie można przezwyciężyć przez zwiększanie stężenia substratu i dlatego zmniejsza się wartość Vmax . W inhibicji niekompetycyjnej powinowactwo enzymu do substratu pozostaje nie zmienione, a więc wartość Km nie zmienia się .
Przykładem inhibicji niekompetycyjnej jest działanie pepstatyny na enzym reninę .
Inhibitor niekompetycyjny wiąże się w miejscu odmiennym od miejsca aktywnego,
Enzym może wiązać albo substrat, albo inhibitor niekompetycyjny, albo oba naraz,
Wykres kinetyki enzymu w układzie współrzędnych, które są odwrotnościami V i [S], ukazujący wpływ inhibitora niekompetycyjnego na wartość Km oraz Vmax.
Enzymy wykazują rozmaitą swoistość katalitycznego oddziaływania na substraty. Niektóre reagują tylko z jednym związkiem, inne są mniej swoiste i działają na określoną grupę związków; swoistość enzymu zależy od budowy substratu, który musi zawierać wiązanie ulegające atakowi danego enzymu oraz grupę funkcyjną (lub grupy funkcyjne) umożliwiającą odpowiednie połączenie się enzymu z substratem i zapoczątkowanie katalizowanej reakcji.
Enzymy wykazują także swoistość przestrzenną: działają tylko na jeden z możliwych stereoizomerów i syntetyzują asymetrycznie (np. tylko L-aminokwasy czy tylko b-glikozydy).
Wyszukiwarka