1. Część teoretyczna.
ogniwo elektrochemiczne - układ w którym wymiana elektronów pomiędzy reagentami zachodzi poprzez przewodnik zamykający obwód między elektrodami.
SEM ogniwa (siła elektromotoryczna) - jest to potencjał elektrostatyczny drutu przyłączonego do elektrody znajdującej się na schemacie ogniwa po stronie prawej, mierzony w stanie równowagi względem potencjału drutu z tego samego metalu, przyłączonego do elektrody lewej.
potencjał standardowy elektrody - jest to siła elektromotoryczna ogniwa zbudowanego w taki sposób, że lewym półogniwem jest standardowa elektroda wodorowa, a prawym badana elektroda. W związku z tym, że wartość potencjału standardowej elektrody wodorowej została przyjęta jako wzorcowa, równa zero, to mierzona siła elektromotoryczna jest równa potencjałowi standardowemu elektrody badanej
równanie Nernsta
![]()
gdzie:
![]()
- bezwzględna wartość współczynnika stechiometrycznego elektronów w równaniach połówkowych.
K - stała równowagi reakcji, K=f(T,p)
![]()
- aktywność danego składnika podniesiona do potęgi równej co do wartości współczynnikowi stechiometrycznemu tego składnika.
F - stała Faradaya, ![]()
W doświadczeniu wykorzystuje się pH -metr, którego głównym elementem jest ogniwo, zbudowane z elektrody szklanej i kalomelowej.
2. Cześć eksperymentalna.
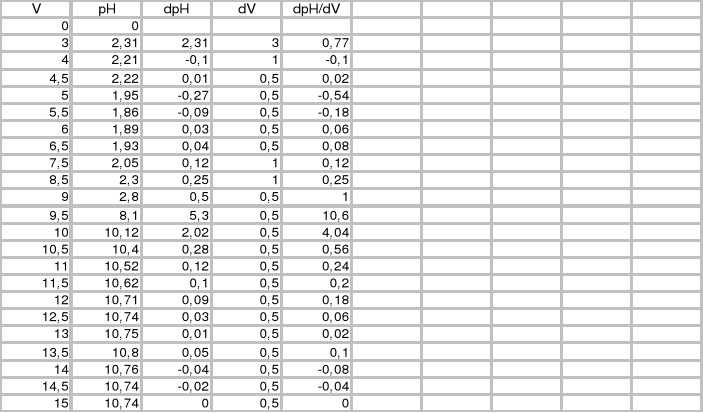
V [cm3] |
pH |
V [cm3] |
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V [cm3] |
pH |
V [cm3] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Opracowanie wyników.
Wykres I
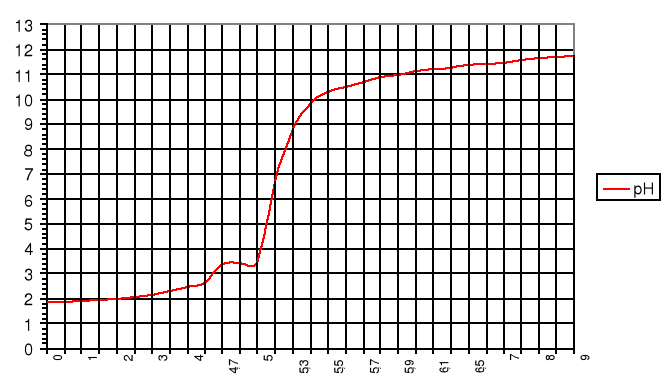
Wykres zależności pH mocnego kwasu od objętości dodanej zasady:
![]()
Wykres II
Wykres zależności ![]()
![]()
Punkt równoważnikowy (pH=7,0), VNaOH=9,4 cm3
Obliczenie liczby gramorównoważników kwasu w próbce:
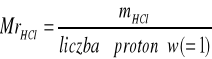
Obliczenie masy HCl w próbce:
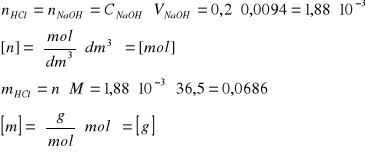
Właściwe obliczenie liczby gramorównoważników w próbce:
![]()
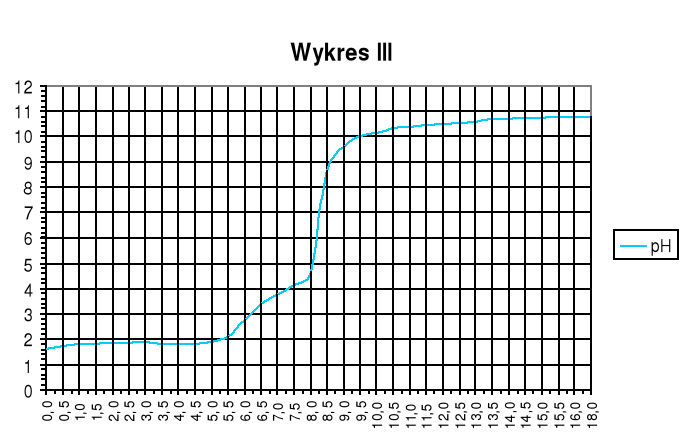
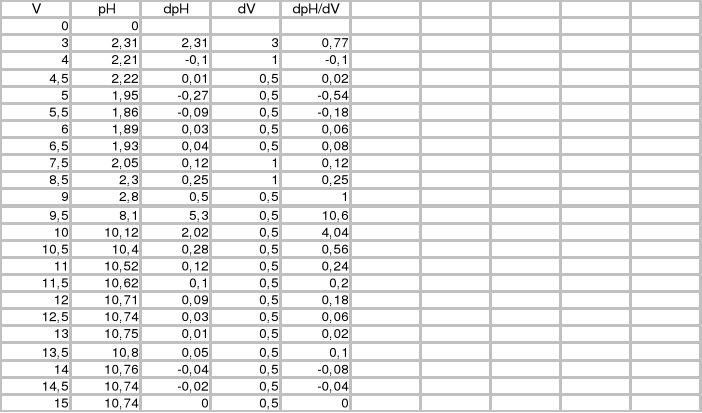
Wykres III
Wykres zależności pH mieszaniny kwasów mocnego i słabego od objętości dodanej zasady:
![]()
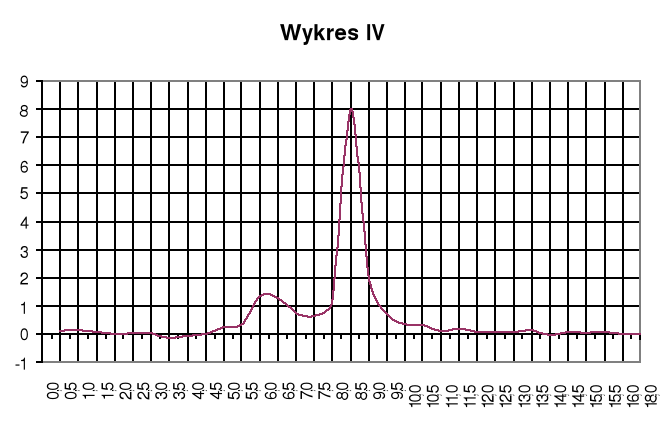
Wykres IV
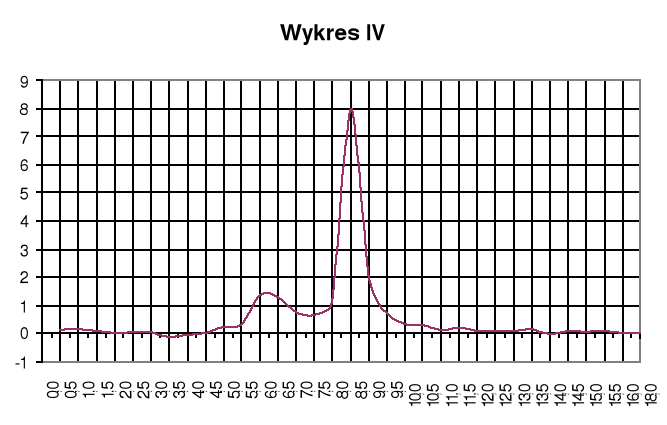
Wykres zależności ![]()
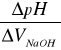
![]()
Punkty równoważnikowe:
zobojętnienie HCl: pH=3,2; VNaOH=6,25cm3
zobojętnienie CH3COOH: pH=7,0; VNaOH=8,25cm3
Obliczenie liczby gramorównoważników kwasów w próbce:
a) HCl
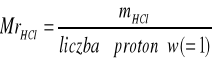
Obliczenie masy HCl w próbce:
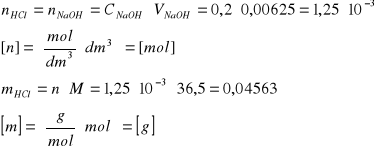
Właściwe obliczenie liczby gramorównoważników w próbce:
![]()
b) CH3COOH
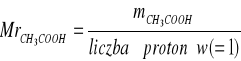
Obliczenie masy HCl w próbce:
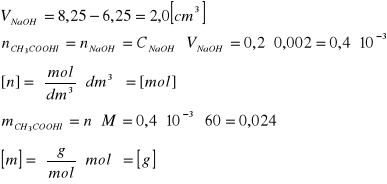
Właściwe obliczenie liczby gramorównoważników w próbce:
![]()
4. Wnioski.
Metodą miareczkowania pehametrycznego wyznaczyć można zarówno stężenie pojedynczego kwasu, jak również stężenie kwasów słabego i mocnego w mieszaninie W przypadku miareczkowania mieszaniny słabego i mocnego kwasu konieczne jest dodanie acetonu, ze względu na istnienie zjawiska rozdziału słabego kwasu organicznego między fazę wody i acetonu. Ma to na celu częściowy rozdział mieszaniny kwasów, w wyniku czego można wyznaczyć dwa punkty równoważnikowe.
![]()
I roztwór
II roztwór
pH
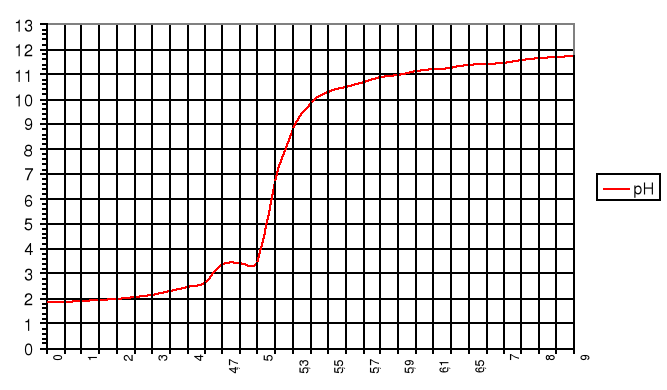
V [cm3]
![]()
![]()
![]()
![]()
![]()
V [cm3]
pH
![]()
![]()
Wyszukiwarka