Cel ćwiczenia:
Celem ćwiczenia było
zapoznanie się z metodą potencjometrycznego pomiary pH
zapoznać się z wykreślaniem krzywych miareczkowania mocnego kwasu mocną zasadą oraz słabego kwasu mocną zasadą
wyznaczenie na ich podstawie punktu równoważnikowego
obliczenie wartości pH w czasie miareczkowania mocnego kwasu mocną zasadą.
Wykonanie ćwiczenia:
co - stężenie octanu sodowego
c - stężenie kwasu octowego
Wyniki miareczkowania HCl i NaOH o stężeniach 0,1 mol/dm3.
Kolejnym zadaniem było wyznaczenie punktu równoważnikowego metodą potencjometryczną poprzez miareczkowanie słabego kwasu 0,1 mol (CH3COOH) silną zasadą 1 mol (NaOH). Wyniki przedstawione zostały w
Porównanie wyników doświadczalnych oraz teoretycznych pomiaru pH.
VNaOH, VHcl - odpowiednio objętość zasady i kwasu przy miareczkowaniu
Czasady,Ckwasu - odpowiednio stężenie zasady i kwasu
Wnioski do sprawozdania:
fenoloftaleina o zakresie pH 8,1 - 10
błękit tymolowy o zakresie pH 8 - 9,6
Wykonanie ćwiczenie składało się z dwóch części :i
A) należało przy pomocy pH-metru zmierzyć wartość pH kilku buforów, a więc wykalibrować pH-metr.
Lp. |
Wartość doświadczalna [pH] |
Bufor |
Wartość teoretyczna [pH] |
1 |
6,04 |
NaHPO4 - C6H8O7 *H2O |
6 |
2 |
8,02 |
NaHPO4 - C6H8O7 *H2O |
8 |
pH - metr był obarczony błędem pomiarowym Δ pH=± 0,05 tzn. że przyrząd wskazywał prawidłowe wartości.
B) - w kolejnym etapie doświadczenia należało sporządzić roztwory buforowe o określonym stężeniu w następujący sposób :
Bufor 1 - 0,1 M CH3COOH ORAZ 0,1 M NaOH
(5 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 40 [cm3] H2O)
Bufor 2 - 0,2 M CH3COOH ORAZ 0,1 M NaOH
(10 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 35 [cm3] H2O)
Bufor 3 - 0,3 M CH3COOH ORAZ 0,1 M NaOH
(15 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 30 [cm3] H2O)
Bufor 4 - 0,4 M CH3COOH ORAZ 0,1 M NaOH
(20 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 25 [cm3] H2O)
Bufor 5 - 0,5 M CH3COOH ORAZ 0,1 M NaOH
(25 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 20 [cm3] H2O)
Bufor 6 - 0,1M CH3COOH ORAZ 0,1 M NaOH + 0,03 M HCl
( 5 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 1,5 [cm3] 1M HCl + 38,5 [cm3] H2O )
Bufor 7 - 0,1M CH3COOH ORAZ 0,1M NaOH + 0,03M NaOH
( 5 [cm3] 1M CH3COOH + 5 [ cm3] 1M CH3COONa + 1,5 [cm3] 1M NAOH + 38,5 [cm3] H2O )
Tak wykonane bufory zostały zmierzone pH-metrem wyniki umieszczone są w
Tabeli nr1 :
Bufor |
C CH3COOH |
C CH3COONa |
C HCl |
C NaOH |
pH - obliczone |
pH - zmierzone |
1 |
0,1 |
0,1 |
|
|
4,76 |
4.62 |
2 |
0,2 |
0,1 |
|
|
4,46 |
4.32 |
3 |
0,3 |
0,1 |
|
|
4,28 |
4.20 |
4 |
0,4 |
0,1 |
|
|
4,15 |
4.07 |
5 |
0,5 |
0,1 |
|
|
4,06 |
3.96 |
6 |
0,1 |
0,1 |
0,03 |
|
4.48 |
4.31 |
7 |
0,1 |
0,1 |
|
0,03 |
5.06 |
4.99 |
Obliczenia dokonano według wzoru:
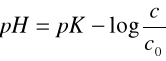
gdzie:
Tabela nr2
|
|
Pierwsza pochodna |
|
Druga pochodna |
|
|
Ml NaOH |
pH |
delta V NaOH |
delta pH |
deltapH/deltaV |
V NaOH |
d^2pH/dV^2 |
0 |
1,28 |
0 |
|
|
|
|
5 |
1,33 |
5 |
0,05 |
0,01 |
0 |
|
10 |
1,41 |
5 |
0,08 |
0,02 |
5 |
0,00E+00 |
15 |
1,47 |
5 |
0,06 |
0,01 |
10 |
-8,00E-04 |
20 |
1,57 |
5 |
0,1 |
0,02 |
15 |
1,60E-03 |
25 |
1,67 |
5 |
0,1 |
0,02 |
20 |
-9,02E-18 |
30 |
1,98 |
5 |
0,31 |
0,06 |
25 |
8,40E-03 |
35 |
2,12 |
5 |
0,14 |
0,03 |
30 |
-6,80E-03 |
35,5 |
2,17 |
0,5 |
0,05 |
0,10 |
35 |
1,44E-02 |
36 |
2,21 |
0,5 |
0,04 |
0,08 |
35,2 |
-4,00E-02 |
36,5 |
2,29 |
0,5 |
0,08 |
0,16 |
35,4 |
1,60E-01 |
37 |
2,35 |
0,5 |
0,06 |
0,12 |
35,6 |
-8,00E-02 |
37,5 |
2,49 |
0,5 |
0,14 |
0,28 |
35,8 |
3,20E-01 |
38 |
2,59 |
0,5 |
0,1 |
0,20 |
36 |
-1,60E-01 |
38,5 |
2,78 |
0,5 |
0,19 |
0,38 |
36,2 |
3,60E-01 |
39 |
2,99 |
0,5 |
0,21 |
0,42 |
36,4 |
8,00E-02 |
39,5 |
3,65 |
0,5 |
0,66 |
1,32 |
36,6 |
1,80E+00 |
39,7 |
3,93 |
0,2 |
0,28 |
1,40 |
36,8 |
1,60E-01 |
40 |
5,92 |
0,3 |
1,99 |
6,63 |
37 |
2,62E+01 |
40,1 |
6,16 |
0,1 |
0,24 |
2,40 |
37,2 |
-1,41E+01 |
40,2 |
6,55 |
0,1 |
0,39 |
3,90 |
37,4 |
1,50E+01 |
40,3 |
7,95 |
0,1 |
1,4 |
14,00 |
37,6 |
1,01E+02 |
40,4 |
8,8 |
0,1 |
0,85 |
8,50 |
37,8 |
-5,50E+01 |
40,5 |
9,12 |
0,1 |
0,32 |
3,20 |
38 |
-5,30E+01 |
40,6 |
9,7 |
0,1 |
0,58 |
5,80 |
38,2 |
2,60E+01 |
40,7 |
9,98 |
0,1 |
0,28 |
2,80 |
38,4 |
-3,00E+01 |
40,8 |
10,06 |
0,1 |
0,08 |
0,80 |
38,6 |
-2,00E+01 |
40,9 |
10,23 |
0,1 |
0,17 |
1,70 |
38,8 |
9,00E+00 |
41 |
10,39 |
0,1 |
0,16 |
1,60 |
39 |
-1,00E+00 |
41,5 |
10,8 |
0,5 |
0,41 |
0,82 |
39,2 |
-7,80E+00 |
42 |
11,02 |
0,5 |
0,22 |
0,44 |
39,4 |
-7,60E-01 |
42,5 |
11,25 |
0,5 |
0,23 |
0,46 |
39,6 |
4,00E-02 |
43 |
11,32 |
0,5 |
0,07 |
0,14 |
39,8 |
-6,40E-01 |
43,5 |
11,39 |
0,5 |
0,07 |
0,14 |
40 |
0,00E+00 |
44 |
11,48 |
0,5 |
0,09 |
0,18 |
40,2 |
8,00E-02 |
44,5 |
11,55 |
0,5 |
0,07 |
0,14 |
45 |
-8,00E-02 |
45 |
11,57 |
0,5 |
0,02 |
0,04 |
45 |
-2,00E-01 |
46 |
11,58 |
1 |
0,01 |
0,01 |
45 |
-6,00E-02 |
47 |
11,59 |
1 |
0,01 |
0,01 |
45 |
0,00E+00 |
48 |
11,6 |
1 |
0,01 |
0,01 |
45 |
0,00E+00 |
49 |
11,62 |
1 |
0,02 |
0,02 |
45 |
1,00E-02 |
50 |
11,62 |
1 |
0 |
0,00 |
45 |
-2,00E-02 |
Tabeli nr 3
|
|
Pierwsza pochodna |
|
Druga pochodna |
|
|
ml NaOH |
pH |
delta V NaOH |
delta pH |
deltapH/deltaV |
V NaOH |
d^2pH/dV^2 |
0 |
3,25 |
|
|
|
|
|
5 |
3,91 |
5 |
0,66 |
0,132 |
5 |
0,0E+00 |
10 |
4,31 |
5 |
0,4 |
0,08 |
10 |
-1,0E-02 |
15 |
4,59 |
5 |
0,28 |
0,056 |
15 |
-4,8E-03 |
20 |
4,88 |
5 |
0,29 |
0,058 |
20 |
4,0E-04 |
25 |
5,18 |
5 |
0,3 |
0,06 |
25 |
4,0E-04 |
30 |
5,72 |
5 |
0,54 |
0,108 |
30 |
9,6E-03 |
31 |
6,12 |
1 |
0,4 |
0,4 |
30,2 |
5,8E-02 |
32 |
6,5 |
1 |
0,38 |
0,38 |
30,4 |
-2,0E-02 |
32,1 |
6,54 |
0,1 |
0,04 |
0,4 |
36,8 |
2,0E-02 |
32,2 |
6,69 |
0,1 |
0,15 |
1,5 |
41,1 |
1,1E+01 |
32,3 |
6,74 |
0,1 |
0,05 |
0,5 |
45,4 |
-1,0E+01 |
32,4 |
6,8 |
0,1 |
0,06 |
0,6 |
49,7 |
1,0E+00 |
32,5 |
6,89 |
0,1 |
0,09 |
0,9 |
54,1 |
3,0E+00 |
32,6 |
6,93 |
0,1 |
0,04 |
0,4 |
58,4 |
-5,0E+00 |
32,7 |
7,12 |
0,1 |
0,19 |
1,9 |
58,6 |
1,5E+01 |
32,8 |
7,44 |
0,1 |
0,32 |
3,2 |
62,7 |
1,3E+01 |
32,9 |
8,07 |
0,1 |
0,63 |
6,3 |
67,0 |
3,1E+01 |
33 |
9,22 |
0,1 |
1,15 |
11,5 |
71,3 |
5,2E+01 |
33,1 |
10,12 |
0,1 |
0,9 |
9 |
71,5 |
-2,5E+01 |
33,2 |
10,4 |
0,1 |
0,28 |
2,8 |
71,7 |
-6,2E+01 |
33,3 |
10,52 |
0,1 |
0,12 |
1,2 |
71,9 |
-1,6E+01 |
33,4 |
10,61 |
0,1 |
0,09 |
0,9 |
72,1 |
-3,0E+00 |
33,5 |
10,72 |
0,1 |
0,11 |
1,1 |
72,3 |
2,0E+00 |
33,6 |
10,79 |
0,1 |
0,07 |
0,7 |
72,5 |
-4,0E+00 |
33,7 |
10,87 |
0,1 |
0,08 |
0,8 |
72,7 |
1,0E+00 |
33,8 |
10,91 |
0,1 |
0,04 |
0,4 |
72,9 |
-4,0E+00 |
33,9 |
10,99 |
0,1 |
0,08 |
0,8 |
73,1 |
4,0E+00 |
34 |
11,03 |
0,1 |
0,04 |
0,4 |
73,3 |
-4,0E+00 |
34,5 |
11,2 |
0,5 |
0,17 |
0,34 |
73,5 |
-6,0E-01 |
35 |
11,36 |
0,5 |
0,16 |
0,32 |
73,7 |
-4,0E-02 |
36 |
11,53 |
1 |
0,17 |
0,17 |
73,9 |
-3,0E-01 |
37 |
11,58 |
1 |
0,05 |
0,05 |
74,1 |
-1,2E-01 |
38 |
11,7 |
1 |
0,12 |
0,12 |
74,3 |
7,0E-02 |
39 |
11,82 |
1 |
0,12 |
0,12 |
74,5 |
1,8E-15 |
40 |
11,88 |
1 |
0,06 |
0,06 |
74,7 |
-6,0E-02 |
Obliczenia zostały dokonane za pomocą wzorów:
a)przed punktem równoważnikowym
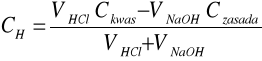
b)po punkcie równoważnikowym
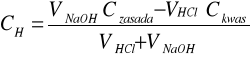
Gdzie:
Wyniki zestawione zostały w tabeli nr 4 :
Tabela nr 4
V NaOH [ml] |
V HCl [ml] |
C HCl |
C NaOH |
pH dośw |
Licznik |
Mianownik |
[H+] |
Ph teor |
|
0 |
40 |
0,1 |
0,1 |
1,28 |
4 |
40 |
0,1000 |
1,00 |
|
5 |
40 |
0,1 |
0,1 |
1,33 |
3,5 |
45 |
0,0778 |
1,11 |
|
10 |
40 |
0,1 |
0,1 |
1,41 |
3 |
50 |
0,0600 |
1,22 |
|
15 |
40 |
0,1 |
0,1 |
1,47 |
2,5 |
55 |
0,0455 |
1,34 |
|
20 |
40 |
0,1 |
0,1 |
1,57 |
2 |
60 |
0,0333 |
1,48 |
|
25 |
40 |
0,1 |
0,1 |
1,67 |
1,5 |
65 |
0,0231 |
1,64 |
|
30 |
40 |
0,1 |
0,1 |
1,98 |
1 |
70 |
0,0143 |
1,85 |
|
35 |
40 |
0,1 |
0,1 |
2,12 |
0,5 |
75 |
0,0067 |
2,18 |
|
35,5 |
40 |
0,1 |
0,1 |
2,17 |
0,45 |
75,5 |
0,0060 |
2,22 |
|
36 |
40 |
0,1 |
0,1 |
2,21 |
0,4 |
76 |
0,0053 |
2,28 |
|
36,5 |
40 |
0,1 |
0,1 |
2,29 |
0,35 |
76,5 |
0,0046 |
2,34 |
|
37 |
40 |
0,1 |
0,1 |
2,35 |
0,3 |
77 |
0,0039 |
2,41 |
|
37,5 |
40 |
0,1 |
0,1 |
2,49 |
0,25 |
77,5 |
0,0032 |
2,49 |
|
38 |
40 |
0,1 |
0,1 |
2,59 |
0,2 |
78 |
0,0026 |
2,59 |
|
38,5 |
40 |
0,1 |
0,1 |
2,78 |
0,15 |
78,5 |
0,0019 |
2,72 |
|
39 |
40 |
0,1 |
0,1 |
2,99 |
0,1 |
79 |
0,0013 |
2,90 |
|
39,5 |
40 |
0,1 |
0,1 |
3,65 |
0,05 |
79,5 |
0,0006 |
3,20 |
|
39,7 |
40 |
0,1 |
0,1 |
3,93 |
0,03 |
79,7 |
0,0004 |
3,42 |
|
40 |
40 |
0,1 |
0,1 |
5,92 |
0 |
80 |
0,0000 |
7,00 |
|
40,1 |
40 |
0,1 |
0,1 |
6,16 |
0,01 |
80,1 |
0,0001 |
10,10 |
|
40,2 |
40 |
0,1 |
0,1 |
6,55 |
0,02 |
80,2 |
0,0002 |
10,40 |
|
40,3 |
40 |
0,1 |
0,1 |
7,95 |
0,03 |
80,3 |
0,0004 |
10,57 |
|
40,4 |
40 |
0,1 |
0,1 |
8,8 |
0,04 |
80,4 |
0,0005 |
10,70 |
|
40,5 |
40 |
0,1 |
0,1 |
9,12 |
0,05 |
80,5 |
0,0006 |
10,79 |
|
40,6 |
40 |
0,1 |
0,1 |
9,7 |
0,06 |
80,6 |
0,0007 |
10,87 |
|
40,7 |
40 |
0,1 |
0,1 |
9,98 |
0,07 |
80,7 |
0,0009 |
10,94 |
|
40,8 |
40 |
0,1 |
0,1 |
10,06 |
0,08 |
80,8 |
0,0010 |
11,00 |
|
40,9 |
40 |
0,1 |
0,1 |
10,23 |
0,09 |
80,9 |
0,0011 |
11,05 |
|
41 |
40 |
0,1 |
0,1 |
10,39 |
0,1 |
81 |
0,0012 |
11,09 |
|
41,5 |
40 |
0,1 |
0,1 |
10,8 |
0,15 |
81,5 |
0,0018 |
11,26 |
|
42 |
40 |
0,1 |
0,1 |
11,02 |
0,2 |
82 |
0,0024 |
11,39 |
|
42,5 |
40 |
0,1 |
0,1 |
11,25 |
0,25 |
82,5 |
0,0030 |
11,48 |
|
43 |
40 |
0,1 |
0,1 |
11,32 |
0,3 |
83 |
0,0036 |
11,56 |
|
43,5 |
40 |
0,1 |
0,1 |
11,39 |
0,35 |
83,5 |
0,0042 |
11,62 |
|
44 |
40 |
0,1 |
0,1 |
11,48 |
0,4 |
84 |
0,0048 |
11,68 |
|
44,5 |
40 |
0,1 |
0,1 |
11,55 |
0,45 |
84,5 |
0,0053 |
11,73 |
|
45 |
40 |
0,1 |
0,1 |
11,57 |
0,5 |
85 |
0,0059 |
11,77 |
|
46 |
40 |
0,1 |
0,1 |
11,58 |
0,6 |
86 |
0,0070 |
11,84 |
|
47 |
40 |
0,1 |
0,1 |
11,59 |
0,7 |
87 |
0,0080 |
11,91 |
|
48 |
40 |
0,1 |
0,1 |
11,6 |
0,8 |
88 |
0,0091 |
11,96 |
|
49 |
40 |
0,1 |
0,1 |
11,62 |
0,9 |
89 |
0,0101 |
12,00 |
|
50 |
40 |
0,1 |
0,1 |
11,62 |
1 |
90 |
0,0111 |
12,05 |
|
Przy miareczkowania mocnego kwasu (HCl) mocną zasadą ( NaOH) o stężeniach 0,1 mol/dm3 w miarę dodawania NaOH stężenie jonów wodorowych maleje w wyniku łączenia się w cząsteczki wody. Wobec czego pH roztworu wzrasta. Zwiększenie wartości pH jest na początku bardzo powolne. Przy dalszym wprowadzaniu zasady do roztworu zmiana pH jest coraz szybsza aż do osiągnięcia punktu równoważnikowego w którym następuje całkowite zobojętnienie roztworu. Teoretyczna wartość ph wynosi 7, z naszych wyników doświadczalnych punkt równoważnikowy przypadł na wartość pH ≈ 6,8 (wykres 1b)
Końcowym etapem ćwiczenia było porównanie wartości teoretycznych i doświadczalnych dla miareczkowania mocnego kwasu mocną zasadą, wartości te są sobie bliskie co widać na wykresie nr 7. Świadczy to o zgodności przeprowadzonych pomiarów, należy jednak dodać że pH-metr którym się posługiwano w ćwiczeniu był obarczony błędem pomiarowym
Δ pH=± 0,05, a jak wynika z pomiaru sporządzonych przez nas roztworów buforowych błąd mógł być nieco wyższy.
Różnica w pomiarze pH mogła być spowodowana także źle dobranym wskaźnikiem (miareczkowaliśmy przy pomocy fenoloftaleiny przy punkcie równoważnikowym mającym nastąpić w punkcie 7)
Druga krzywa miareczkowania przedstawia miareczkowanie słabego kwasu (CH3COOH) przez mocną zasadę ( NaOH) o stężeniach 0,1 mol/dm3 .
Miareczkowanie to różni się od poprzedniego; podczas miareczkowania słabego kwasu mocną zasadą powstaje sprzężona z nim słaba zasada według reakcji:
CH3COOH + OH- → H2O + CH3COO -
Słaba zasada która powstała w reakcji reaguje z wodą:
CH3COO - +H2O → CH3COOH + OH -
czego wynikiem jest to iż w punkcie równoważnikowym odczyn roztworu nie jest obojętny tylko zasadowy. Zmniejszenie stężenia jonów wodorowych podczas miareczkowania jest spowodowane nie tylko zobojętnianiem tych jonów jonami OH -, lecz także cofaniem się dysocjacji kwasu octowego, w miarę zwiększania się stężenia anionów CH3COO -. Do mierzenia wartości pH przy takim miareczkowaniu najlepszymi wskaźnikami są:
a więc w prawie dokładnie w obrębie skoku krzywej miareczkowania. Z naszych wykresów wynika, ze punkt równoważnikowy doświadczalny przypada na wartość pH ≈ 8,8 przy objętości ok. 33 cm3 zasady na 40 cm3 kwasu
15
7
![]()
![]()
Wyszukiwarka