Wyznaczanie granicznego przewodnictwa równoważnikowego
mocnego elektrolitu
Ze zmianami zachodzącymi w roztworach elektrolitów związane jest przewodnictwo molowe lub równoważnikowe, zdefiniowane równaniem
![]()
Przewodnictwo molowe odnosi się do przewodnictwa roztworu, którego stężenie wyrażone jest w molach ∙ dm-3, natomiast w przypadku przewodnictwa równoważnikowego stężenie wyrażone jest w valach ∙ dm-3. Jeżeli κ wyraża się w Ω-1 ∙ cm-1, a stężenie w mol ∙ dm-3 lub val ∙ dm-3, to powyższe równanie można zapisać w postaci
![]()
Biorąc pod uwagę zależność przewodnictwa od stężenia, wszystkie elektrolity można podzielić na dwie grupy. Pierwszą stanowią elektrolity, których przewodnictwo równoważnikowe szybko spada ze wzrostem stężenia (elektrolity słabe), natomiast w drugiej grupie obserwuje się znacznie mniejszy wpływ stężenia na zmiany przewodnictwa równoważnikowego (elektrolity mocne).
W roztworze o nieskończenie dużym rozcieńczeniu Λ osiąga wartość graniczną Λ0 (tzw. graniczne przewodnictwo równoważnikowe). Jest to przewodnictwo roztworu zawierającego 1 val jonów w tak dużym rozcieńczeniu, że nie występują żadne oddziaływania między jonami. Λ0 jest sumą granicznych przewodnictw jonowych kationu i anionu, co świadczy o tym, że jony w rozcieńczeniu nieskończenie wielkim wędrują w sposób niezależny. Jest to tzw. prawo niezależnego ruchu jonów Kohlrauscha.
Dla elektrolitów mocnych Kohlrausch ustalił empiryczną zależność przewodnictwa równoważnikowego od pierwiastka kwadratowego stężenia
![]()
gdzie: Λ0 (graniczne przewodnictwo równoważnikowe) i a są stałymi doświadczalnymi.
Ta prostoliniowa zależność jest spełniana w obszarze niskich stężeń i umożliwia wyznaczenie granicznego przewodnictwa równoważnikowego elektrolitów mocnych na drodze ekstrapolacji.
W roztworach silnie rozcieńczonych mocnych elektrolitów (warunki odpowiadające roztworom idealnym) Λ ma wartość stałą, równą granicznemu przewodnictwu równoważnikowemu Λ0. Wraz ze wzrostem stężenia coraz większego znaczenia nabierają oddziaływania między jonami oraz jonami i rozpuszczalnikiem, prowadzące do odstępstw od zachowania idealnego. Miarą tego może być tzw. stopień jonizacji (α), zdefiniowany jako stosunek przewodnictw równoważnikowych przy danym stężeniu i rozcieńczeniu nieskończenie wielkim:
![]()
Dla wielu silnych elektrolitów, w znacznym zakresie stężeń, istnieje liniowa zależność przewodnictwa równoważnikowego od ![]()
. Natomiast słabe elektrolity, np. kwas etanowy, nie dają liniowej zależności. Dla tych elektrolitów przewodnictwo równoważnikowe wzrasta gwałtownie, gdy stężenie dąży do zera.
Opracowanie wyników
W celu wyznaczenia stałej oporowej k naczyńka pomiarowego przygotowano roztwór KCl o dwóch różnych stężeniach i mierzono przewodnictwo, wykonując po pięć pomiarów dla każdego stężenia.
Następnie mierzono przewodnictwo następujących elektrolitów: NaCl, NaOH, CH3COOH o przygotowanych wcześniej dla każdego różnych stężeniach. Dla każdego ze stężeń wykonano po 3 pomiary.
Na podstawie wyznaczonych przewodnictw równoważnikowych wykonano wykresy zależności przewodnictwa od stężenia substancji Λ = f (
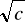
). Dla elektrolitów mocnych, mianowicie HCl i NaCl przewodnictwo to zmienia się liniowo, natomiast dla elektrolitu słabego, czyli roztworu CH3COOH przewodnictwo dąży asymptotycznie do wartości granicznej odpowiadającej dużemu rozcieńczeniu, co potwierdza, że substancja ta jest słabym elektrolitem.
Na podstawie równań opisujących zależność = f (
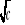
) - czyli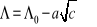
odczytujemy przewodnictwo równoważnikowe dla mocnych elektrolitów (gdy stężenie r-ru dąży do 0):
- dla roztworu HCl : Λ0 (HCl) = 390,3618 [cm2∙mol-1∙Ω-1]
- dla roztworu NaCl : Λ0 (NaCl) = 110,8386 [cm2∙mol-1∙Ω-1]
Graniczne przewodnictwa równoważnikowe dla mocnych elektrolitów możemy obliczyć na podstawie prawa Kohlorauscha:
![]()
oraz ![]()
Dla temperatury, w jakiej przeprowadzano doświadczenie graniczne przewodnictwa jonowe wynoszą:
![]()
gdzie: β - poprawka temperaturowa
λ0;t - graniczne jonowe przewodnictwo w danej temperaturze t
λ0;25 - graniczne jonowe przewodnictwo w temperaturze 25°C
Stąd otrzymujemy odpowiednio:
- ![]()
- ![]()
- ![]()
- ![]()
= 427,35 [cm2∙mol-1∙Ω-1]
- ![]()
= 126,96 [cm2∙mol-1∙Ω-1]
Ponieważ dla słabego elektrolitu nie możemy skorzystać z powyższych zależności (wykres zależności = f (
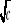
) nie jest funkcją liniową), do obliczenia granicznego przewodnictwa CH3COOH musimy posłużyć się wykresem zależności 1/Λ = f (Λ∙c). Równanie opisujące prostą wykreśloną na tym wykresie jest następującej postaci:
![]()
Do wykreślenia powyższej zależności zgodnie z instrukcją uwzględniliśmy tylko przewodnictwa dla pięciu najbardziej rozcieńczonych roztworów ( czyli dla stężeń 0,025 ÷0,0016 ).
Wartość przewodnictwa granicznego odczytana z wykresu wynosi zatem:
![]()
![]()
= 151,515 [cm2∙mol-1∙Ω-1]
Na podstawie prawa Kohlorauscha obliczyliśmy graniczne przewodnictwo Λ0 (CH3COOH), wykorzystując odpowiednie zależności:
a) tablicowe wartości odpowiednich przewodnictw jonowych λ0:
![]()
![]()
= 391,77 [cm2∙mol-1∙Ω-1]
b) tablicową wartość Λ0(CH3COONa) oraz wyznaczone w ćwiczeniu Λ0(NaCl) i Λ0(HCl)
![]()
![]()
= 370,90 [cm2∙mol-1∙Ω-1]
Dla elektrolitu mocnego i słabego obliczono stopnie dysocjacji α = Λ / Λ0 dla kolejnych stężeń:
stężenie c [M] |
Stopień jonizacji α |
||
|
elektrolity mocne |
elektrolit słaby |
|
|
HCl |
NaCl |
CH3COOH |
0,1 |
0,76 |
0,91 |
0,0129 |
0,05 |
0,81 |
0,93 |
0,0182 |
0,025 |
0,85 |
0,92 |
0,0254 |
0,0125 |
0,89 |
0,98 |
0,0349 |
0,0063 |
0,97 |
0,99 |
0,0493 |
0,0031 |
- |
- |
0,0672 |
0,0016 |
- |
- |
0,0914 |
Wyznaczono stałą równowagi reakcji jonizacji elektrolitu słabego
stężenie c [M] |
α |
K [M] |
wartość średnia |
0,1 |
0,0129 |
16,858∙10-6 |
16,194∙10-6 |
0,05 |
0,0182 |
16,869∙10-6 |
|
0,025 |
0,0254 |
16,549∙10-6 |
|
0,0125 |
0,0349 |
15,776∙10-6 |
|
0,0063 |
0,0493 |
16,106∙10-6 |
|
0,0031 |
0,0672 |
15,008∙10-6 |
|
0,0016 |
0,0914 |
14,711∙10-6 |
|
Ponieważ wartość stałej dysocjacji dla ostatniego stężenia nieco odbiega od pozostałych, uznaliśmy ją za obarczoną dużym błędem pomiarowym, przez co nie uwzględniliśmy w obliczeniu wartości średniej.
W literaturze odnaleźliśmy następującą wartość:
![]()
![]()
![]()
16,982∙10-6
Wnioski
Z otrzymanych wyników wartości przewodnictwa i stężenia sporządzono wykres Λ = f (
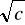
) dla elektrolitów mocnych, oraz = f (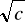
) dla elektrolitu słabego, jakim jest kwas octowy. Na wykresach można zauważyć, że wraz ze wzrostem stężenia elektrolitu, maleje przewodnictwo równoważnikowe. Przyczyną tego jest zmniejszająca się ruchliwość jonowa wraz z rosnącym stężeniem na skutek wzrastających oddziaływań międzycząsteczkowych. Dla elektrolitów mocnych zależność ta jest prostoliniowa.
Wartość Λ0 wyliczona przez komputer dla HCl wynosi 390,3618; wartość literaturowa zaś 407. Zaistniała różnica wynika z różnych wartości temperatury: pomiaru i temperatury, dla której odczytano wartość literaturową (25°C), ponieważ temperatura ma zasadniczy wpływ na - wraz ze wzrostem temperatury rośnie przewodnictwo.
W przypadku NaCl wartość wyznaczona doświadczalnie wynosi 110,8386 wartość zaś literaturowa - 135. Być może spadek przewodnictwa spowodowały pewne zanieczyszczeniem badanego roztworu poprzednim tj. HCl (na elektrodzie pomiarowej mogły pozostać jony H+).
Ponieważ dla słabych elektrolitów takich jak CH3COOH nie można aproksymować wykresu zależności λ = f (
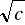
) do linii prostej, w związku z czym wartość granicznego przewodnictwa równoważnikowego obliczonego za pomocą programu „LAMBDA - ZERO” - 30,1842 nie jest prawdziwą. Możemy ją jednak wyznaczyć wykorzystując zależność: 1/Λ = f (Λ∙c). Graniczne przewodnictwo równoważnikowe odczytane z wykresu obarczone jest jednak dużym błędem (151,151), gdyż obliczając Λ0 poprzez sumowanie wartości przewodnictw jonowych wartość ta wynosi 390,6 (dla T = 25°C) .
- 5 -
Wyszukiwarka