|
Politechnika Śląska Wydział Inżynierii Materiałowej i Metalurgii |
Sprawozdanie Z CHEMII OGÓLNEJ
Laboratorium
|
|
TEMAT:
1a) Dysocjacja elektrolityczna, przewodność elektryczna roztworów. 1b) Wytrącanie trudno rozpuszczalnych soli i wodorotlenków.
|
|
Uwagi prowadzącego:
|
|
Data przyjęcia:
Podpis prowadzącego: |
Imię i nazwisko:
|
|
Grupa: ZIP 12 Sekcja: III |
SPRAWOZDANIE
1a) Dysocjacja elektrolityczna, przewodność elektryczna roztworów.
Wprowadzenie:
Dysocjacja elektrolityczna proces, w którym związki chemiczne podczas rozpuszczania w wodzie ulegają rozpadowi na jony dodatnie i ujemne, w wyniku oddziaływań między substancją rozpuszczoną, a rozpuszczalnikiem.
Elektrolity związki dysocjujące na jony w roztworach wodnych, czyli substancje, których wodne roztwory przewodzą prąd elektryczny. Do mocnych elektrolitów możemy zaliczy większość soli oraz wodorotlenki litowców i berylowców. Przykłady mocnych elektrolitów : H2SO4, HNO3,HCl, HClO4
Stopień dysocjacji liczba, która określa, jaką część elektrolitu ulega dysocjacji. określa moc elektrolitu i jest to stosunek stężenia cząsteczek zdysocjowanych do całkowitego stężenia tych cząsteczek w elektrolicie. Podaje Siudo w postaci liczb bezwymiarowych zawartych w przedziale 0<α<1 lub w procentach:
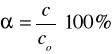
Stała dysocjacja elektrolityczna stała równowagi procesu dysocjacji będąca równocześnie miarą mocy kwasów.
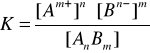
Przebieg ćwiczenia:
Do pojemników wypełnionych testerem z roztworami zanurzaliśmy elektrodę przyrządu badającego przewodność elektryczną. Następnie odczytywaliśmy wynik i zapisywaliśmy w kartach pomiarowych.
Wyniki badań
Lp. |
Rodzaj cieczy |
Reakcja dysocjacji |
Przewodność elektryczna mS |
Wnioski |
1 |
Woda destylowana |
_______
|
6,6 |
Nie jest elektrolitem |
2 |
Woda wodociągowa |
H2O <-> H+ + OH- |
0,1 |
Słaby elektrolit |
3 |
5% roztwór cukru |
_______
|
0,17 |
Nie jest elektrolitem |
4 |
0,1M HC |
HCl <-> H+ + Cl- |
17,81 |
Mocny elektrolit |
5 |
0,1 M CH3COOH |
CH3COOH <-> CH3COO- + H+ |
0,258 |
Słaby elektrolit |
6 |
0,1M NaOH |
NaOH <-> Na+ + OH- |
10,5 |
Mocny elektrolit |
7 |
0,1 M NH4OH |
NH4OH <-> NH4++OH- |
1,58 |
Słaby elektrolit |
8 |
0, M NaCl |
NaCl <-> Na++Cl- |
6,55 |
Mocny elektrolit |
Wnioski:
Ćwiczenie dostarczyło nam informacji o przebiegu reakcji dysocjacji. Dzięki temu wiemy już, które roztwory są elektrolitami słabymi , mocnymi lub nimi nie są . Oraz znamy ich przewodność elektrolityczną.
Literatura:
Saternus M., Fornalczyk A., Dankemyer-Łączny J.: Chemia ogólna dla metalurgów, Poi. ŚL, Gliwice, 2007.
Skrypt nr 2270 pod redakcją D. Krupkowej pt. "Ćwiczenia z chemii ogólnej dla studentów inżynierii materiałowej i metalurgii"
1b) Wytrącanie trudno rozpuszczalnych soli i wodorotlenków.
Wprowadzenie:
Procesy wytrącania, czyli reakcje, w których jeden z produktów wydziela się z roztworu w postaci trudno rozpuszczalnego osadu.
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów trudno rozpuszczalnego związku w jego roztworze nasyconym.
Rozpuszczalność to ilość substancji, jaką w danych warunkach ciśnienia i temperatury, można rozpuścić w określonej ilości rozpuszczalnika uzyskując roztwór nasycony.
Przebieg ćwiczenia:
Do próbówek wprowadzaliśmy po ok. 2 cm3 roztworów, następnie wstrząsaliśmy próbówką i obserwowaliśmy przebieg reakcji wytrącenia. Następnie zapisywaliśmy wyniki w karcie pomiarowej.
Wyniki badań:
Struktura |
Reakcja |
Obserwacja i wnioski |
P I A S K O W A |
AgNO3 + KI = AgI↓ + KNO3 Ag+ + NO3- + K+ + I- = AgI↓ + K+ + NO3- Ag+ + I- = AgI↓
|
Zmiana koloru roztworu na żółty. Powstanie żółtego osadu. |
|
AgNO3 + KBr = AgBr↓ + KNO3 Ag + + NO3- + K+ + Br- = K+ + NO3- + AgBr↓ Ag + + Br- = AgBr↓
|
Zmiana koloru roztworu na mleczny. Powstanie białego osadu. |
|
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3 2Ag+ + 2NO3- +2K+ + CrO42- = Ag2CrO4↓ + 2K+ + 2NO3- 2Ag+ + CrO42- = Ag2CrO4↓
|
Zmiana koloru roztworu na czerwony. Powstanie czerwonego osadu. |
|
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3 Pb2+ + 2NO3- + 2H+ + SO42- = PbSO4↓ + 2H+ + 2NO3- Pb2+ + SO42- = PbSO4↓
|
Zmiana koloru roztworu na biały. Powstanie białego osadu. |
G A L A R E T O W A T A |
Cu(NO3)2 +2KI = CuI2↓ + 2KNO3 Cu 2+ + 2NO3- + 2K+ + 2I- = CuI2↓ + 2K+ + 2NO3- Cu 2+ + 2I- = CuI2↓
|
Zmiana koloru roztworu na musztardowy. Powstanie osadu. |
|
NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4 Ni2+ + SO42- + 2Na+ + 2OH- = Ni(OH)2↓ + 2Na+ + SO42- Ni2+ +2OH- = Ni(OH)2↓
|
Zmiana roztworu na jasno zielony. Powstanie osadu. |
|
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl- + 3Na+ +3OH- = Fe(OH)3↓ + 3Na+ + 3Cl- Fe3+ + 3OH- = Fe(OH)3↓
|
Brak zmiany koloru roztworu Powstanie osadu. |
Wnioski:
Zadanie nauczyło nas, które roztwory wytrącają osady. Ukazało nam to, jakie mamy rodzaje osadów.
Literatura:
Saternus M., Fornalczyk A., Dankemyer-Łączny J.: Chemia ogólna dla metalurgów, Poi. ŚL, Gliwice, 2007.
Skrypt nr 2270 pod redakcją D. Krupkowej pt. "Ćwiczenia z chemii ogólnej dla studentów inżynierii materiałowej i metalurgii"
1
![]()
Wyszukiwarka