Politechnika Łódzka Natalia Zioło
Wydział Budownictwa Architektury Piotr Zarzycki
i Inżynierii Środowiska Alicja Woźniak
Kierunek: Inżynieria Środowiska
Semestr I
Nastawianie miana roztworów
NaOH i KMnO![]()
Data ćwiczenia |
20.10.2008r. |
Data oddania |
27.10.2008r. |
Data oddania poprawionego sprawozdania |
17.11.2008r. |
Ocena |
|
Podpis |
|
Cel ćwiczenia
Zdobycie umiejętności miareczkowania substancji. Poznanie metod miareczkowania kwasów i zasad. Przeprowadzenie reakcji utleniania i redukcji.
Wstęp teoretyczny
Podstawy analizy miareczkowej
Analiza miareczkowa polega na tym, że do roztworu oznaczonego wprowadza się porcjami (miareczkami) równoważną chemicznie ilość roztworu mianowanego (o znanym stężeniu). Stężenie (lub miano) oznaczanej substancji oblicza się na podstawie zmierzonej dokładnie objętości zużytego roztworu o znanym stężeniu (lub mianie).
Klasyfikacja metod miareczkowych
Klasyfikacja metod miareczkowych według typu reakcji zachodzącej podczas miareczkowania
Alkacymetria - opiera się na reakcjach kwas-zasada.
Kompleksometria - metody oparte na tworzeniu trwałych, łatwo rozpuszczalnych związków kompleksowych.
Precypitometria - wykorzystuje reakcje, w których powstają związki trudno rozpuszczalne - metoda wytrąceniowa
Redoksymetria - wykorzystuje reakcje utleniania i redukcji
PR i PK miareczkowania
PR (punkt równoważności) - moment, w którym ilość wprowadzonego mianowanego roztworu zrównoważy ilość składnika oznaczanego. Żeby móc wzrokowo zaobserwować punkt równoważnikowy do roztworu miareczkowanego wprowadza się wskaźnik (indykator), który zmienia barwę w chwili zakończenia reakcji między roztworem mianowanym, a roztworem miareczkowanym. Moment, w którym indykator zmienia swoje zabarwienie nazywa się (punktem końcowym) PK miareczkowania.
Zasadniczo PK i PR miareczkowania powinny się pokrywać. W praktyce jednak punkt końcowy miareczkowania następuje tuż przed lub tuz po punkcie równoważnikowym. Różnica pomiędzy tymi punktami nazywa się błędem miareczkowania.
Wskaźniki PK
Wskaźnikami alkacymetrycznymi są pewne barwniki organiczne zmieniające barwę zależnie od pH roztworu, w którym się znajdują.
Wskaźnik
|
Barwa w roztworze kwaśnym zasadowym |
Zmiana barwy w zakresie pH
|
|
Oranż metylowy
|
czerwona
|
pomarańczowa
|
3,1-4,4
|
Czerwień metylowa
|
czerwona
|
żółta
|
4,2-6,3
|
Błękit bromotymolowy
|
żółta
|
niebieska
|
6,2-7,6
|
Fenoloftaleina
|
bezbarwna
|
malinowa
|
8,3-10,0
|
Roztwory mianowane
Roztwory mianowane są to roztwory o dokładnie znanym stężeniu, które wyznaczono poprzez nastawienie jego miana. Stężenie roztworu mianowanego wyraża się w [g/ml]. Często stężenie roztworów mianowanych wyraża się ich molowością [mol/l]. W alkacymetrii jako roztworów mianowanych najczęściej używa się roztworów mocnych kwasów i zasad. Z kwasów są to najczęściej; kwas solny lub siarkowy. Jako zasady najczęściej używa się roztworu wodorotlenku sodu.
Technika analizy miareczkowej
Technika analizy miareczkowej polega na dodawaniu roztworu w postaci kropel oraz mieszaniu cały czas roztworu powstającego.
Alkacymetria
Alkacymetria skupia metody miareczkowe oparte na reakcjach kwas - zasada. Metody te są również nazywane metodami zobojętniania. Oprócz kwasów i zasad można nimi również oznaczać sole słabych kwasów i mocnych zasad, bądź tez odwrotnie. Alkacymetrię można podzielić na:
Alkalimetrię - metoda oznaczania kwasów
Acydymetrię - metoda oznaczania zasad
W większości oznaczeń alkacymetrycznych roztwór miareczkowany nie ma w punkcie równoważnikowym odczyny dokładnie obojętnego.
Reakcje utleniania i redukcji
Reakcje utleniania i redukcji polegają na wymianie elektronów pomiędzy reagentami. Redukcja polega na przyłączeniu elektronów, a przez to na zwiększeniu ładunku ujemnego (zmniejszenie dodatniego) i obniżeniu stopnia utleniania. Utlenianie zaś polega na oddawaniu elektronów, co powoduje zwiększenie ładunku dodatniego (zmniejszenie ujemnego) i podwyższenie stopnia utleniania. Przebieg procesu jest możliwy tylko wtedy gdy jednocześnie zachodzi proces utleniania. Oba te procesy stanowią wspólnie reakcję utleniania i redukcji czyli reakcję red - oks.
Równania połówkowe
Wszystkie reakcje red - oks można przedstawić w postaci układu sprzężonego, składającego się z wóch reakcji połówkowych. Ogólnie reakcję red - oks możemy wyrazic w następujący sposób:
Oks![]()
![]()
+ ne ![]()
Red![]()
Red![]()
![]()
Oks![]()
+ ne
![]()
Oks![]()
+Red![]()
+ne ![]()
Red![]()
+Oks![]()
+ ne
Oks - utleniacz, Red - reduktor, ne - liczba elektronów
Stopień utleniania
Stopniem utlenienia pierwiastka wchodzącego w skład określonej substancji nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych jakie przypisalibyśmy atomom tego pierwiastka gdyby cząsteczki tej substancji miały budowę jonową. Zasady oznaczenia stopnia utleniania:
Stopień utlenienia pierwiastka w stanie wolnym równy jest zero.
Stopień utlenienia pierwiastka w postaci jonu prostego równa się jego elektronowartościowości(wartościowości jonu).
Suma stopnia utlenienia wszystkich atomów wchodzących w skład jonu złożonego równa jest ładunkowi jonu.
Suma stopnia utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero.
Fluor we wszystkich swych połączeniach występuje na -1 stopniu utlenienia.Tlen w połączeniach ma stopień utlenienia -2. Wyjątki stanowią fluorek tlenu OF
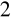
, w którym tlen ma stopień utlenienia +2.
Redoksometria
Redoksometria stanowi dział analiz miareczkowych skupiający metody oparte na reakcjach utleniania i redukcji Oksydymetria skupia metody oparte na miareczkowaniu mianowanym roztworem utleniacza, z kolei reduktometria skupia metody w których miareczkowanie przeprowadza się mianowanym roztworem reduktora.
Do typowych metod oksydometrycznych należą:
Nadmanganianometria - utleniaczem KMnO
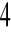
Cerometria - utleniaczem jest Ce(SO
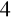
)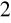
Chromianometria - utleniaczem jest K
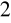
Cr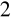
O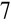
lub K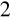
Cr O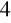
Bromianometria - utleniaczem jest KBrO
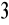
Przebieg ćwiczenia
Oznaczanie miana roztworu NaOH poprzez miareczkowanie go 0,05 mol/l roztworem H
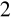
S O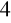
Do kolby stożkowej o pojemności 250 ml odmierzyć pipetą 25 ml analizowanego roztworu wodorotlenku sodu. Następnie dodać do kolby 50 ml wody destylowanej, 2-3 krople oranżu metylowego i miareczkować go 0,05 mol/l roztworem H![]()
SO![]()
do pierwszej zmiany barwy. W celu ustalenia dokładnego wyniku miareczkować 2-3 próbki NaOH. Obliczyć stężenie molowe analizowanego roztworu i jego miana w g/ml.
Pierwsze miareczkowanie
Stan wyjściowy |
Ilość użytego roztworu |
0 ml |
0,3 ml |
Drugie miareczkowanie
Stan wyjściowy |
Ilość użytego roztworu |
1 ml |
0,2 ml |
Wzór powstałej reakcji:
2NaOH + H![]()
SO![]()
![]()
Na SO![]()
+ 2 H![]()
O
aA + bB ![]()
cC + dD
Obliczanie stężeń molowych dla następujących miareczkowań:
V![]()
C![]()
: V![]()
C![]()
= a : b
b V![]()
C![]()
= a V![]()
C![]()
V![]()
i V![]()
- objętości roztworów A i B
C![]()
i C![]()
- stężenia molowe roztworów A i B
C![]()
=![]()
W naszym przypadku będą to dwa stężenia molowe ponieważ mierzyliśmy dwie próbki.
C![]()
= 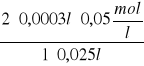
= 0,0012![]()
C![]()
= 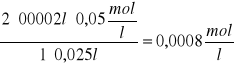
Czyli odpowiednio ilość moli wynosi:
C![]()
=![]()
C![]()
= ![]()
n![]()
= 0,0012![]()
![]()
= 0,00003moli n![]()
=![]()
=0,00002moli
A także odpowiednio miano roztworu jest równe:
T![]()
= ![]()
T![]()
=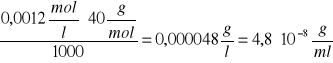
T![]()
= ![]()
T![]()
= 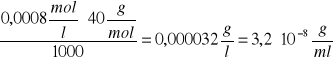
Nastawianie miana KMnO
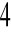
na 0,05 mol/l Na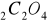
Do kolby stożkowej o pojemności 250 ml odmierzyć pipetą 10 ml 0,05 mol/l roztworu szczawianu sodu. Następnie dodać 50 ml wody destylowanej oraz 10 ml roztworu H![]()
SO![]()
(1+3) (odmierzonego pipeta za pomocą gruszki).
Otrzymany roztwór ogrzewać w łaźni wodnej do temperatury 70-80![]()
C (tj. do momentu gdy nad roztworem zacznie się pojawiać mgiełka pary wodnej), a następnie miareczkować ostrożnie na gorąco, roztworem którego miano należy wyznaczyć (KMnO![]()
).
Początkowo należy wprowadzać roztwór KMnO![]()
bardzo powoli, po kropli czekając każdorazowo na zupełne odbarwienie się roztworu miareczkowanego. Gdy reakcja już zachodzi, można przyspieszyć proces, nie zapominając o mieszaniu w celu wyrównania stężeń. Zbliżający się koniec miareczkowania poznać po tym, że zmniejsza się szybkość zaniku barwy nadmanganianu potasu. Miareczkowanie jest zakończone, gdy po dodaniu 1 kropli KMnO![]()
w nadmiarze, roztwór przybiera barwę różową, utrzymującą się w ciągu 1 minuty.
Do oznaczenia przygotować dwie próbki. Zanotować wyniki pomiarów, obliczyć stężenie (mol/l) i miano (g/ml) oraz napisać równanie zachodzącej reakcji (wraz z równaniami połówkowymi).
Pierwsze miareczkowanie
Stan początkowy |
Ilość użytego roztworu |
1 ml |
13,3 ml |
Drugie miareczkowanie
Stan początkowy |
Ilość użytego roztworu |
15 ml |
13,3 ml |
Wzór powstałej reakcji:
![]()
Obliczamy stężenie molowe ![]()
:
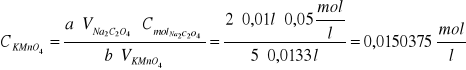
Obliczamy ilość moli:
![]()
Obliczamy miano KMnO![]()
:
T=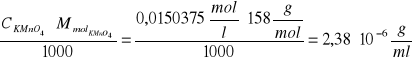
Wnioski
Bardzo ważnym w obu ćwiczeniach było miareczkowanie, które umożliwiało nam uzyskanie prawidłowych wyników.
W ćwiczeniu pierwszym po dodaniu 0,3 ml H
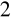
SO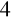
a następnie przy drugim miareczkowaniu 0,2 ml H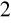
SO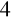
otrzymaliśmy barwę różową.W wyniku reakcji zasady NaOH i kwasu H
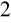
SO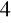
otrzymaliśmy sól Na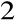
SO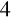
i wodę.W ćwiczeniu drugim dodawaliśmy KMnO
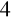
o barwie fioletowej do ogrzanego Na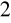
C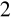
O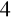
, w którym dodany nadmanganian potasu odbarwiał się, po dodaniu odpowiedniej ilości udało nam się zabarwić szczawian sodu na kolor różowy który utrzymywał się dłużej niż 60 sekund.
Wyszukiwarka