Ebuliometria to fizyko chemiczna metoda badawcza oparta na zjawisku podwyższenia temperatury wrzenia roztworu w porównaniu z temperaturą wrzenia czystego rozpuszczalnika. Para nad rozcieńczonym roztworem nielotnego składnika w lotnym rozpuszczalniku składa się praktycznie z czystego rozpuszczalnika. Prężność całkowita jest równa prężności cząstkowej rozpuszczalnika. Rozpuszczalnik w roztworze rozcieńczonym stosuje się do prawa Raoulta i prężność pary nad roztworem wynosi:
p=p1=p*1x1< p1*
gdzie:
p*1- prężność pary czystego rozpuszczalnika,
x1-ułamek molowy rozpuszczalnika.
Prężność pary nad roztworem substancji nielotnej jest więc zawsze niższa od prężności pary czystego rozpuszczalnika. Względne obniżenie prężności pary nad roztworem ![]()
jest równe ułamkowi molowemu substancji rozpuszczonej i nie zależy od jej rodzaju. Ciecz wrze w temperaturze, w której prężność jej pary zrówna się z ciśnieniem atmosferycznym. Jeżeli zatem prężności pary ulega obniżeniu, to dla osiągnięcia wartości ciśnienia zewnętrznego ciecz musi być ogrzana do nieco wyższej temperatury. Zatem efekt obniżenia prężności pary
Nad roztworem substancji nielotnej w porównaniu z czystym rozpuszczalnikiem prowadzi do podwyższenia temperatury wrzenia roztworu. Doświadczalnie stwierdzono że w zakresie stężeń, w których słuszne jest prawo Raoulta, różnica między temperaturą wrzenia roztworu a temperaturą wrzenia czystego rozpuszczalnika jest proporcjonalna do molalności m:
![]()
gdzie:
Ke to współczynnik proporcjonalności tzw. Stała ebulioskopowa. Jest to wielkość charakteryzująca dany rozpuszczalnik i nie zależy od rodzaju substancji rozpuszczonej. Molalność m określa liczbę moli n2 substancji rozpuszczonej w 1000g czystego rozpuszczalnika:
![]()
podstawiając do wcześniejszej zależności uzyskamy
wyrażenie na masę molową substancji rozpuszczonej:
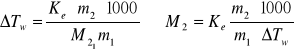
gdzie:
m2-masa substancji
m1-masa wody destylowanej
T1- odczytana temperatura wrzenia wody
T1,2- odczytana temperatura wrzenia roztworu
![]()
- różnica między temperaturą wrzenia roztworu a temperaturą wrzenia rozpuszczalnika
Ke- stała ebulioskopowa
M2-masa cząsteczkowa substancji rozpuszczonej
Celem ćwiczenia było wyznaczenie masy cząsteczkowej substancji rozpuszczonej w wodzie, na podstawie pomiaru podwyższenia temperatury wrzenia roztworu w porównaniu z temperaturą wrzenia czystego rozpuszczalnika.
m1 [g] |
m2 [g] |
T1 [deg] |
T1,2 [deg] |
[deg] |
Ke [deg kg mol-1] |
M2 [g mol-1] |
50,2
|
5,0102 |
3,82 |
4,51 |
0,69 |
0,514 |
74,35 |
Błąd d wartości masy cząsteczkowej substancji rozpuszczonej w wodzie :
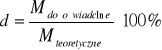
gdzie:
Mdoświadczalne= 74,35 g/mol
Mteoretyczne=76 g/mol
![]()
100% - 97,82% =2,18%
Wnioski:
Wartość masy cząsteczkowej substancji rozpuszczonej w wodzie wynosi 74,35 g/mol. Wartość ta obarczona jest błędem wielkości 2,18%. Błąd jest niewielki i substancji, a następnie źle przeprowadzonym procesem rozpuszczania. Mimo to najprawdopodobniej spowodowany jest niedokładnością w odważeniu według mojej oceny ćwiczenie przeprowadziłam poprawnie.
2
Wyszukiwarka