Numer ćwiczenia : 4 |
Temat ćwiczenia : DESTYLACJA |
Data wykonania : 31.03.2003 |
Grupa : 4 Zespół : B |
Wykonawcy ćwiczenia : Szymon Kowalski Tomasz Pierzyński |
Ocena : |
Wyznaczenie składu badanych roztworów CH3COOH i ich par, zależności od temperatury wrzenia
Zestawienie wyników:
Roztwór |
Tw [oC] |
Skład cieczy |
Skład pary |
||||
|
|
VNaOH [ml] |
Cmol [mol/l] |
% obj. |
VNaOH [ml] |
Cmol [mol/l] |
% obj. |
I III V |
105,5 103,5 103 |
27,3 20,3 16,6 |
13,67 10,15 8,30 |
78,16 58,05 47,47 |
27,7 15,6 12,7 |
11,33 7,78 6,37 |
64,82 44,51 36,41 |
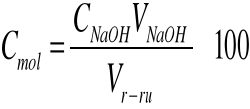
Stężenie molowe badanych roztworów obliczono na podstawie wzoru:
gdzie: CNaOH = 0,1 mol/l
Vr-ru = 20 ml
100 - rozcieńczenie
Natomiast % objętościowy kwasu octowego w mieszaninie wyznaczono jako stosunek:
![]()
Przy czym objętość kwasu policzono jako:
![]()
gdzie: m- masa kwasu octowego zawartego w roztworze
d = 1,05 g/cm3 = 1050 g/dm3 - gęstość kwasu octowego
masę kwasu można wyznaczyć znając liczbę jego moli w roztworze:
![]()
gdzie: M = 60,05 g/mol - masa molowa kwasu octowego
liczbę moli wyznaczono na podstawie stężenia molowego roztworu:
![]()
Ostatecznie wzór przyjmuje postać:
![]()
Otrzymane wyniki naniesiono na wykres zależności temperatury wrzenia roztworu od składu pary i od składu roztworu wraz z danymi literaturowymi zamieszczonymi w instrukcji
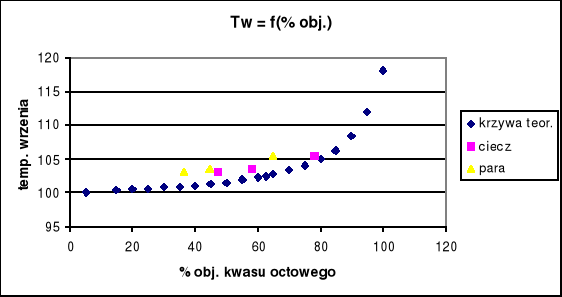
Teoretycznie ze wzrostem stężenia kwasu octowego w roztworze powinna wzrastać temperatura wrzenia. Otrzymane wyniki są zbliżone krzywych teoretycznych, jedna temperatura wrzenia w każdym przypadku jest wyższa od teoretycznej temp. odczytanej z diagramu. Przyczyna tego może być zbyt późne stwierdzenie wrzenia roztworu.
Dla każdego roztworu ciecz jest bardziej bogata w kwas octowy, niż para co potwierdza fakt iż woda jest w tej mieszaninie składnikiem bardziej lotnym.
2.Obliczenie współczynników aktywności acetonu i wody (wg danych zawartych w instrukji):
Ułamki molowe składników obliczono ze wzorów:
![]()
![]()
gdzie: Ma = 58 g/mol
Mw =18 g/mol
Wzory do obliczeń aktywności i współczynnika aktywności acetonu i wody:
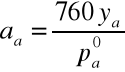
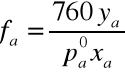
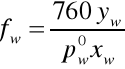
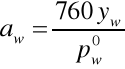
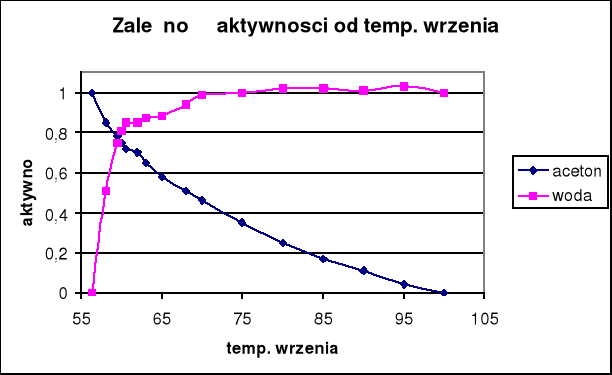
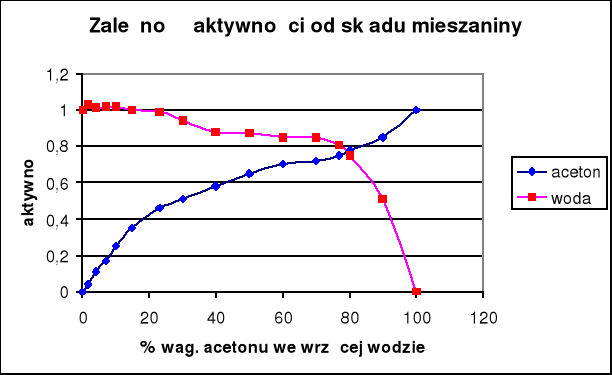
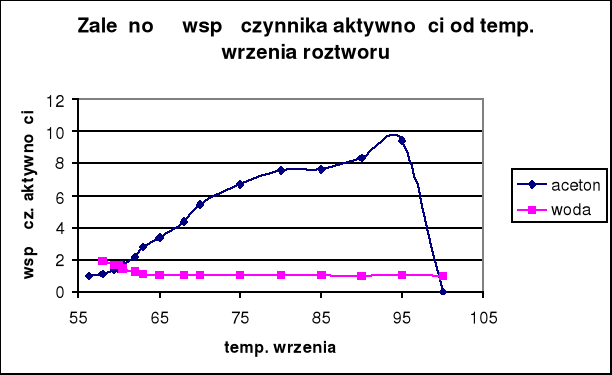
Wyniki obliczeń zawarte są w tabeli. Na podstawie otrzymanych wyników sporządzono wykresy współczynników aktywności i aktywności acetonu oraz wody w funkcji temperatury wrzenia, a także zależności tych wartości od składu cieczy.
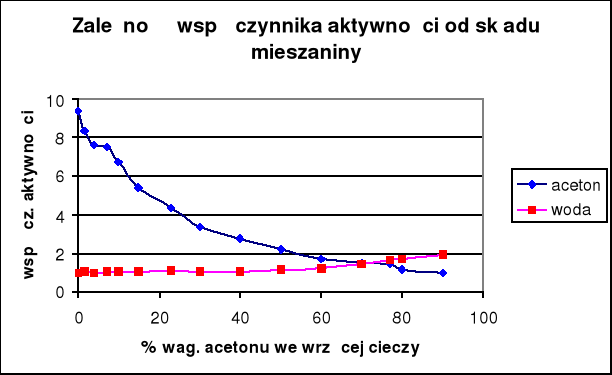
Stężenie acetonu i wody we wrzącej cieczy |
Temp. wrzenia roztworu [oC] |
Rzeczywiste stężenie acetonu i wody w parze |
pwo mm Hg |
pao mm Hg |
Rzeczywista prężność acetonu w parze pw = 760*ya |
Raultowska prężność acetonu w parze pa = xa* pao |
fa |
aa |
fw |
aw |
||||
% wag. acetonu |
% mol xa |
% mol xw |
|
% wag. acetonu |
% mol ya |
% mol yw |
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
0,0 1,5 4,0 7,0 10,0 15,0 23,0 30,0 40,0 50,0 60,0 70,0 77,0 80,0 90,0 100,0 |
0,000 0,005 0,013 0,023 0,033 0,052 0,085 0,117 0,171 0,237 0,318 0,420 0,510 0,554 0,736 1,000 |
1,000 0,995 0,987 0,997 0,967 0,948 0,915 0,883 0,829 0,763 0,682 0,580 0,490 0,446 0,264 0,000 |
100,0 95,0 90,0 85,0 80,0 75,0 70,0 68,0 65,0 63,0 62,0 60,5 60,0 59,5 58,0 56,3 |
0,0 35,0 58,0 70,0 78,0 84,0 88,0 90,0 92,0 93,0 93,5 94,0 94,5 95,0 97,0 100,0 |
0,000 0,147 0,300 0,420 0,524 0,620 0,695 0,736 0,781 0,805 0,817 0,829 0,842 0,855 0,909 1,000 |
1,000 0,857 0,700 0,580 0,476 0,380 0,305 0,264 0,219 0,195 0,183 0,171 0,158 0,145 0,091 0,000 |
760 634 528 434 355 289 234 214 188 171 164 153 149 146 136 126 |
2820 2460 2140 1840 1585 1350 1150 1095 1023 935 892 871 852 833 812 760 |
0 109 228 319 398 471 528 560 594 612 621 630 640 650 691 760 |
0 12 27 42 53 70 98 129 175 221 283 366 434 461 598 760
|
- 9,40 8,35 7,60 7,54 6,72 5,41 4,35 3,39 2,76 2,19 1,72 1,47 1,41 1,16 1,00 |
0,00 0,04 0,11 0,17 0,25 0,35 0,46 0,51 0,58 0,65 0,70 0,72 0,75 0,78 0,85 1,00 |
1,00 1,03 1,02 1,04 1,05 1,05 1,08 1,06 1,07 1,14 1,24 1,46 1,64 1,69 1,92 - |
1,00 1,03 1,01 1,02 1,02 1,00 0,99 0,94 0,88 0,87 0,85 0,85 0,81 0,75 0,51 0,00 |
Wnioski:
Współczynnik aktywności acetonu dla niskich stężeń w mieszaninie osiąga stosunkowo wysokie wartości (prawie 10), następnie stopniowo spada do wartości dla czystego acetonu. Natomiast współczynnik aktywności wody nieznacznie zależy od temperatury zmienia się od 1 (czysta woda) do prawie 2.
Aktywność wody również utrzymuje sie na stałym poziomie, spada dopiero powyżej 70% zawartości acetonu w cieczy, natomiast aktywność acetonu rośnie dosyć równomiernie ze wzrostem jego zawartości.
Te same zależności widoczne są na wykresach w funkcji temperatury wrzenia, dla wody aktywność spada dopiero poniżej 60°C, natomiast dla acetonu spada prawie liniowo ze wzrostem temperatury.
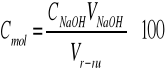
![]()
![]()
![]()
![]()
Wyszukiwarka