Wykład 13.
Przybliżenie adiabatyczne ( Borna -Oppenhaimera)
Do tej pory zajmowaliśmy się opisem elektronów poruszających się w polu nieruchomych jonów. Oczywiście wiemy , że w realnych układach ( drobinach lub kryształach jądra atomów nie są nieruchome ( nawet w temperaturze 0K jądra wykonują pewne drgania o energii ![]()
( ![]()
jest stałą Plancka a ![]()
częstością kołową drgań) . Uwzględnienie ruchu jonów lub jąder będzie tematem tego wykładu.
Możemy skorzystać z wniosków poprzedniego wykłady i przyjąć, że udało nam się obliczyć energie i funkcje własne układu wielolelektronoiwego w przybliżeniu jenoelektronowym dla danych położeń jonów.
Możemy więc rozważać każdy elektron osobno używające do jego opisu hamiltonianu ![]()
i funkcji falowej ![]()
.
Jeśli elektron znajduje się w krysztale lub drobinie składającej się z N jąder całkowita energia układu będzie opisana hamiltonianem
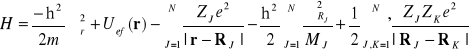
(II-1)
![]()
W hamiltonianie tym pierwsze trzy człony są znanym nam już hamiltonianem jednoelektronowym z efektywnym potencjałem opisującym oddziaływania międzyelektrodowe, w którym potencjał oddziaływania elektron z jądrami przedstawiono jako sumę potencjałów poszczególnych jąder. Czwarta suma reprezentuje energię kinetyczną jąder zaś piąta suma energię potencjalna odpychania ładunków jąder. Literami ZJ i MJ z indeksami oznaczono odpowiednio liczby atomowe i masy jąder. Literą RJ oznaczono położenia jąder.
Na ogół drgania sieci krystalicznej lub drobin nie polegają na niezależnych drganiach wszystkich jonów. Zawsze mamy do czynienia z ruchem uporządkowanym, w którym jądra drgają mnie lub bardziej symetrycznie. Współrzędne opisujące ruch jąder są od siebie wzajemnie zależne. Nie ma więc potrzeby używania N niezależnych położeń W najprostszym przypadku ruch wszystkich jąder będzie mógł być opisany jedna współrzędną R
Przybliżenie adiabatyczne
Jako interesujący przykład można rozpatrzyć cząsteczkę dwuatomową , np. H2, lub jon metalu w związku koordynacyjnym np. CrO6 .
a
H
R=|R2-R1|
R2
H
R1
b
R
Rysunek 1 a i b
W oby przypadkach drania układu jonów można opisać przy pomocy jednej współrzędnej, R . Powoduje to ,że hamiltonian może być przedstawiony w znacznie prostszej postaci
![]()
(II-2)
gdzie He i Hj są operatorami opisującymi ruch elektronów i jąder
![]()
(II-3)
Skoro dokonano separacji zmiennych można przedstawić funkcje falową w postaci iloczynu :
![]()
(II-4)
Funkcja w tej postaci nosi czasem nazwę funkcji Borna Oppenhaimera . Pierwszy składnik jest funkcją elektronową , opisującą ruch elektronów dla danych położeń jąder . Obrazuje to równanie Shrödingera w postaci
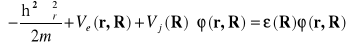
(II-5)
gdzie ![]()
jest parametrycznie zależną od położeń jąder energią elektronów. Należy zwrócić uwagę, że w równaniu (II-5) występuje potencjał oddziaływania jąder. Dla elektronu jest stała , zależna od położeń jąder . Na ogół stałe elementy hamiltonianu są pomijane . W tym przypadku bierzemy to je pod uwagę. Robimy to ponieważ w całkowitym hamiltonianie układu (II-2) jest to funkcja zależna od położeń jąder.
Zobaczmy teraz , w jakim przypadku możemy interpretować równanie (II-5) jako równanie Shrödingera dla elektronów. W ogólnym przypadku możemy rozwiązywać równanie z hamiltonianem (II-2) i funkcją (II-4) . Otrzymamy :
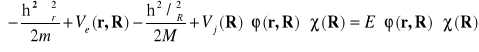
(II-6)
W równaniu tym energia E jest energia własną układu elektronów i jonów . Można przyjąć następujący warunek normalizacji funkcji falowych :
![]()
![]()
(II-7)
Równanie (II-6) da się przepisać w postaci:
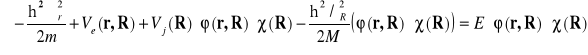
(II-8)
Drugi składnik równania daje się zapisać w postaci :
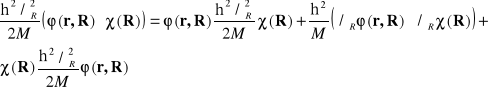
(II-9)
Pierwszy składnik w równaniu (II-9) reprezentuje energię kinetyczną jonów (czynnik![]()
) pomnożoną przez elektronowa funkcję falową, dwa pozostałe stanowią tzw. Operator nieadiabatyczności . Formalnie dokonujemy przybliżenia adiabatycznego gdy zakładamy, że :
![]()
(II-10)
Przybliżenie to jest uzasadnione we wszystkich przypadkach , gdy elektronowa funkcja falowa , nie zależy lub bardzo słabo zależy od położeń jąder. Na ogół przypadku wielu molekuł założenie to jest spełnione. W przypadku kryształów mamy do czynienia z bardziej skomplikowaną sytuacją i założenie o adiabatyczności układu trzeba zawsze osobno analizować. Często pomija się operator nieadiabatyczności argumentując , że w wyniku jego działania dostajemy poprawki do wartości energii rzędu ![]()
( stosunku masy elektronu do masy jonu).
Jeśli założy się spełnienie warunków normalizacji cząstkowej tzn.
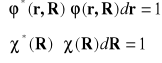
(II-11)
Wówczas
![]()
(II-12)
(ponieważ jest to różniczkowanie stałej ) prowadzi do zerowania się pierwszego składnika (II-10) przy obliczaniu wartości własnej energii.
Równanie (II-8) można rozwiązać mnożąc lewostronnie przez ![]()
i całkując po zmiennej elektronowej, r. Otrzymujemy
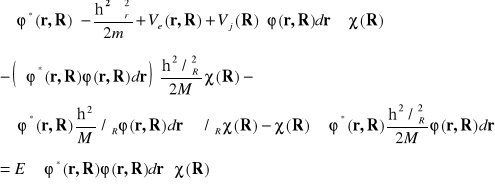
(II-13)
Korzystając z pierwszego warunku normalizacji oraz równania (II-12) otrzymamy
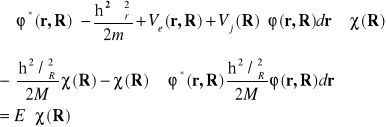
(II-14)
Jeśli założymy, że
![]()
to równanie (II-14) da się przekształcić do postaci:
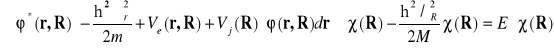
(II-15)
Korzystając dalej z równania (II-5) otrzymamy równanie Schrödingera opisujące ruch jonów
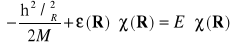
(II-16)
Podsumowując tą część wykładu można powiedzieć , że przybliżenie adiabatyczne pozwala separować ruch elektronów i ruch jonów. Otrzymujemy dwa równania. Najpierw rozwiązujemy równanie (II-5) otrzymując energie elektronów w polu nieruchomych jąder dla każdego położenia jąder osobno. Następnie rozwiązuje się równanie (II-16) otrzymując energie całego układu.
Zwróćmy uwagę co składa się energię ![]()
. Równanie (II-5) pozwala na przedstawienie tej energii w formie sumy
![]()
(II-17)
gdzie ![]()
jest energią elektronu , wartość własna otrzymana z równania Schrödingera nie uwzględniającego potencjału wzajemnego oddziaływania jąder.
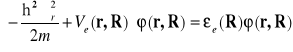
(II-18)
Aby zilustrować powyższe rozważania wykonajmy przykładowe obliczenia . Spróbujmy zanalizować równanie (II-17). Zastanówmy się jak od położeń jąder zależeć będzie energia ![]()
w elektronowym stanie podstawowym . Jeśli układ znajduję się w położeniu równowagi jakiekolwiek przesunięcia jonów powodują wzrost energii układu. Z mechaniki klasycznej wiadomo, że możemy wówczas przybliżyć energię układu przy pomocy energii sprężystej. W przypadku gdy układ daje się opisać przy pomocy jednej współrzędnej R
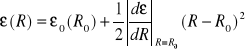
(II-19)
Jak widać jest to rozwinięcie funkcji energii w szereg potęgowy względem położenia równowagi jonów, R=R0, przy założeniu ,że pierwsza pochodna jest równa zeru (
). Łatwo pokazać, że
![]()
(II-20)
Łatwo zauważyć, że wykres zależności energii od położeń jąder jest dany przez parabolę. Można wprowadzić nową zmienną Q=R-R0 wówczas równanie (II-19) można przedstawić w postaci:
![]()
(II-21)
Równanie (II-16) jest więc po prostu równaniem oscylatora harmonicznego ( patrz wykład z fizyki teoretycznej lub mechaniki kwantowej)
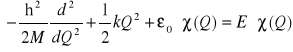
(II-22)
W przypadku, gdy układ elektronów zostanie wzbudzony do wyższych stanów energetycznych warunek (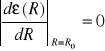
) nie musi być spełniony . Równanie opisujące zależność energii elektronów od położenia jonów w stanie wzbudzonym dane będzie wzorem:
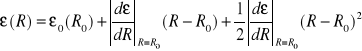
(II-23)
lub
![]()
(II-24)
Stała V może być liczona jako
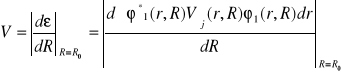
(II-25)
gdzie ![]()
elektronową funkcja falową układu w stanie wzbudzonym . Zauważmy, że jeśli 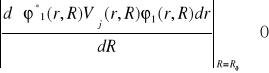
, nawet jeśli w stanie podstawowym
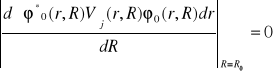
.
Na rysunku 2 przedstawione są krzywe opisujące energie układu w stanie podstawowym i wzbudzonym . Widać, że po wzbudzeniu do stanu „1” następuje relaksacja jonów do nowego położenie równowagi Q1.
Elementarna matematyka pozwala obliczyć położenie równowagi jonów w elektronowym stanie wzbudzonym :
![]()
(II-26)
oraz związane z przesunięciem jonów obniżenie energii układu
![]()
(II-27)
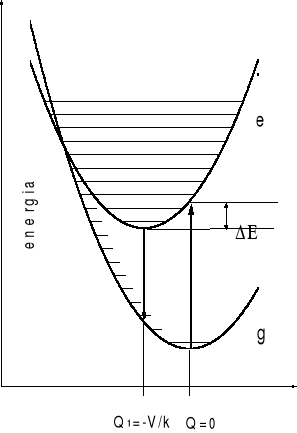
Rysunek 2
Diagram konfiguracyjny . Na rysunku przedstawiono stan podstawowy i jeden ze stanów wzbudzonych. Poziomy oscylacyjne związane z każdym stanem elektronowym przedstawiono przy pomocy linii poziomych .
Wibronowe funkcje falowe maja postać
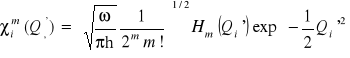
gdzie
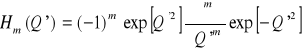
i
![]()
Prawdopodobieństwo przejścia jest proporcjonalne do kwadratu momentu przejścia
![]()
W niskiej temperaturze widmo emisji dane jest przez przejścia ze stanu poczatkowego ![]()
Wówczas kolejne linie będą miały natężania
![]()
Analogicznie będzie w przypadku absorpcji . Stanem początkowym będzie stan ![]()
a prawdopodobieństwa przejść do kolejnych stanów wibracyjnych wzbudzonego stanu elektronowego będą dane wzorem
![]()
![]()
gdzie ![]()
oznacza liczbę fononów , która mieści się w energii relaksacji sieci
![]()
Ptra rysune 2.
Widmo absorpcji i emisji przedstawione jest na rysunku 3.
1
8
Wyszukiwarka