WODA
Woda - Arystoteles uznał ją za jeden z 4 pierwiastków - ziemia, ogień, powietrze i woda. Cavendish w 1781 r. wykazał, że woda powstaje podczas spalania wodoru w powietrzu. Lavoisier w 1781 r. wykazał, że woda jest związkiem wodoru z tlenem. Niezbędny związek do życia.
Woda w naturze ma różny stopień czystości. Zawiera rozpuszczone gazy i sole.
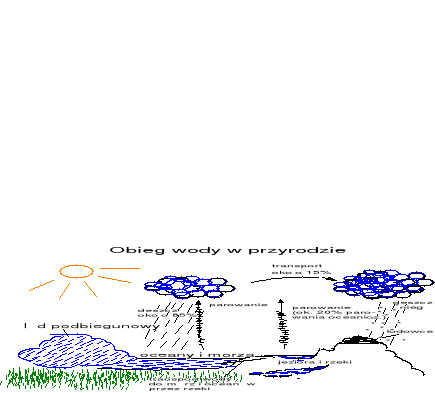
Woda w naturze.
![]()
Oceany i morza 97,33 %
Słone jeziora i morza wewnętrzne 0,008 % wody słone
![]()
Lodowce i lód na biegunach 2,04 %
Wody gruntowe 0,61 %
Jeziora 0,009 % wody słodkie
Woda w glebie (wilgoć) 0,005 %
Woda w atmosferze 0,001 %
Rzeki 0,0001 %
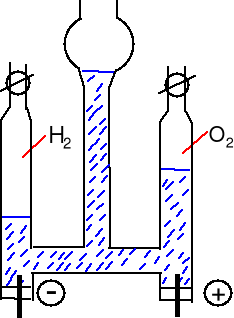
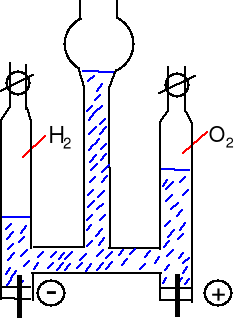
Rozkład wody - elektroliza wody zakwaszonej H2SO4.
Aparat Hoffmanna.
Jony H3O+, SO42-, HSO4-
Katoda (-) redukcja
2H+(aq) + 2e = H2
Anoda (+) utlenienie
H2O = 2H+(aq) + 2e + ˝O2
Substancje rozpuszczone we wodach w środowisku.
Wody naturalne - rozpuszczone substancje gazowe:
O2 - warunkuje życie we wodzie
N2 - z azotu atmosferycznego
CO2 - dość dobrze rozpuszcza się we wodzie
NH3 - zanieczyszczenia biologiczne wody
H2S - zanieczyszczenia biologiczne wody, także wody mineralne.
Wody naturalne - rozpuszczone substancje jonowe:
Wody morskie i oceaniczne - zasolenie do 3,5 % (2,7 % NaCl). Bałtyk 1,1 % (0.8 % NaCl). Występują przede wszystkim jony Na+, K+, Mg2+, Ca2+, Cl- , Br- , I-, SO42-, HCO3-.
Wody gruntowe - zanieczyszczone składnikami gleby z którą się kontaktują. Zawierają z reguły sole wapnia, magnezu, żelaza i glinu z anionami wodorowęglanowymi HCO3- , chlorkowymi, siarczanowymi (VI). Są we warstwach wodonośnych.
Wody mineralne - wydobywają się na powierzchnię z większych głębokości. Nie mają zanieczyszczeń organicznych, lecz więcej substancji mineralnych.
Wykrywanie niektórych anionów i kationów zawartych we wodzie.
a) chlorki Cl- + Ag+ → AgCl↓ (biały osad, fioletowieje na świetle)
b) siarczany(VI) SO42- + Ba2+ = Ba SO4↓ (biały osad)
c) wapń Ca2+ + C2O42- = CaC2O4↓ (biały osad, nier. w CH3COOH)
d) żelazo 2Fe2+ + H2O2 + 2H3O+ = 2Fe3+ + 4H2O
Fe3+ + 3SCN- = Fe(SCN)3 Fe(SCN)3 + 3KSCN = K3[Fe(SCN)6]
Woda pitna i przemysłowa.
Woda pitna, bez smaku i zapachu, bez substancji organicznych i bez metali ciężkich. Filtracja i chlorowanie lub ozonowanie lub działanie ClO2.
Przemysł chemiczny i przemył energetyczny - praktycznie chemicznie czysta woda. Kamień kotłowy - CaCO3, CaSO4, CaSiO3, MgSiO3 i Mg(OH)2 oraz związki żelaza i glinu.
Twardość wody. Twardość wody - przyczyna rozpuszczone nieorganiczne związki wapnia, magnezu, żelaza i glinu. Mierzy się w stopniach. Stopień niemiecki 1oN odpowiada 10 mg CaO w 1 dm3 wody.
Woda twarda nie tworzy piany z mydłem sodowym lub potasowym.
Twardość całkowita - wszystkie sole wapniowe i magnezowe obecne we wodzie.
Twardość węglanowa (przemijająca) - zawartość Mg(HCO3)2 i Ca(HCO3)2. Ca(HCO3)2 = CaCO3(s) + CO2(g) + H2O
Mg(HCO3)2 = Mg(OH)2(s) + 2CO2(g)Twardość trwała (niewęglanowa) - zawartość MgSO4, CaSO4, MgCl2, CaCl2, MgSiO3 i CaSiO3.
Twardość trwała = twardość całkowita - twardość węglanowa
Oznaczanie twardości węglanowej, miareczkowanie kwasem solnym wobec oranżu metylowego od barwy żółtej do czerwonego zabarwienia
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2 + 2H2O zmiana barwy pH 3.1 - 4.4
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2 + 2H2O tylko twardość węglanowa
CaO + 2HCl = CaCl2 + H2O
PN - 100 cm3 wody. Miareczkowanie 0.1 M HCl. Przykładowo zużycie HCl v = 3,5 cm3 0,1 M roztworu. zmiana barwy pH kwaśny 3,1-4,4(mniej kwaśny) Oblicz twardość węglanową.
1 cm3 0.1M HCl 0,001 dm3 ∙ 0,1M = 10-4 mola
2 mole HCl - 56 g CaO
1 mol HCl : 28 g CaO = 10-4 mola : x
x = 28 ∙ 10-4 g CaO = 2.8 mg CaO
1 cm3 0.1M HCl odmiareczkowuje 2.8 mg CaO
1 dcm3 wody - 35 cm3 0,1 M = 35 ·2,8 mg CaO,
co odpowiada 98 mg CaO co daje 9,8ºN.
Chemiczne zmiękczanie wody.
Działanie mlekiem wapiennym i następnie węglanem sodu
MgCl2 + Ca(OH)2 = Mg(OH)2(s) + CaCl2
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2(s) + 2CaCO3(s) + 2H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3(s) + 2H2O
CaSO4 + Na2CO3 = CaCO3(s) + Na2SO4
metoda tania, do instalacji niskociśnieniowych
Działanie ortofosforanem (V) sodu Na3PO4 albo polifosforanami
3Ca(HCO3)2 + 2 Na3PO4 = Ca3(PO4)2(s) + 6NaHCO3
3MgCl2 + 2 Na3PO4 = Mg3(PO4)2(s) + 6NaCl
metoda droższa, do instalacji średniociśnieniowych
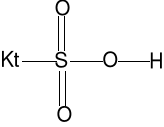
Wymiana jonowa, wymieniacz jonowy zdolny do wymiany kationów to kationit ( np. minerały zeolity).
2Kt-Na(s) + Ca2+ = Kt2Ca(s) + 2Na+
Podobną metodą jonitową można przeprowadzić demineralizację wody, która zawiera np. MgCl2
kationit Kt-SO3H, wymienia M2+ na
H3O+, Kt - polimer (żywica) zawierający
wiele grup sulfonowych SO3H
2KtSO3H(s) + 2H2O + Mg2+ = (KtSO3)2Mg(s) + 2H3O+ (zbiornik K)
kwaśny roztwór HCl prowadzony jest na złoże anionitowe wymieniające aniony na grupy OH-
Anionit An-OH
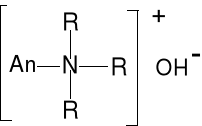
An - polimer(żywica) zawierająca wiele
grup zasad amoniowych (RNR3+)(OH-),
R może być H lub grupa organiczna.
(AnNR3+)(OH-)(s) + Cl- = (AnNR3+)(Cl-)(s) +OH- (zbiornik A)
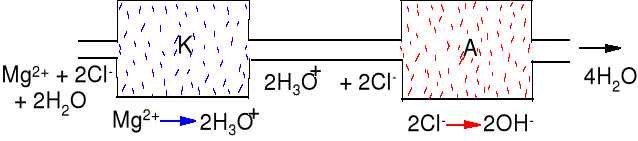
Regeneracja kationitu i anionitu.
Kationit przemywamy kwasem solnym, anionit roztworem NaOH
metoda najlepsza, do instalacji wysokociśnieniowych, n. p. elektrociepłownie
Metody oczyszczania wody
destylacja - najczystsza woda w aparaturze ze szkła kwarcowego lub z metali szlachetnych.
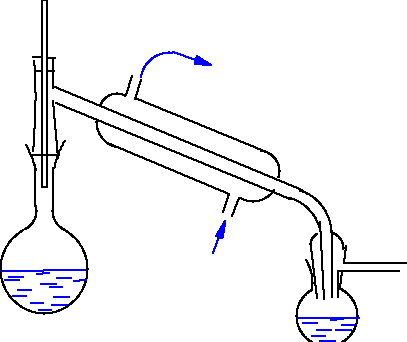
Wymieniacze jonowe.
Techniki membranowe.
Właściwości fizyczne wody. (Wpływ wiązania wodorowego)
d(max w 3,98 oC) - lód ma znacznie mniejszą gęstość (0,92 g . cm-3) w 0 oC niż woda (0,999 g . cm-3). W stanie krystalicznym i ciekłym liczba najbliższych cząsteczek wynosi około 4. Stała dielektryczna ε = 78,4 bardzo duża. Temp. topnienia i temp. wrzenia są bardzo wysokie w porównaniu do innych związków typu H2E (E - tlenowiec):
temperatury wrzenia i topnienia wodorków tlenowców (oC):
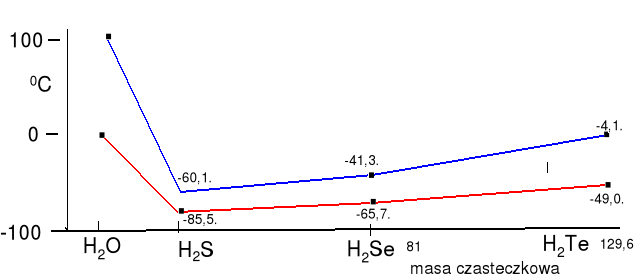
Woda pod wysokim ciśnieniem i w wysokiej temperaturze ( 220,6 bar i 374 ºC ma zupełnie inne właściwości. Jeżeli zerwany jest układ wiązań wodorowych, wykazuje ona właściwości eterów, rozpuszcza węglowodory i tłuszcze. Wykazuje w tych warunkach właściwości korozyjne.
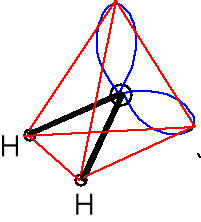
Właściwości chemiczne wody. geometria par elektr.
Wzór Lewisa Kształt cząsteczki atomu centr. AX2E2
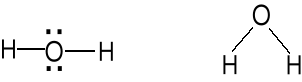
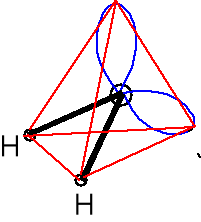
Zasada Lewisa
H2(g) + ½O2(g) = H2O(l) ΔHtwo = -285,8 kJ . mol-1.
Dysocjacja jonowa wody 2H2O H3O+ + OH- [H3O+] . [OH-] = 10-14
Czysta woda - odczyn obojętny (pH = 7) ,
badanie fenoloftaleiną ( bezbarwna 8,3-10 czerwona),
badanie błękitem bromotymolowym (żółty 6,0-7,6 niebieski),
badanie papierkiem uniwersalnym (wg skali)
Rozpuszczalność soli - hydratacja kationu (jako zasada Lewisa) i czasami anionu, a szczególnie oksoanionu (wiązania wodorowe).
AlCl3(s) + xH2O = [Al(OH2)6]3+(aq) + 3Cl-(aq) LK kationu = 6
Reakcje ze związkami metaloorganicznymi i związkami Grignarda
CaC2 + 2H2O = C2H2 + Ca(OH)2 (napisać w formie jonowej, jon C22-)
C4H9Li + H2O = C4H10 + LiOH
Reakcja z metalami np. Mg (dodatek NH4Cl) lub Al (aktyw. pow.).
Mg(s) + 2H2O(l) = Mg(OH)2(s) + H2(g)
Mg(OH)2(s)+ 2NH4Cl(aq) = MgCl2(aq) + 2NH3(aq) NH4Cl oczyszcza
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH3 . H2O powierzchnię Mg
Reakcja z węglem i tlenkiem węgla CO (patrz wodór)
C + H2O = CO + H2 (1500 K)
CO + H2O = CO2 + H2 (ok. 600 K, kat)
Reakcja z metanem CH4 (patrz wodór)
CH4(g) + H2O(g) = CO(g) + 3H2(g)
Reakcje z halogenkami niemetali
PCl5 + 4H2O → H3PO4 + 5HCl
SiCl4 + 2H2O → SiO2 + 4HCl
BCl3 + 3H2O → H3BO3 + 3HCl
Rodzaje wody występujące w związkach chemicznych.
woda konstytucyjna, wydzielająca się przy ogrzewaniu związków, nie jest związana koordynacyjnie z kationem lub anionem, jest związana chemicznie w jonach w ilości stechiometrycznej.
Ca(OH)2(s) = CaO(s) + H2O(c) znak ΔH reakcji
2NaHCO3(s) = Na2CO3(s) + H2O(c) + CO2(g)
KH2PO4(s) = KPO3(s) + H2O(l]woda krystalizacyjna, jest związana z kationem (wiązanie koordy
nacyjne lub oddziaływania elektrostatyczne) - tak zwana woda kationowa lub z anionem (wiązania wodorowe) - woda anionowa. Woda jest związana w ilości stechiometrycznej. Liczba cząsteczek wody przyłączonych do kationu, jeżeli ligandem jest tylko woda. jest to liczba koordynacyjna kationu. Zależy od rozmiaru kationu. [Be(OH2)4]2+, [Mg(OH2)6]2+, [Al(OH2)6]3+.
BeCO3 . 4H2O, BeSO4 . 4H2O, BeCl2 . 4H2O
MgSO4 . 7H2O, Mg(ClO4)2 . 6H2O, MgCl2 . 6H2O
Fe(NO3)2 . 6H2O, FeCl3 . 6H2O, Fe(NH4)2(SO4)2 . 6H2O
Ogrzewanie uwodnionych soli powoduje stopniowe odszczepienie cząsteczek wody.
CaSO4 . 2H2O → CaSO4 . 0.5 H2O + 1.5 H2O
2CaSO4 . 2H2O → 2CaSO4 . H2O + 3 H2O
CuSO4 . 5H2O → CuSO4 . H2O + 4 H2O
CuSO4 . H2O → CuSO4 + H2O
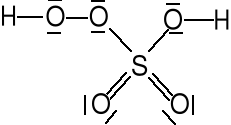
NADTLENEK WODORU
Ciecz prawie bezbarwna, mieszająca się z wodą, t. w. = 150,5 °C.
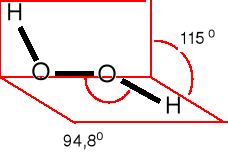
O—O 147.5 pm (gaz)
Otrzymywanie.
Metoda laboratoryjna
BaO2 + H2SO4 → H2O2 + BaSO4 (H2SO4 około 30 %)
Wykrywanie.
TiOSO4 + H2O2 + 2H2O = H2SO4 + H4TiO5
(kwas nadtlenotytanowy żółty)
H2Cr2O7 + 4H2O2 = 5H2O + 2CrO5 (CrO5 niebieski w eterze)
Metody przemysłowe. Metoda chinonowa (I. G. Farbenindustrie)
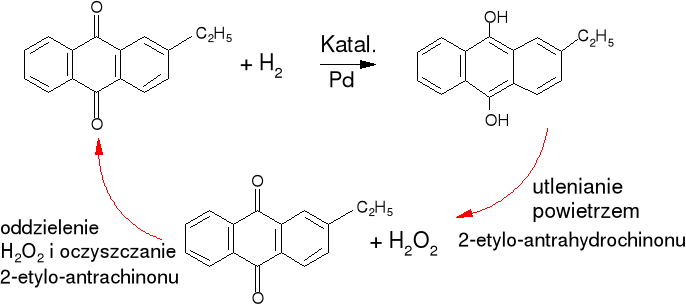
Właściwości chemiczne.
Nietrwały, lecz bez katalizatorów rozkład przebiega powoli.
H2O2(c) H2O(c) + ½ O2(g) ΔHo = -98,2 kJ . mol-1
Katalizatory, Pt, MnO2, alkalia, kurz. Przechowywanie (stabilizatory). 80% roztwór jest stosowany często jest w procesach technologicznych, np. do produkcji epoksydów, do produkcji innych środków bielących oraz do napędu torped. 30% roztwór zwany jest perhydrolem często stosowany do bielenia. 3% jest to woda utleniona stosowany do dezynfekcji.
Właściwości utleniające.
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4
Mn(OH)2 + H2O2 = MnO2 + 2H2O
2KI + H2SO4 + H2O2 = K2SO4 + 2H2O + I2
KOH + Cr(OH)3 + H2O2 = K2CrO4 + H2O (dobierz współczynniki)
Właściwości redukujące.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5O2
Ag2O + H2O2 = 2Ag + H2O + O2 (Ag2O rozpuszcza się w NH3 . H2O)
2K3[Fe(CN)6] + H2O2 + 2KOH = 2K4[Fe(CN)6] + 2H2O + O2
ClO- + H2O2 → Cl- + 1O2 + H2O 1O2 → 3O2 + hν
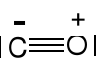
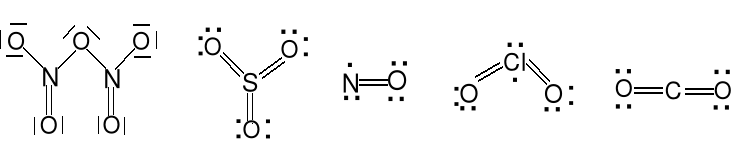
Tlenki . Wiązanie E=O lub E—O—E, potrójne wiązanie
Jon tlenkowy O2-. Tlenki kwasowe, zasadowe i amfoteryczne.
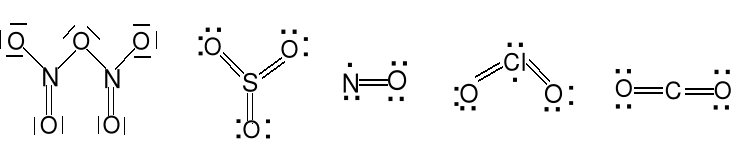
N2O5 SO3 NO ClO2 CO2
Tlenki kwasowe: N2O5, SO3, ClO2, SO2, NO2, CO2, CrO3, Mn2O7, SiO2.
N2O5 + H2O → 2HNO3 N2O5 + K2O → 2KNO3
N2O5 + 2NaOH → 2NaNO3 + H2O
2ClO2 + 2NaOH → NaClO3 + NaClO2
2ClO2 + Na2CO3 → NaClO3 + NaClO2 + CO2
Tak samo zachowuje się NO2
SiO2 + 2NaOH → Na2SiO3 + H2O
Tlenki niemetali nie reagujące z wodą kwasowo: NO, CO, N2O.
Tlenki zasadowe: CaO, K2O, CrO, Tl2O, Ag2O.
CaO + H2O → Ca(OH)2
CaO + 2HCl → CaCl2 + H2O
CrO + 2HCl → CrCl2 + H2O
Tlenki amfoteryczne: SnO, PbO, CuO, Cr2O3, Al2O3, ZnO, BeO.
ZnO + 2HCl → ZnCl2 + H2O
ZnO + H2O + 2NaOH → Na2[Zn(OH)4]
Nadtlenki. Wiązanie E—O—O—E, jon nadtlenkowy O22- (BaO2).
Kwasy nadtlenowe. 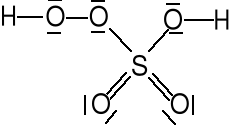
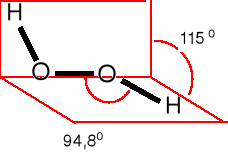
Kwas nadtlenojednosiarkowy
(kwas Karo)
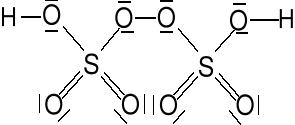
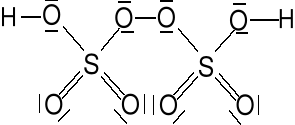
Kwas nadtlenodwusiarkowy
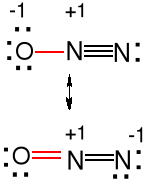
Ponadtlenki. Znane dla Na, K, Rb, Cs, jon ponadtlenkowy O2- (KO2).
O2- paramagnetyczny
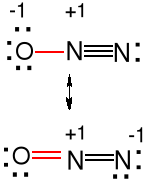
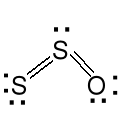
Podtlenki. Zawierają często wiązanie E—E
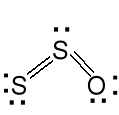
N2O tlenek diazotu S2O tlenek disiarki
tlenek azotu (I) tlenek siarki (I)
podtlenek azotu
cząsteczka liniowa cząsteczka kątowa
1
![]()
![]()
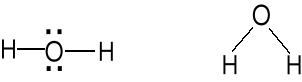
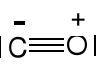
Wyszukiwarka