![]()
(1)
Numer ćwiczenia : 4 |
Temat ćwiczenia : Adsorpcja |
Data wykonania: 10.05.2014 |
Grupa : 1 Zespół : 1 |
Wykonawcy ćwiczenia : Tomasz Bugaj Beata Duda Martyna Pokwiczał Marta Tempka |
Ocena : |
1. Cel ćwiczenia :
Celem ćwiczenia jest doświadczalne wyznaczenie izotermy adsorpcji kwasu octowego na węglu aktywnym oraz sprawdzenie stosowalności równań Freundlicha i Langmuira do opisu badanego procesu.
2. Przyrządy i odczynniki :
- 7 kolb płaskodennych o pojemności 500 [cm3],
- 7 butelek z doszlifowanymi korkami,
- kolbki do przeprowadzania miareczkowania,
- pipety i cylindry miarowe o rożnej pojemności i dokładności:
Tabela 1.
strzęt lab.[ml] |
tolerancja[l] |
pipeta 5 |
0,000002 |
pipeta 10 |
0,00002 |
pipeta 25 |
0,00003 |
cylinder 80 |
0,00075 |
cylinder 250 |
0,0015 |
biureta 50 |
0,00075 |
- waga o dokładności ważenia 0,01 [g],
- lejki,
- bibułki do przesączania roztworów,
- próbki węgla aktywnego po 4,5 [g] na każdy przygotowany roztwór kwasu octowego,
- do przygotowania roztworów kwasu octowego o pożądanym stężeniu używaliśmy wody
destylowanej oraz kwasu octowego o stężeniu 2 [mol/dm3];
3. Wykonanie cwiczenia :
W kolbach płaskodennych o pojemności 500 [cm3] przygotowano pięć roztworów kwasu octowego o różnych stężeniach, według przepisu zamieszczonego w sali laboratoryjnej. Następnie miareczkowano te roztwory zasadą sodowa w obecności fenoloftaleiny (3-4 krople), w celu dokładnego oznaczenia ich stężenia.
Do butelek z doszlifowanymi korkami wlano po 150 ml poszczególnych roztworów i wsypano po 4,5 g węgla aktywnego. Przez 15 minut wstrząsano butelkami, a następnie po dokładnym wymieszaniu roztworów przesączono je i zmiareczkowano, 1 molowym roztworem NaOH. Wyniki obu miareczkowań zestawiono w tabeli 1.
4.Opracowanie wyników:
Tabela 2 - wyniki miareczkowań:
|
Wyniki miareczkowania roztworów kwasu octowego przed adsorpcją. Średnia VNaOH [cm3] |
Wyniki miareczkowania roztworów kwasu octowego po adsorpcji. Średnia VNaOH [cm3] |
Próbka nr 1 |
5,73 |
2,37 |
Próbka nr 3 |
14,67 |
9,23 |
Próbka nr 4 |
12,8 |
7,3 |
Próbka nr 5 |
10,57 |
7,1 |
Próbka nr 7 |
9,77 |
7,93 |
Próbka nr 8 |
13,73 |
11,17 |
Próbka nr 9 |
19,47 |
13,5 |
Na podstawie uzyskanych wyników miareczkowania obliczono stężenia badanych roztworów kwasu octowego przed adsorpcją (c1) oraz po adsorpcji (c2).
CH3COOH + NaOH → CH3COONa + H2O
Z zapisu równania reakcji chemicznej kwasu octowego z zasadą sodową wiadomo, że jeden mol CH3COOH reaguje z jednym molem NaOH tworząc jeden mol CH3COONa. Na tej podstawie można napisać wzór 1, który pozwoli obliczyć stężenia badanych próbek roztworów kwasu octowego.
![]()
(1)
gdzie:
c - stężenie badanego roztworu [mol/dm3]
VNaOH - objętość 0,1 M NaOH zużytego w miareczkowaniu [cm3]
CNaOH - stężenie NaOH, równe 0,1 [mol/dm3]
Vroztworu - objętość roztworu pobranego do miareczkowania [cm3]
Tabela 3 - zestawienie stężeń roztworów przed i po adsorpcji:
|
Stężenia roztworów kwasu octowego przed adsorpcją c1 [mol/dm3] |
Stężenia roztworów kwasu octowego po adsorpcji c2 [mol/dm3]
|
Próbka nr 1 |
0,0127 |
0,0053 |
Próbka nr 3 |
0,0489 |
0,031 |
Próbka nr 4 |
0,0853 |
0,0487 |
Próbka nr 5 |
0,1057 |
0,071 |
Próbka nr 7 |
0,1954 |
0,1586 |
Próbka nr 8 |
0,2746 |
0,2234 |
Próbka nr 9 |
0,3894 |
0,2700 |
Następnie obliczono ilość moli kwasu octowego, jaka została zaadsorbowana
przez 1 g węgla aktywnego w każdej z badanych próbek zgodnie ze wzorem 2 (wyniki - tabela 3):
![]()
(2)
gdzie:
x - ilość moli substancji zaadsorbowanej przez 1 gram adsorbentu
V - objętość roztworu kwasu octowego, użytego do adsorpcji, równa 150 [cm3]
mC - masa węgla aktywnego, użytego do adsorpcji, równa 4,5 [g]
(c1-c2) - różnica stężeń roztworów kwasu octowego, przed i po adsorpcji
Tabela 4.
|
x [mol/g] |
Próbka nr 1 |
0,0002 |
Próbka nr 3 |
0,0006 |
Próbka nr 4 |
0,0012 |
Próbka nr 5 |
0,0012 |
Próbka nr 7 |
0,0012 |
Próbka nr 8 |
0,0017 |
Próbka nr 9 |
0,0040 |
Kolejnym krokiem jest oszacowanie niepewności obliczonych wartości stężeń oraz adsorpcji, na podstawie tolerancji wykorzystywanych urządzeń pomiarowych.
Błąd w wyznaczonym stężeniu próbek kwasu octowego można zapisać:
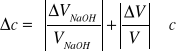
(3)
gdzie:
∆VNaOH - dokładność biurety, równa 0,1 [cm3];
VNaOH - objętość roztworu NaOH zużytego w miareczkowaniu;
∆V - dokładność pipet i cylindrów miarowych, używanych do pobierania roztworów
kwasu octowego;
V - objętość roztworu kwasu octowego pobrana do miareczkowania.
Niepewność adsorpcji szacujemy na podstawie prawa przenoszenia niepewności, metodą pochodnej logarytmicznej.
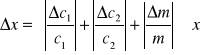
(4)
gdzie: c1 - stężenie kwasu octowego przed adsorpcją
![]()
niepewność stężenia kwasu octowego przed adsorpcją
c2 - stężenie kwasu octowego przed adsorpcją
![]()
niepewność stężenia kwasu octowego po adsorpcji
m - masa adsorbentu - węgla aktywnego, równa 4,5 [g]
![]()
błąd pomiaru masy adsorbentu, równy 0,01 [g]
Przeprowadzając obliczenia według powyższych wzorów uzyskano wyniki zebrane w tabeli 4:
Tabela 5.
|
c1 |
∆c1 |
c2 |
∆c2 |
x |
∆x |
Próbka nr 1 |
0,0127 |
0,001625 |
0,0053 |
0,001625 |
0,0003 |
0,00012 |
Próbka nr 3 |
0,0489 |
0,0198 |
0,0310 |
0,0198 |
0,0015 |
0,00048 |
Próbka nr 4 |
0,0853 |
0,0323 |
0,0487 |
0,0323 |
0,0012 |
0,00085 |
Próbka nr 5 |
0,1057 |
0,0486 |
0,0710 |
0,0486 |
0,0012 |
0,00105 |
Próbka nr 7 |
0,1954 |
0,1105 |
0,1586 |
0,1105 |
0,0017 |
0,00195 |
Próbka nr 8 |
0,2746 |
0,1564 |
0,2234 |
0,1564 |
0,0017 |
0,00274 |
Próbka nr 9 |
0,3894 |
0,1888 |
0,2700 |
0,1888 |
0,0400 |
0,00389 |
Na podstawie uzyskanych wyników można wykreślić doświadczalną izotermę adsorpcji kwasu octowego na węglu aktywnym - zależność ilości kwasu octowego zaadsorbowanego przez jednostkę masy adsorbentu x od stężenia roztworu po osiągnięciu stanu równowagi c2 (wykres 1).
Wykres 1.
Sprawdzenie stosowalności równania Freundlicha:
W celu sprawdzenia stosowalności empirycznego równania izotermy Freundlicha w postaci:
![]()
(5)
gdzie: x - ilość moli substancji zaadsorbowanej przez 1 gram adsorbentu
c2 - stężenie roztworu w stanie równowagi adsorpcyjnej
k, n - parametry zależne od temperatury, rodzaju adsorbentu i adsorbatu
należy powyższe równanie zlogarytmować:
![]()
(6)
Otrzymuje się zależność liniową ![]()
,
gdzie: b = logk
a = n
Doświadczalna izoterma adsorpcji oraz teoretyczna izoterma Freundlicha wyznaczona na podstawie regresji liniowej. Wyniki przedstawione w układzie logx = f(logc2) obrazuje wykres 2.
0,000333 |
0,000823 |
0,001037 |
0,001258 |
0,001899 |
0,002264 |
0,002495 |
Równanie regresji liniowej wyznaczone przy pomocy programu Excel:
y = 0,589x - 2,269 (7)
Korzystając z zależności 6 i 7 wyznaczono:
a=n |
|
|
|
n= |
0,5126 |
b=log(k) |
b= |
-2,3115 |
k= |
0,004881 |
|
Tabela 6- ilość moli substancji zaadsorbowanej przez 1 gram adsorbentu (x) zgodnie z izotermą Freundlicha
oraz dane doświadczalne:
|
c2 [mol/dm3] |
x [mol/g] dla izotermy Freundlicha |
x [mol/g] dla danych doświadczalnych |
Próbka nr 1 |
0,0053 |
0,000333 |
0,00025 |
Próbka nr 3 |
0,0310 |
0,000823 |
0,00060 |
Próbka nr 4 |
0,0487 |
0,001037 |
0,00122 |
Próbka nr 5 |
0,0710 |
0,001258 |
0,00116 |
Próbka nr 7 |
0,1586 |
0,001899 |
0,00123 |
Próbka nr 8 |
0,2234 |
0,002264 |
0,00171 |
Próbka nr 9 |
0,2700 |
0,002495 |
0,00398 |
Sprawdzenie stosowalności równania Langmuira:
W celu sprawdzenia stosowalności równania Langmuira przekształcono równanie izotermy Langmuira do postaci:
![]()
(8)
gdzie: x - liczba moli substancji zaadsorbowanej przez jednostkową masę adsorbentu ,
x0 - liczba moli substancji zaadsorbowanej przez jednostkową masę powierzchni
adsorbentu w stanie pełnego obsadzenia jego powierzchni warstwą
jednocząsteczkową ,
k - stała zależna od temperatury,
Uzyskuje się zależność liniową, typu ![]()
,
gdzie: ![]()
![]()
Doświadczalna izoterma adsorpcji oraz teoretyczna izoterma Langmuira wyznaczona na podstawie regresji liniowej. Wyniki przedstawione w układzie c2/x = f(c2) obrazuje wykres 3.
Wykres 3
Równanie regresji liniowej wyznaczone przy pomocy programu Excel:
y = 286,1x + 38,79 (9)
Korzystając z zależności 8 i 9 wyznaczono:
a= 1/x0 |
a= |
245,49 |
xo=1/a |
x0= |
0,0041 |
|
|
|
b=k/x0 |
b= |
34,823 |
k=b*x0 |
k= |
0,141851 |
|
|
|
Obliczenie ilości moli substancji zaadsorbowanej przez 1 gram adsorbentu (x) zgodnie z izotermą Langmuira wg wzoru 10:
![]()
(10)
Tabela 7 - ilość moli substancji zaadsorbowanej przez 1 gram adsorbentu (x) zgodnie z izotermą Langmuira oraz
dane doświadczalne:
|
c2 [mol/dm3] |
x [mol/g] dla izotermy Langmuira |
x [mol/g] dla danych doświadczalnych |
Próbka nr 1 |
0,0053 |
0,00015 |
0,00025 |
Próbka nr 3 |
0,0310 |
0,00073 |
0,00060 |
Próbka nr 4 |
0,0487 |
0,00104 |
0,00122 |
Próbka nr 5 |
0,0710 |
0,00136 |
0,00116 |
Próbka nr 7 |
0,1586 |
0,00215 |
0,00123 |
Próbka nr 8 |
0,2234 |
0,00249 |
0,00171 |
Próbka nr 9 |
0,2700 |
0,00267 |
0,00398 |
Następnie rysujemy wykres przedstawiający izotermę Freundlicha, Langmuira, oraz punkty
doświadczalne. Zaznaczone są także błędy ∆c2, a także ∆x: Iyopt
wykres 4
Wykres 5
4. Wnioski:
Na podstawie wykonanych pomiarów i obliczeń uzyskaliśmy izotermę adsorpcji mówiącą że ilość moli kwasu octowego, zaadsorbowanego przez 1 g węgla aktywnego rośnie ze wzrostem stężenia roztworów.
Adsorpcja to procesem wymagającym czasu, aby zaszła pewna równowaga adsorpcyjna. Dlatego należy się liczyć z tym, że nie zawsze udaje się uchwycić równowagę adsorpcyjną, co wpływa na jakość uzyskanych wyników.
Błędy mogą być spowodowane niedokładnością odmierzenia masy węgla, niedokładnym odczytem objętości roztworu miareczkującego bądź też niedokładnym sporządzeniem roztworów badanych. Można też zauważyć, że niepewności uzyskanych wyników maleją, im mniejsze próbki pobieramy do miareczkowania.
Na podstawie zamieszczonych wykresów widać, że równanie izotermy Langmuira najlepiej sprawdza się dla wyższych stężeń roztworów, zaś przy mniejszych odchyłki od rzeczywistych pomiarów są znaczne.