Aminokwasy
Budowa aminokwasów:
minimum jedna grupa aminowa i jedna grupa karboksylowa
w α-aminokwasach (czyli tych, które wchodzą w skład białek i nas interesują) obie te grupy są przyłączone do tego samego atomu węgla
atom węgla α jest wtedy asymetryczny - stąd wynikają właściwości optyczne aminokwasów
grupy funkcyjne białek występują w formie zjonizowanej
-COOH odszczepia proton dając -COO- (anion karboksylowy)
-NH2 przyłącza proton dając -NH3+ (kation amoniowy)
Aminokwasy w roztworach wodnych mogą występować w trzech formach. O tym , która z nich przeważy w danym momencie, decyduje:
stała dysocjacji grupy kwasowej
stała dysocjacji grupy aminowej
pH roztworu (stężenie jonów wodorowych)
Punkt izoelektryczny - wartość pH, przy której wyraźnie przeważa forma obojnacza aminokwasu. Można ją wyliczyć:
Podział aminokwasów ze względu na:
charakter łańcucha bocznego:
polarność łańcucha bocznego (to było na wykładzie):
miejsce syntezy
przemiany szkieletów:
charakter:
Wzory aminokwasów (w razie nieczytelności odsyłam do googli :D):
Metabolizm aminokwasów:
grupa NH2:
przeniesienie grupy α-aminowej na α-ketoglutaran (transaminacja)
glutaminian ulega hydrolizie z powrotem do α-ketoglutaranu oraz NH4+ (deaminacja oksydacyjna)
jak już pojawił się NH4+ to trzeba się go pozbyć, bo jest toksyczny wchodzi do cyklu mocznikowego
szkielet węglowy aminokwasu jest przekształcany w któryś z głównych intermediatów, a potem już sobie wchodzi do odpowiedniego szlaku metabolicznego, żeby nic się nie zmarnowało :) I stąd wziął się podział na aminokwasy ketogenne i glukogenne:
Przykładem aminokwasu, który nie bierze udziału w budowie białek jest homocysteina.

powstaje jako produkt uboczny podczas metabolizmu metioninyjest uważana za czynnik ryzyka rozwoju:
chorób sercowo-naczyniowych (zmiany miażdżycowe oraz zakrzepowe)
chorób neurodegeneracyjnych (Parkinson, Alzheimer)
nowotwór jelita grubego
Reakcje barwne aminokwasów:
Peptyd - cząsteczka chemiczna składająca się z aminokwasów połączonych wiązaniem peptydowym.
podział:
oligopeptydy - zawierające do 10 reszt aminokwasowych
polipeptydy - zawierające powyżej 10 reszt aminokwasowych
nazewnictwo:
zaczynamy od końca N
wymieniamy po kolei wszystkie aminokwasy łącząc poszczególne komponenty nazwy łącznikiem -ylo
przykład: glicyloalanina (Gly-Ala)
Wiązanie peptydowe:
znajdują się w jednej płaszczyźnie
do ich wytworzenia potrzebna jest energia, ponieważ równowaga tej reakcji jest przesunięta w kierunku hydrolizy (rozpadu), a nie syntezy
podczas tworzenia się jednego takiego wiązania powstaje 1 cząsteczka wodyPeptydy naturalne:
niezbędny do działania niektórych enzymów
dzięki niemu (i reduktazie glutationowej) mogą powstawać wiązania disiarczkowe
sprzęganie metabolitów ksenobiotyków (czyli usuwa ble rzeczy z organizmu)
uczestniczy w zachowaniu równowagi procesów red-oks (może występować w formie zredukowanej i utlenionej)
wykorzystywany jako ligand do wiązania żelaza
jest antyoksydantem
Forma |
Elektroforeza |
W jakim pH występuje? |
1) Dodatnio naładowana (obie grupy sprotonowane) |
cząsteczka „wędruje” do katody (tego z minusem?) |
W niskim (jest dużo jonów H+ w roztworze, więc przyłączają się do gr. -NH2 |
2) Jon obojnaczy (zwitterjon) |
cząsteczka nie rusza się, bo jest obojętna |
Gdzieś tak pośrodku (zależy od aminokwasu) patrz wykresie niżej |
3) Ujemnie naładowana (grupy z odłączonymi protonami) |
cząsteczka „wędruje” do anody (tego z plusem) |
W wysokim (mało jonów H+ więc układ dąży do tego, żeby uzupełnić brak i COOH oddaje proton) |
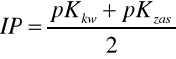
pKkw oraz pKzas są to stałe dysocjacji grupy kwasowej oraz zasadowej aminokwasu.
łańcuchowe |
pierścieniowe, w tym aromatyczne |
- alanina - cysteina - kwas asparaginowy - kwas glutaminowy - glicyna - leucyna - izoleucyna - lizyna - metionina - asparagina - glutamina - arginina - seryna - treonina - walina |
- fenyloalanina - histydyna - prolina - tryptofan - tyrozyna |
łańcuch niepolarny |
łańcuch polarny |
|
- glicyna - alanina - walina - leucyna - izoleucyna - metionina - prolina - fenyloalanina - tryptofan |
zjonizowany |
niezjonizowany |
|
- lizyna - arginina - histydyna - kwas asparaginowy - kwas glutaminowy |
- glutamina - tyrozyna - cysteina - treonina - seryna - asparagina
|
egzogenne (człowiek nie może ich syntezować - pobrać z zewnątrz) |
endogenne (synteza możliwa w organizmie człowieka) |
- fenyloalanina - histydyna - izoleucyna - leucyna - lizyna - metionina - arginina - treonina - walina - tryptofan |
- alanina - cysteina - kwas asparaginowy - kwas glutaminowy - glicyna - asparagina - prolina - glutamina - seryna - tyrozyna |
glukogenne (dostarczają pirogronianu) |
ketogenne (dostarczają acetylo-CoA) |
glukoketogenne |
- alanina - glicyna - cysteina - treonina - seryna - arginina - kwas glutaminowy - glutamina - kwas asparaginowy - asparagina - histydyna - prolina - metionina - walina |
- izoleucyna - leucyna - lizyna |
- tryptofan - fenyloalanina - tyrozyna |
zasadowe (przewaga grup NH2) |
kwasowe (przewaga grup COOH) |
obojętne (tyle samo obu grup) |
- histydyna - lizyna - arginina |
- kwas asparaginowy - kwas glutaminowy |
- alanina - cysteina - fenyloalanina - glicyna - leucyna - izoleucyna - metionina - asparagina - prolina - glutamina - seryna - treonina - walina - tryptofan - tyrozyna |
- potrzebny enzym: aminotransferaza
- alanina + α-ketoglutaran glutaminian + pirogronian
- asparaginian + α-ketoglutaran glutaminian + szczawiooctan
- nie ulegają: lizyna, treonina, prolina, hydroksyprolina
- produkt pośredni = zasada Schaffa
- potrzebne: NAD+, dehydrogenaza glutaminianowa
Intermediat |
Aminokwasy |
AMINOKWASY KETOGENNE |
|
acetylo-CoA |
izoleucyna, leucyna, tryptofan |
acetoacetylo-CoA |
leucyna, lizyna, fenyloalanina, tryptofan, tyrozyna |
AMINOKWASY GLUKOGENNE |
|
pirogronian |
alanina, cysteina, seryna, glicyna, treonina, tryptofan |
α-ketoglutaran |
arginina, glutamina, kw. glutaminowy, histydyna, prolina |
bursztynylo-CoA |
izoleucyna, walina, treonina, metionina |
fumaran |
asparaginian, fenyloalanina, tyrozyna |
szczawiooctan |
asparaginian |
Reakcja |
Co wykrywamy? |
Zasada |
Ksantoproteinowa |
pierścień benzenowy |
+ kwas azotowy żółte pochodne nitrowe później + NaOH pomarańcz (azi-nitrowe) |
Aldehydowa |
pierścień indolowy |
kondensacja z aldehydem w środowisku kwaśnym barwne produkty (np. fiołkowy) |
Cystynowa |
grupę sulfidową |
+ NaOH i temp. siarkowodór, a po dodaniu octanu ołowiu czarny PbS |
PEPTYDY
Nazwa |
Funkcja |
OLIGOPEPTYDY |
|
glutation |
patrz niżej |
met- i leuenkefaliny |
neuropeptydy |
oksytocyna, wazopresyna |
hormony |
angiotensyna, bradykinina |
kininy |
POLIPEPTYDY |
|
somatotropina |
hormony |
kortykotropina |
|
melanotropina |
|
insulina |
|
glukagon |
|
GLUTATION - γ-glutamylocysteinyloglicyna (GSH) - poniżej w formie zredukowanej:
Forma utleniona to taka z mostkiem siarczkowym (czyli chyba składa się jakby z dwóch glutationów - spałam na wykładzie najwyraźniej).
Funkcje:
Nie wiem czy nie pokopałam nazw, ale znaki są ok.
W razie problemów z zapamiętaniem: z ZEWNĄTRZ potrzebujemy aminokwasy egZogenne (tu „z” i tu „z” :D)
![]()
Wyszukiwarka