ALDEHYDY
Wiązanie >C=O jest co najmniej 2x bardziej polarne od wiązania pojedynczego -C—O—
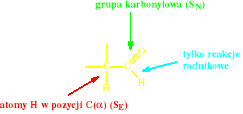
Aldehydowy (i ketonowy) atom węgla ma właściwości elektrofilowe i może być atakowany przez czynniki nukleofilowe
Podstawniki elektronoakceptorowe w R (Ar) podwyższają podatność atomu węgla na reakcje substytucji nukleofilowej (SN)
Podstawniki elektronodonorowe w R (Ar) obniżają podatność aldehydowego atomu węgla na reakcje substytucji nukleofilowej (SN)
Formaldehyd ma najbardziej reaktywną grupę karbonylową
Inne aldehydy alifatyczne są mniej reaktywne, bo grupy alkilowe wywierają dodatni efekt indukcyjny (+I)
Podatność ketonów na reakcje substytucji jest jeszcze mniejsza ze względu na zdwojenie efektu indukcyjnego
W aldehydach aromatycznych efekt mezomeryczny (+M) jest silniejszy niż efekt indukcyjny (+I) w aldehydach alifatycznych, dlatego aldehydy aromatyczne są mniej podatne na reakcje SN na atomie C, niż aldehydy alifatyczne
Od aldehydów aromatycznych mniej reaktywne (SN) są ketony aromatyczne
Najmniejszą reaktywność wykazują ketony diaromatyczne
Karbonylowy atom tlenu wykazuje tylko nieznaczne właściwości zasadowe, o kilka rzędów mniejsze niż tlen w alkoholach (wyraźnie amfoteryczny) i w eterach. Wynika to z jego hybrydyzacji sp2 (bo hybrydyzacja sp3 sprzyja występowaniu właściwości kwasowych)
Zmiany reaktywności związków karbony-lowych w zależności od rodzaju podstaw-nika przy karbonylowym atomie węgla

Wiązania reaktywne w aldehydzie
Reakcje substytucji nukleofilowej będą więc przebiegały według schematu:
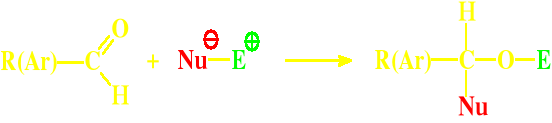
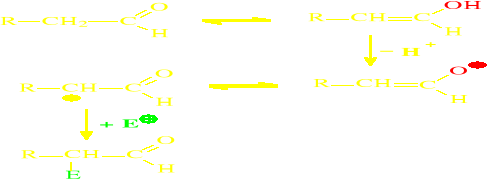
Reakcje substytucji elektrofilowej (SE) na
węglu a wytłumaczyć można występowaniem tautomerii keto-enolowej, której mogą ulegać aldehydy
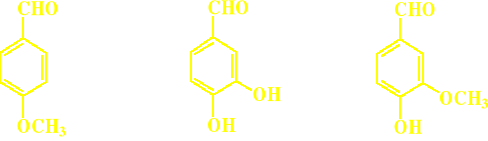
Aldehyd anyżowy Piperonal Wanilina
OTRZYMYWANIE ALDEHYDÓW:
Utlenianie alkoholi Iº rzędowych
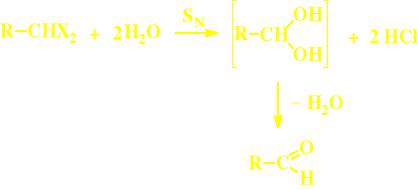
Hydroliza geminalnych dihalogenowęglowodorów
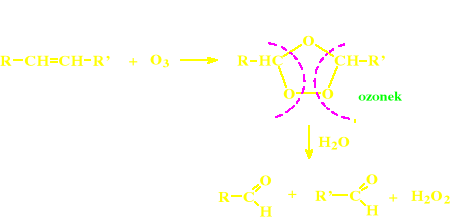
Hydroliza ozonków otrzymanych z alkenów
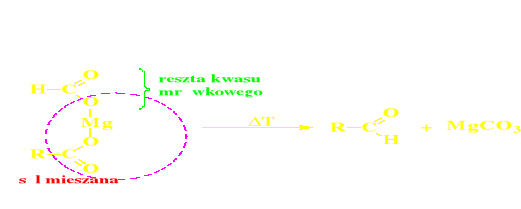
Piroliza mieszanych soli kwasu mrówkowego i innego (metoda Limprichta - Pirii)
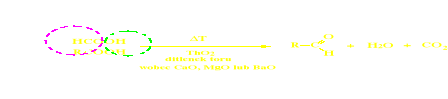
Modyfikacja metody pirolitycznej - metoda kontaktowa
Redukcja halogenków kwasowych (metoda Rosemunda)
Reakcje związków Grignarda z mrówczanem etylu
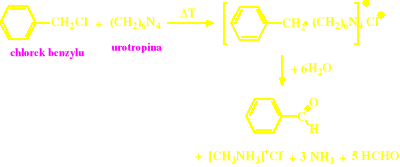
Reakcja chlorku benzylu z urotropiną (Reakcja Sommeleta) tylko dla aldehydów aromatycznych
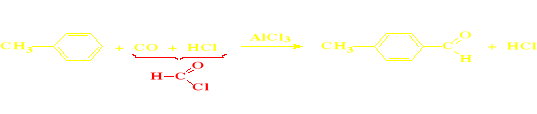
Utlenianie pochodnych toluenu (tylko dla aldehydów aromatycznych)
Redukcja nitryli aromatycznych chlorkiem cynawym (metoda Stephena)
Formylowanie metodą Gattermanna - Kocha (tylko aldehydy aromatyczne)
Metoda Vilsmeiera - z DMF i POCl3 (Ar)
Metoda Reimera - Tiemana - z fenolem i dichlorokarbenem (tylko aldehydy aromatyczne)
Formylowanie alkenów (reakcja „oxo”)
Metody specyficzne
○ aldehyd mrówkowy
▫ z metanolu, katalityczna
▫ z metanu, wobec AlPO4
○ aldehyd octowy
▫ addycja wody do acetylenu
▫ utlenianie etylenu powietrzem (metoda
Wackera)
Utlenianie alkoholi pierwszorzędowych
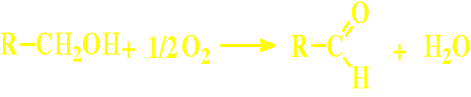
Stosuje się tu kompleksy związków chromu Cr6+ lub utlenianie katalityczne wobec Ag, Cu, lub Al.; ubocznie w tych reakcjach zachodzić może utlenienie do kwasów karboksylowych
Hydroliza geminalnych dihalogenowęglowodorów
Hydroliza ozonków (otrzymanych z alkenów)
Piroliza mieszanych soli Ca, Mg lub Ba,
w których jednym z kwasów musi być kwas mrówkowy
( = metoda Limprichta - Pirii)
Metoda kontaktowa (modyfikacja metody pirolitycznej)
Redukcja halogenków kwasowych
( = metoda Rosenmunda

stosuje się tu specyficzne (częściowo zatrute) katalizatory, bez zatrucia reakcja zachodziłaby dalej, do alkoholu
Katalizator = Pt lub Pd na BaSO4 wobec śladów tiomocznika
Reakcje estrów kwasu mrówkowego ze związkami Grignarda
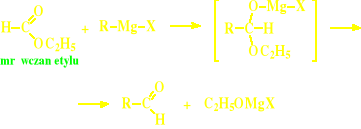
produktem jest dowolny aldehyd, zdeterminowany budową wyjściowego związku Grignarda;
otrzymany aldehyd może reagować na ogólnych zasadach z kolejną cząsteczką związku Grignarda więc reakcja wymaga „zatrzymania” na odpowiednim etapie
Reakcja Sommeleta (tylko do aldehydów aromatycznych)
Utlenianie pochodnych toluenu (tylko do aldehydów aromatycznych)
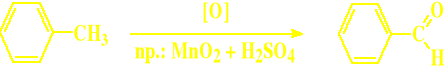
Redukcja nitryli ( = metoda Stephena) (tylko dla aldehydów aromatycznych)
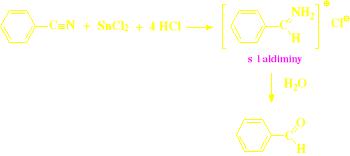
Metoda Gattermanna - Kocha (tylko dla aldehydów aromatycznych)
- jest to reakcja SE,
- reakcji tej ulegają tylko związki aromatyczne z podstawnikiem aktywującym (elektronodawczym),
- wymaga obecności katalizatora AlCl3,
- zwana jest reakcją formylowania,
- czynnikiem formylującym jest mieszanina tlenku węgla i chlorowodoru zachowująca się jak hipotetyczny chlorek formylu
Metoda Vilsmeiera (tylko dla aldehydów aromatycznych)
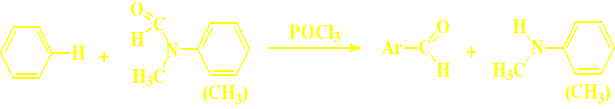
ogólnie:
Ar-H + N-metyloformanilid (a zazwyczaj
N,N-dimetyloformamid - czyli tzw DMF,
pełniący jednocześnie rolę rozpuszczalnika)
(HCON(CH3)2)
Metoda Reimera - Tiemana (tylko dla hydroksyaldehydów aromatycznych)
Fenol + Chloroform + NaOH
chloroform pod wpływem NaOH wytwarza dichlorokarben reagujący z fenolem w pozycji orto-
→ stąd inna nazwa = metoda karbenowa
1) wytworzenie karbenu
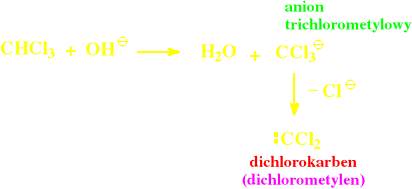
2) reakcja karbenu z fenolem
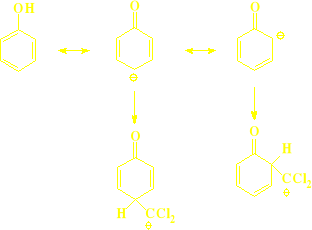
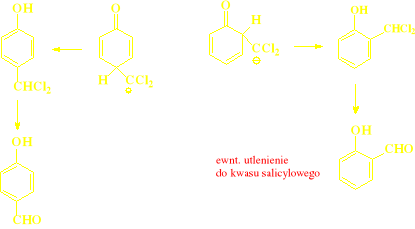
rozdzielenie met. destylacji z parą wodną, izomer orto- jest nielotny, bo tworzy wewnętrzne wiązanie wodorowe
Właściwości karbenów
Są nietrwałe
Nie są obdarzone ładunkiem
Mają wolną parę elektronów
Mają lukę oktetową
Są bardzo reaktywne
Karbenem jest także tlenek węgla
Formylowanie alkenów (reakcja „oxo”) jest to reakcja o znaczeniu przemysłowym
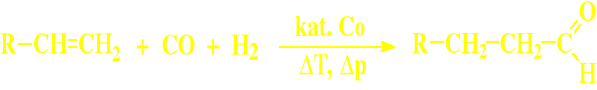
Metody specyficzne
○ Aldehyd mrówkowy
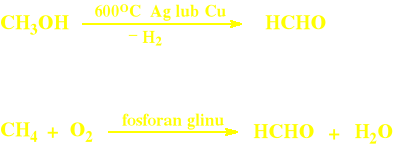
○ Aldehyd octowy
przyłączenie wody do acetylenu
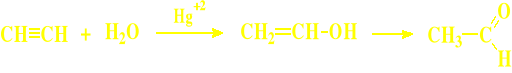
utlenienie etylenu powietrzem (metoda Wackera)

WŁAŚCIWOŚCI CHEMICZNE ALDEHYDÓW:
Ulegają reakcjom addycji do grupy karbonylowej
○ addycja bez wydzielenia produktów
ubocznych (zwykle wody) - są to
reakcje odwracalne
○ addycja z wydzieleniem wody w
kolejnym etapie reakcji - są to reakcje
nieodwracalne
○ addycja karboanionów czyli tzw.
reakcje kondensacjiAldehydy ulegają ponadto:
utlenieniu
metoda Meervrina Ponndorfa - Verley`a
metoda Clemmensena
inne metody
redukcji
dysproporcjonowaniu
reakcja Cannizaro
reakcja Cannizaro - Tiszczenki
chlorowcowaniu
polimeryzacji
Addycja bez wydzielenia produktów ubocznych (zwykle wody)
Są to reakcje odwracalne
Cyjanowodoru
Wodorosiarczynu sodowego
Amoniaku
Wody
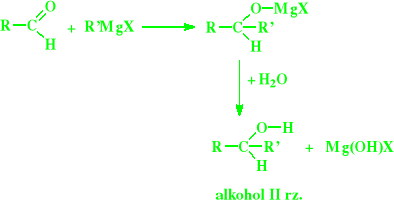
Związków Grignarda
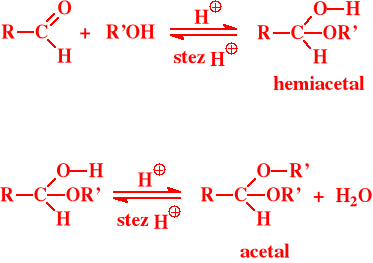
Alkoholu
Addycja cyjanowodoru:
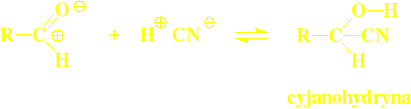
Addycja wodorosiarczanu sodu:
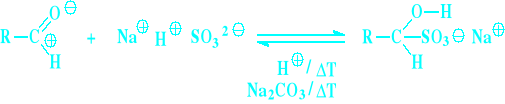
Addycja amoniaku:
Jest to reakcja specyficzna dla aldehydów, zasadniczo nie dają jej ketony - wyjątkiem jest aceton
Spośród aldehydów odmiennie reagują:
formaldehyd
aldehyd benzoesowy
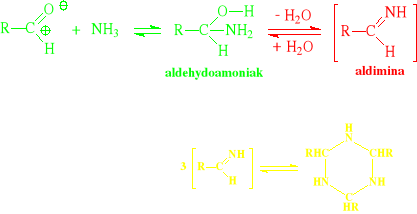
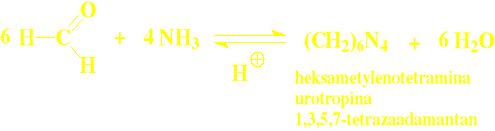
Do formaldehydu:
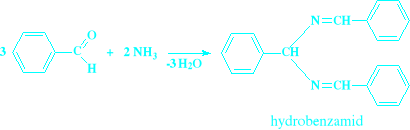
Do benzaldehydu:
Reakcja acetonu z amoniakiem:
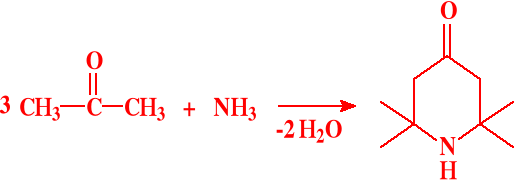
Addycja wody
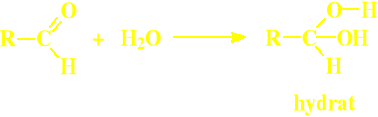
Addycja związków magnezoorganicznych:
Addycja alkoholu:
Jest to reakcja specyficzna dla aldehydów, zasadniczo nie dają jej ketony - wyjątkiem jest reakcja z niektórymi a-glikolami
Reakcja zachodzi w środowisku rozcieńczonych kwasów
Produktem przejściowym są hemiacetale a końcowym acetale
Acetale są niewrażliwe na środowisko zasadowe, ulegają rozkładowi w stężonych kwasach
Addycja z wydzieleniem cząsteczki wody
Reakcja zwykle zachodzi dwuetapowo, W pierwszym etapie powstaje nietrwały produkt przyłączenia a w drugim zachodzi natychmiastowa eliminacja wody i wytworzenie trwałego produktu końcowego
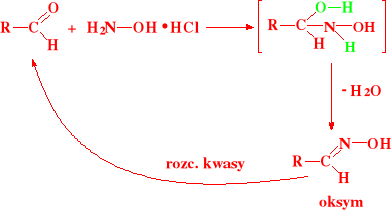
Tworzenie oksymów
Powstawanie hydrazonów
i fenylohydrazonówPowstawanie semikarbazonów
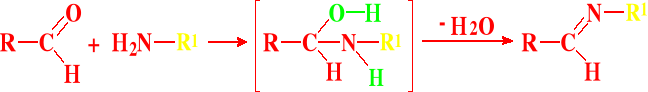
Przyłączanie amin
Tworzenie oksymów:
Powstawanie hydrazonów, fenylohydrazonów i semikarbazonów
Wszystkie te związki powstają w identyczny sposób jak oksymy - odpowiednio pod wpływem:
Hydrazony z hydrazyny (R = NH2)
Fenylohydrazony z fenylohydrazyny
(R = NH-Ph)2,4-Dinitrofenylohydrazony z 2,4-dinitro-fenylohydrazyny (R = NH-Ph-2,4-NO2)
Semikarbazony z semikarbazydu
(R = HN-CO-NH2)
|
R1 = |
|
Hydrazyna |
-NH2 |
Hydrazon |
Fenylohydrazyna |
-NH-Ph |
Fenylohydrazon |
2,4-dinitro- |
-NH-2,4-(NO2)-Ph |
2,4-Dinitro-fenylohydrazon |
Semikarbazyd |
-NH-CO-NH2 |
Semikarbazon |
Przyłączanie amin:
W reakcji biorą udział głównie aldehydy aromatyczne (lub z układem aromatycznym) i reagują także niemal wyłącznie z aminami aromatycznymi
Reakcja ma zróżnicowany przebieg w zależności od rzędowości reagującej aminy
Aminy trzeciorzędowe nie ulegają przyłączeniu do grupy karbonylowej aldehydów
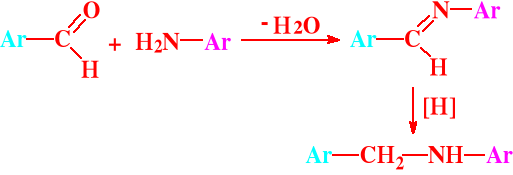
Reakcja aldehydów z aminami pierwszorzędowymi prowadzi do zasad azometinowych zwanych zasadami Schiffa,
które łatwo redukują się do amin II-rzędowych
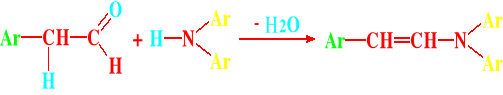
Reakcja aldehydów z aminami drugorzędowymi prowadzi do enamin
Reakcji tej ulegają tylko aldehydy posiadające co najmniej jeden atom wodoru w pozycji α (alfa) ponieważ tylko on może brać udział w utworzeniu eliminowanej cząsteczki wody
Właściwości chemiczne aldehydów - reakcje addycji
Reakcje kondensacji (przyłączanie karboanionów)
kondensacja aldolowa z dalszą krotonizacją
- kondensacja Claisenakondensacja Perkina
kondensacja Knovenagela
kondensacja benzoinowa wobec jonów CN-
kondensacja z aminami i fenolami do
barwników trifenylometanowychPolimeryzacja
aldehydu mrówkowego i octowego
Kondensacja aldolowa:
Zachodzi ona pomiędzy dwiema cząsteczkami związków karbonylowych (aldehydów, ketonów, estrów), z których co najmniej jedna musi mieć przynajmniej jeden atom wodoru na węglu α (alfa), w celu wytworzenia karboanionu,
Reakcja może zachodzić pomiędzy dwiema cząsteczkami tego samego związku,
Reakcja jest katalizowana głównie przez zasady, ale mogę pełnić tę funkcję także niektóre sole i rozcieńczone kwasy,
Jeśli reagują ze sobą różne związki to tworzą się aldole mieszane,
Reakcja zachodzi w 3 etapach , a może jej towarzyszyć również czwarty etap - krotonizacja
I etap - wytworzenie karboanionu - zawsze na węglu α względem grupy karbonylowej
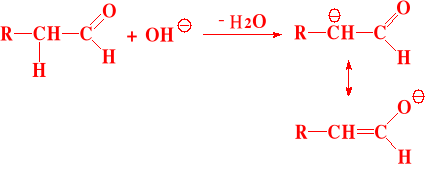
II etap - przyłączenie karboanionu - do związku karbonylowego
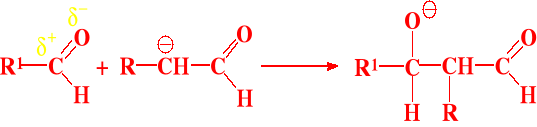
III etap - przyłączenie protonu (np. z wody)
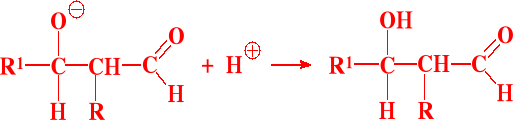
Możliwy jest IV etap - odwodnienie czyli krotonizacja
Krotonizacja, jeśli jest możliwa, zachodzi łatwo
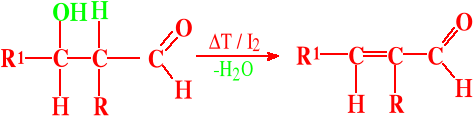
Kondensacja Claisena
Jest to odmiana kondensacji aldolowej
Substratem w tej reakcji są estry
Produktem są β-oksoestry
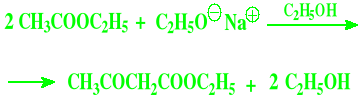
Przykładowy przebieg kondensacji Claisena dla propionianu etylu (reakcja zawsze zachodzi w pozycji alfa)
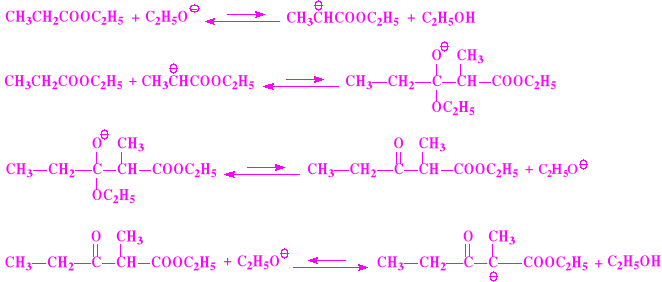
W kondensacji aldolowej atak nukleofilowy prowadzi do addycji - reakcji typowej dla aldehydów i ketonów; w kondensacji Claisena atak nukleofilowy prowadzi do substytucji - reakcji typowej dla związków acylowych
β-Oksoester bardzo łatwo tworzy sól sodową, w której atom(y) wodoru przy węglu pomiędzy dwoma grupami karbonylowymi są zastępowane atomami sodu; β-oksoester jest mocniejszym kwasem niż alkohol etylowy; w postaci jonowej ulega mezomerii
Możliwa jest również tzw. krzyżowa kondensacja Claisena, pomiędzy dwoma różnymi estrami. Ma to miejsce szczególnie wtedy, gdy jeden z substratów nie zawiera atomów wodoru w pozycji alfa i nie jest zdolny do wytworzenia karboanionu. W takiej sytuacji przebieg reakcji jest zdecydowanie jednokierunkowy.
Kondensacja Perkuna:
Odmianą kondensacji aldolowej jest kondensacja Perkina
W reakcji tej aldehydy aromatyczne ulegają kondensacji z bezwodnikami kwasowymi
Katalizatorem w reakcji Perkina jest sól sodowa lub potasowa kwasu tworzącego bezwodnik użyty do reakcji
Klasycznym przykładem reakcji Perkina jest synteza kwasu cynamonowego
Synteza kwasu cynamonowego, jako przykład syntezy kwasów α,β-nienasyconych
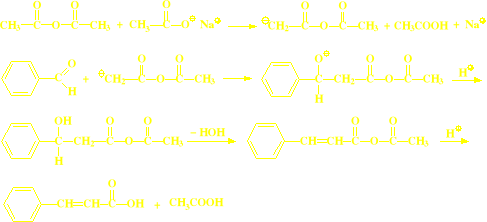
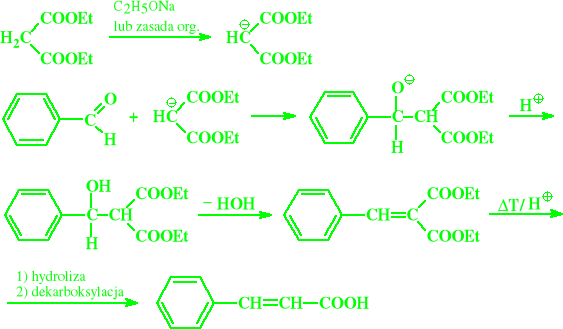
Kondensacja Knovenagel`a
Odmianą kondensacji aldolowej jest również kondensacja Knovenagel`a
Jest to reakcja aldehydów, głównie aromatycznych, z estrami kwasu malonowego
Zachodzi ona w środowisku bezwodnym, wobec katalizatorów zasadowych (np. piperydyna, pirydyna, dimetyloamina itp.)
Ostatnim jej etapem jest zwykle dekarboksylacja a podstawowym produktem są także kwasy α,β-nienasycone
Synteza kwasu cynamonowego metodą Knovenagel`a
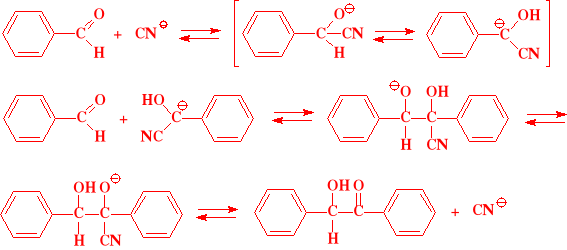
Kondensacja benzoinowa
Kondensacji tej ulegają tylko aldehydy aromatyczne
Zachodzi ona wobec działających katalitycznie jonów cyjankowych
Produktem tej reakcji jest benzoina, będąca analogiem acyloiny
W końcowym bilansie tej reakcji nie powstają żadne produkty uboczne
Otrzymywanie benzoiny z aldehydu benzoesowego
Utlenianie i redukcja aldehydów

Redukcja metodą Meerveina, Ponndorfa - Verley`a
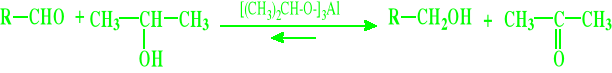
Redukcja metodą Clemmensena (bardziej charakterystyczna dla ketonów)
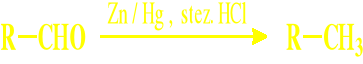
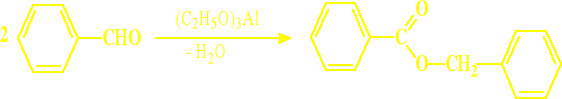
Reakcja dysproporcjonowania= Reakcja Cannizaro
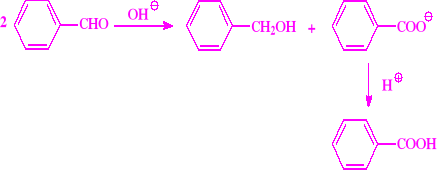
Jest to wzajemne oddziaływanie dwóch identycznych ugrupowań w dwóch identycznych lub podobnych cząsteczkach, względnie w tej samej cząsteczce. Jedna z tych grup utlenia się kosztem zredukowania grupy drugiej
Ulegają tej reakcji te aldehydy, które nie mają atomów wodoru w pozycji alfa, czyli te, które nie dają reakcji aldolowej. Typowym przykładem takich aldehydów są aldehydy aromatyczne oraz neo-pentanal
Reakcja dysproporcjonowania zachodzi w środowisku alkalicznym, ale nietypowa jest aktywność różnych wodorotlenków w tej reakcji
NaOH < KOH < Ca(OH)2 < Ba(OH)2 < TlOH
Najłatwiej utlenia się w tych warunkach aldehyd mrówkowy, stąd reakcja dowolnego aldehydu z taką samą ilością aldehydu mrówkowego oraz z alkaliami daje z dobrą wydajnością ów alkohol, różny od metanolu (CH3OH) oraz mrówczan sodu. Jest to tzw. krzyżowa reakcja Cannizaro
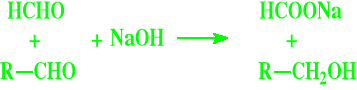
Reakcja dysproporcjonowania Typowy przebieg reakcji Cannizaro to:

Reakcja dysproporcjonowania Reakcja Cannizaro - Tiszczenki
Jest to modyfikacja reakcji Cannizaro
Prowadzi się ją w obecności etanolanu glinu
Otrzymuje się w niej odpowiednie estry utworzone z powstających przejściowo kwasów i alkoholi
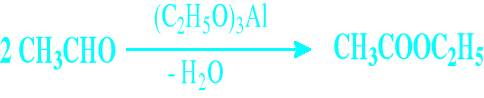
Reakcje redukcji z udziałem aldehydów
Aldehydy, w odróżnieniu od ketonów, działają redukująco na niektóre charakterystyczne odczynniki analityczne
Aldehydy, w reakcjach tych, ulegają utlenieniu
Są to m.in. reakcje z:
Odczynnikiem Fehlinga
Odczynnikiem Tollensa
Odczynnikiem Benedicta
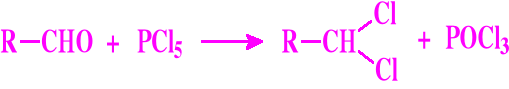
Chlorowcowanie aldehydów
Aldehydy, pod wpływem halogenków fosforu, ulegają łatwo chlorowcowaniu w obrębie grupy C=O. Szczególnie podatne są na reakcję chlorowania za pomocą PCl5
Polimeryzacja aldehydów
Aldehyd mrówkowy

Paraform, biały krystaliczny proszek
= polimer liniowy
![]()
n = ~100 = paraformaldehyd
n = ~1000 = polioksymetylen
Trymeryzacja:
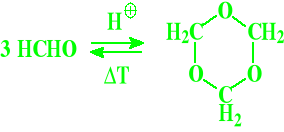
Aldehyd octowy
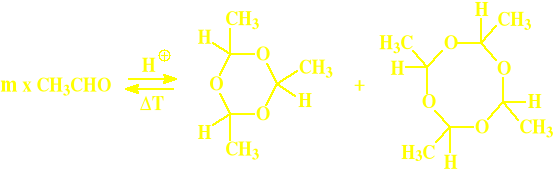
paraaldehyd metaaldehyd
Wyszukiwarka