Slajd 2 Ogólna charakterystyka helowców
Grupę helowców, stanowiących VIII główną grupę układu okresowego, tworzą: hel, neon, argon, krypton, ksenon i radon. Wykazują one najmniejszą aktywność chemiczną spośród wszystkich znanych pierwiastków i z tego powodu określane są także nazwą gazy szlachetne. Z wyjątkiem helu o konfiguracji elektronowej 1s2 wszystkie pozostałe pierwiastki tej grupy wykazują konfigurację elektronową s2p6.
Całkowite zapełnienie tych orbitali walencyjnych powoduje bierność chemiczną tych pierwiastków.
Slajd 3 Ogólna charakterystyka helowców
Helowce wykazują duże wartości energii jonizacji, co powoduje, że nie tworzą one trwałych jonów dodatnich. Równocześnie wykazują ujemne powinowactwo elektronowe, w wyniku czego nie tworzą one jonów ujemnych. Wysoka energia jonizacji powoduje jednak, że ich elektroujemność przyjmuje duże wartości.
Slajd 4 - tabela
Slajd 5 Ogólna charakterystyka helowców
Helowce występują we wszystkich stanach skupienia w postaci cząsteczek jednoatomowych. Ponadto jednoatomowe cząsteczki helowców mogą na siebie oddziaływać tylko słabymi siłami międzycząsteczkowymi, w których czynna jest tylko składowa oddziaływań dyspersyjnych.
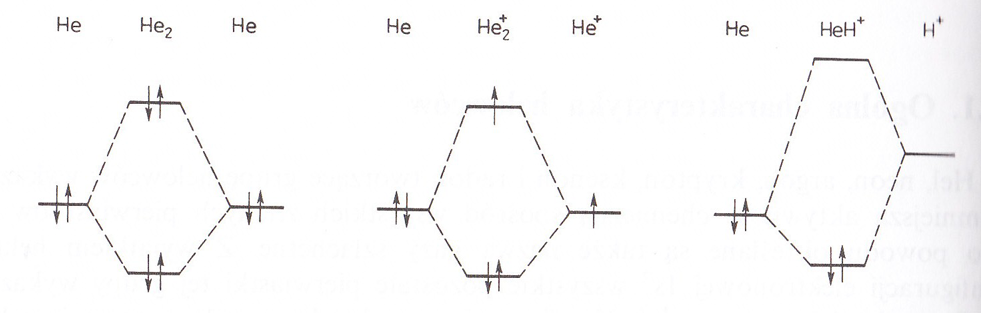
Cząsteczka He2, musiałaby być nietrwała ze względu na to, że obsadzony elektronami byłby nie tylko poziom energetyczny orbitalu wiążącego σ1s, lecz również poziom orbitalu antywiążącego σ*1s. Przedstawiałaby ona układ bogatszy w energię, a więc mniej trwały niż dwa nie oddziałujące na siebie atomy tlenu.
Slajd 6 diagramy

Zauważyć tutaj należy, że jon He2+ zawierający tylko jeden elektron na orbitalu antywiążącym jest trwalszy niż układ złozony z atomu He i jonu He+. Ilość energii zyskana na skutek umieszczenia 2 elektronów na poziomie σ1s jest bowiem większa niż nakład energii związany z umieszczeniem 1 elektronu na poziomie σ*1s.
Slajd 7 Właściwości fizyczne helowców
gazy bezbarwne;
bez smaku i zapachu;
ulegają skropleniu dopiero w bardzo niskich temperaturach;
hel wykazuje najniższą temperaturę wrzenia spośród wszystkich znanych substancji;
temperatury wrzenia helowców wzrastają stopniowo ze wzrostem ich masy atomowej.
Slajd 8 Właściwości fizyczne helowców
helowce w stanie stałym tworzą sieć o gęstym ułożeniu atomów;
hel tworzy sieć heksagonalna, a pozostałe helowce regularną płasko centrowaną;
hel w stanie stałym może być otrzymany tylko pod zwiększonym ciśnieniem;
ich ciepła topnienia i parowania są wyjątkowo małe,
co jest podobnie jak niskie temperatury wrzenia i topnienia spowodowane bardzo słabymi oddziaływaniami pomiędzy cząsteczkami tych gazów.
Slajd 9 Właściwości fizyczne helowców
Skroplony hel występuje w dwóch odmianach oznaczanych jako hel I i hel II. Bezpośrednio poniżej temperatury wrzenia trwały jest hel I o własnościach zwykłej cieczy. W temperaturze 2,17 K i pod ciśnieniem 0,05·105 Pa przechodzi on w hel II odznaczający się niezwykle małą lepkością, około 103 razy mniejszą od lepkości gazowego wodoru, oraz dobrym przewodnictwem cieplnym. Stan taki nazwano nadciekłym.
Slajd 10 Właściwości fizyczne helowców
Wykres fazowy helu
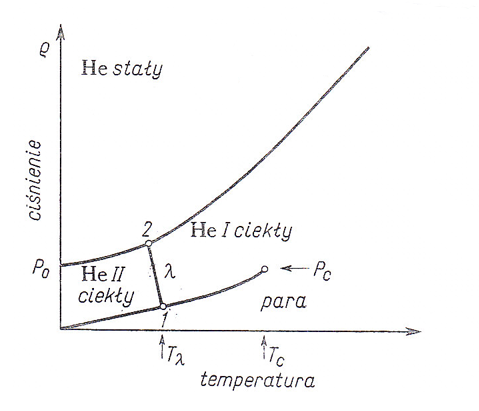
Tλ (1) = 2,173˚K (38,0 mm Hg),
Tλ (2) = 1,760˚K (29,64 atm)
Pc = 2,26 atm Tc = 5,2 ˚K P0 = 25 atm
Ciekły hel podlega w temp. 2,173˚K i pod ciśnieniem 38,0 mm Hg przemianie, którą określa się jako punkt λ; powstaje odmiana hel II. Punkt λ przesuwa się ze wzrastającym ciśnieniem i osiąga w temp. 1,760˚K (29,64 atm) krzywa krzepnięcia. Jak wynika z wykresu fazowego hel nie ma właściwego punktu potrójnego. Ciekły hel pozostaje w równowadze z gazowym z gazowym aż do temp. 0 ˚K i może zakrzepnąć tylko pod ciś. 25 atm w temp. 0 ˚K
Slajd 11 Otrzymywanie helowców
Surowcem, z którego można otrzymać wszystkie helowce (z wyjątkiem radonu) jest powietrze. Hel uzyskuje się jednak głównie z gazu ziemnego bogatego w ten pierwiastek.
Wydzielenie mieszaniny wszystkich helowców z powietrza nie sprawia w skali laboratoryjnej większych trudności. Przepuszczając powietrze nad ogrzewanymi wiórkami miedzi usuwa się z niego tlen, a następnie wiąże się azot ogrzewając je z metalicznym magnezem lub wapniem.
2Cu + O2 = 2Cuo
3Mg + N2 = Mg3N2
Pozostałość składa się w 99,8 % z argonu oraz w 0,2% z pozostałych gazów szlachetnych.
Slajd 12
Produkcja helowców w skali technicznej polega na przeróbce skroplonego powietrza. Poszczególne gazy zawarte w skroplonym powietrzu różnią się temperaturami wrzenia i można je ułożyć według wzrastających temperatur wrzenia w następujący szereg:
He |
Ne |
N2 |
Ar |
O2 |
Kr |
Xe |
4,2 K |
27,1 K |
77,4 K |
87,3 K |
90,2 K |
119,8 K |
165,1 K |
Najniższe temperatury wrzenia, położone poniżej temp. wrzenia azotu wykazują hel i neon. Temp. Wrzenia argonu leży pomiędzy temp. Wrzenia azotu i tlenu. Krypton i ksenon są najmniej lotne. Ich temp. Wrzenia są wyższe od temp. Wrzenia tlenu.
Slajd 13
Mieszanina kilku cieczy o różnych temperaturach wrzenia parując daje fazę gazową wzbogaconą zawsze w składniki najbardziej lotne. Oznacza to, że pozostająca ciecz stopniowo wzbogaca się w składniki trudniej lotne, składniki o wyższych temperaturach wrzenia. W czasie wrzenia ciekłego powietrza główna część helu i neonu przechodzi do początkowych porcji (frakcji) pary. Oczywiście będą one zawierać także sporo azotu, ale bardzo mało tlenu, kryptonu i ksenonu.
Slajd 14
W miarę jak ubywa cieczy, otrzymujemy frakcję szczególnie bogatą w azot, frakcję wzbogaconą w argon, frakcję zawierającą głównie tlen. Przeważająca część kryptonu i ksenonu znajdzie się w ostatnich porcjach parującej cieczy. Zbierając odpowiednie frakcje uzyskuje się więc gazy wzbogacone w hel i neon, w argon lub w krypton i ksenon. Taki sposób rozdzielania substancji nazywamy destylacją frakcjonowaną.
Slajd 15
W celu dalszego rozdzielenia frakcji bogatej w hel i neon wykorzystuje się fakt, że gazy zaadsorbowane w niskiej temp. Na węglu aktywnym desorbują się z niego w czasie ogrzewania w takiej samej kolejności, w jakiej wzrasta ich temperatura wrzenia.
Najpierw desorbuje się zatem hel, następnie neon a na końcu azot. Wydzielenie argonu, a także kryptonu i ksenonu z odpowiednich frakcji odbywa się za pomocą ponownego skroplenia i rozdzielenia z zastosowaniem destylacji frakcjonowanej. Azot i tlen można z nich usunąć także metodą chemiczną.
Slajd 16 Związki chemiczne helowców
Klatraty
Stanowią one bardzo specyficzny typ połączeń, w których substancje macierzyste: hydrochinon, anilina, fenol, krzepnąc okludują we wnękach, obecnych w sieci przestrzennej, cząsteczki obce, np. SO2, H2S, HCl. Cząsteczki obce zostają w nich uwięzione w sposób czysto mechaniczny bez wytwarzania jakichkolwiek wiązań chemicznych.
Najbardziej znanymi przykładami klatratów tworzących się z udziałem helowców są klatraty, w których sieć macierzystą tworzy hydrochinon, C6H4(OH)2. Powstają one podczas krystalizacji hydrochinonu z roztworów: benzoesowego lub wodnego, nasyconych argonem, kryptonem lub ksenonem pod zwiększonym ciśnieniem.
Slajd 17
Gazy te można łatwo odzyskać rozpuszczając klatrat, np. w alkoholu metylowym lub ogrzewając go do temperatury 390 K. Klatraty tworzone są przez wszystkie gazy szlachetne z wyjątkiem helu.
Slajd 18
Hydraty helowców
Hydraty helowców są także związkami typu klatratów. W hydratach o wzorze Y· 5,75 H2O (Y- atom helowca) cząsteczki wody, krzepnącej w obecności helowca, układają się w taką strukturę krystaliczną, że komórka elementarna zawiera 46 cząsteczek H2O, pomiędzy którymi znajduje się 8 luk zdolnych pomieścić atomy helowca.
Slajd 19
Heksafluoroplatynian ksenonu
Działając ksenonem na sześciofluorek platyny w temperaturze pokojowej tworzy się czerwonopomarańczowy stały heksafluoroplatynian ksenonu:
Xe + PtF6 = XePtF6
Związek ten ma budowę jonową, jest trwały w temperaturze pokojowej, w próżni daje się przesublimować. Ogrzewany w temperaturach powyżej 430K oddaje częściowo ksenon i przechodzi w związek o składzie Xe(PtF6)2, ciało stałe o barwie czerwonej. Z wodą XePtF6 ulega gwałtownej reakcji hydrolizy:
2 XePtF6 + 6H2O = 2Xe + O2 + 12HF + 2PtO2
Slajd 20
Fluorki ksenonu
Fluorki ksenonu, XeF2, XeF4 i XeF6, powstają w czasie ogrzewania, naświetlania lub poddawania wyładowaniom elektrycznym mieszaniny ksenonu i fluoru o odpowiednim składzie. Może wówczas dojść do ustalenia stanów równowagi odpowiadających reakcjom:
Xe + F2 XeF2
XeF2 + F2 XeF4
XeF4 + F2 XeF6
Przy małym nadmiarze fluoru powstaje XeF2 jako główny produkt. Ze wzrostem stężenia F2 powstaje coraz więcej wyższych fluorków.
Slajd 21
Otrzymywanie i własności fluorków ksenonu
Slajd 22
Tabela
Slajd 23
Fluorki ksenonu w temperaturze pokojowej są bezbarwnymi ciałami krystalicznymi łatwo sublimującymi w czasie ogrzewania w próżni.
Sieci przestrzenne dwóch niższych fluorków, XeF2 i XeF4, są sieciami molekularnymi.
XeF6 tworzy w stanie stałym cztery odmiany polimorficzne, których struktura nie jest jeszcze w pełni wyjaśniona.
W odmianie regularnej, trwałej w temperaturach niższych niż 153 K, obecne są jony [XeF5]+ łączące się ze sobą za pośrednictwem mostków F- w tetramery i heksamery pierścieniowe.
Cząsteczki XeF2 są liniowe (D∞h), a cząsteczki XeF4 kwadratowe płaskie (D4h).
Slajd 24
Wszystkie trzy fluorki rozpuszczają się w ciekłym HF, przy czym dwa niższe dają roztwory nie przewodzące prądu elektrycznego, podczas gdy sześciofluorek ulega dysocjacji elektrolitycznej:
XeF6 + HF XeF5+ + HF2-
Fluorki ksenonu w czasie ogrzewania ulegają rozkładowi na pierwiastki i wykazują silne działanie utleniające i fluorujące. W czasie tego typu reakcji ksenon redukuje się do stopnia utlenienia 0:
XeF2 + C2H4 = Xe + C2H4F2
XeF4 + 2H2 = Xe + 4HF
Slajd 25
XeF2 rozpuszcza się w wodzie, w której z czasem ulega rozkładowi - szybszemu w roztworze zasadowym, wolniejszemu w kwaśnym:
XeF2 + 2OH- = Xe + H2O = ½ O2 + 2F-
Podobnie zachowuje się XeF4. Hydroliza XeF6 prowadzi natomiast do XeOF4 i XeO2F2, jeśli użyje się małych ilości wody:
XeF6 + H2O = XeOF4 + 2HF
XeF6 + 2H2O = XeO2F2 + 4HF
Użycie większych ilości wody prowadzi do trójtlenku ksenonu:
XeF6 + 3H2O = XeO3 + 6HF
Slajd 26
XeF6 może działać jako kwas Lewisa reagując z fluorkami cięzkich litowców. Prowadzi to do utworzenia anionów XeF7-
XeF6 + MF = M+[XeF7]- (M = Na, K, Rb, Cs)
Heptafluorokseniany ulegają dysproporcjonowaniu do oktafluoroksenianów i XeF6:
2M+ [XeF7]- = M2+[XeF8]2- + XeF6
stanowiących najtrwalsze połączenia ksenonu, które mogą być ogrzewane do temperatury 670 K bez rozkładu.
Slajd 27
W obecności silnych kwasów Lewisa fluorki ksenonu stają się donorami jonu fluorkowego:
XeF6 + PtF5 = [XeF5]+[PtF6]-
XeF4 + 2SbF5 = [XeF3]+[Sb2F11]-
2XeF2 + AsF5 = [Xe2F3]+[AsF6]-
Slajd 28
W kationach i anionach tworzą się mostki fluorkowe:
Oprócz fluorków otrzymano połączenia ksenonu z chlorem (XeCl4, XeCl2) i bromem (XeBr2). Krypton tworzy KrF2 o własnościach zbliżonych do XeF2. Badania radonu, pierwiastka o najniższej energii jonizacji spośród wszystkich helowców, w przypadku którego można by oczekiwać największej reaktywności, są znacznie utrudnione na skutek jego silnej radioaktywności, która może stymulować rozkład tworzących się niezbyt trwałych połączeń. Radon reaguje jednak z ciekłymi fluorkami halogenków (ClF3, BrF3, BrF5) dając produkt pozostający po odparowaniu roztworu. W roztworze takim radon obecny jest w formie kationów, być może Rn2+, gdyż w czasie elektrolizy wędruje do elektrody ujemnej.
Slajd 29
Dwufluorek ksenonu ma budowę liniową, czterofluorek płaską, kwadratową. Struktura XeF6 jest najprawdopodobniej odkształconą strukturą oktaedryczną.
Najprostszy schemat orbitali cząsteczkowych w XeF2 uzyskuje się rozważając pokrywanie się orbitali p dwóch atomów fluoru z jednym z orbitali p centralnego atomu ksenonu.
Najprostszy schemat orbitali cząsteczkowych w XeF2 uzyskuje się rozważając pokrywanie się orbitali p dwóch atomów fluoru z jednym z orbitali p centralnego atomu ksenonu.
Następuje utworzenie trzech kombinacji liniowych orbitali atomowych stanowiących trzy zdelokalizowane orbitale cząsteczkowe: wiążący σ, niewiążący σ0 oraz antywiążący σ*. Przeniesienie elektronów na poziom energetyczny orbitalu σ daje zmniejszenie energii układu w porównaniu z układem złożonym z izolowanych atomów. Ulokowanie elektronów na poziomie σ0 nie zmienia w wyraźny sposób energii układu, a umieszczenie ich na poziomie σ* zwiększa energie układu, a więc daje układ mniej trwały. Układ trwały o konfiguracji σ2 σ02 uzyskujemy, jeżeli w tworzeniu wiązania zdelokalizowanego uczestniczą orbitale p obu atomów fluoru zapełnione tylko w połowie, a więc dostarczające łącznie 2 elektrony.
Slajd 30 Struktura fluorków ksenonu
W przypadku cząsteczki XeF4 przyjmuje się, że mamy do czynienia z dwoma zespołami trójcentrowych orbitali cząsteczkowych - σ, σ0 σ*. Wiązania utworzone przez obydwa zespoły są skierowane w stosunku do siebie pod katem prostym. Powoduje to rozmieszczenie czterech jąder atomowych fluoru w czterech wierzchołkach kwadratu, w środku którego znajduje się jądro ksenonu.
Slajd 31
Związki ksenonu z tlenem
Obecnie są znane związki z tlenem oraz fluorem i tlenem wyłącznie dla ksenonu.
Trójtlenek ksenonu, XeO3:
Tworzy się w czasie hydrolizy XeF6. Może być on następnie wydzielony z roztworu przez ostrożne zagęszczanie.
Jest to bezbarwne ciało stałe, łatwo ulegające wybuchowemu rozkładowi.
Ma budowę piramidalną.
Zawiera jedną wolną parę elektronową.
Slajd 32
W roztworze wodnym XeO3 działa silnie utleniająco. Utlenia, np. jony Mn2+ do MnO4-.
Po dodaniu do roztworu Ba(OH)2 wytrąca się w wyniku dysproporcjonowania osad nadksenianu baru, Ba2XeO6, zawierającego ksenon na VIII stopniu utlenienia.
2XeO3 + 4OH- + 2Ba2+ = Ba2XeO6 ( ) + Xe + O2 + H2O
Przy powolnym wprowadzeniu ksenianu baru do kwasu siarkowego w temperaturze 268K powstaje czterotlenek ksenonu, XeO4, gaz ulegający niezmiernie łatwo wybuchowemu rozkładowi.
Slajd 33
Rozpowszechnienie helowców we Wszechświecie różni się znacząco od ich rozpowszechnienia w dostępnych badaniom warstwach kuli ziemskiej co przedstawia poniższa tabela.
Hel jest drugim po wodorze pierwiastkiem pod względem rozpowszechnienia we Wszechświecie. Neon i argon są we Wszechświecie również bardziej rozpowszechnione niż krzem, w stosunku do którego określa się zawartość innych pierwiastków w kosmochemii. Na ziemi najbardziej rozpowszechnionym spośród helowców jest argon. Niewielkie ilości argonu i helu powstają na ziemi wskutek przemian promieniotwórczych.
Slajd 34
Argon jest jednym z produktów rozpadu jąder izotopu potasu 1940K, które mogą ulegać przemianie β- lub przemianie β+. W pierwszym przypadku powstaje atom wapnia w drugim - argonu:
Hel tworzy się na skutek przemian alfa, bardzo częstych w naturalnych szeregach promieniotwórczych, a więc w uranowo-radowym, uranowo-aktynowym i torowym. We wszystkich tych szeregach jako jeden z pierwiastków promieniotwórczych ulegających dalszemu rozpadowi pojawia się jeden z izotopów radonu. Są to izotopy krótkotrwałe i z tego powodu zawartość radonu w przyrodzie jest mała.
Slajd 35
Helowce na Ziemi występują głownie w atmosferze. Hel znajduje się także w niektórych źródłach gazu ziemnego.
Zawartość helu w gazach ziemnych występujących w europie jest na ogół mała, w gazach występujących w USA dochodzi natomiast do 1%, co umożliwia otrzymanie tego pierwiastka w dużych ilościach. Hel powstający w reakcji rozpadu promieniotwórczego w minerałach uranowych częściowo pozostaje w nich zokludowany i wydobywa się dopiero w czasie rozdrabniania, prażenia lub rozpuszczania minerałów.
Slajd 36 Zastosowanie helowców
Hel służy do napełniania balonów.
Mieszanina helu z tlenem używana jest jako gaz, którym oddychają nurkowie.
Hel odgrywa ogromną rolę w wielu pracach laboratoryjnych związanych z otrzymywaniem najniższych temperatur.
Slajd 37
Argon może byś używany do wytwarzania atmosfery obojętnej w aparaturze laboratoryjnej, technice spawalniczej.
Argon i hel stosowane są do utrzymywania atmosfery chemicznie biernej przy wytopie niektórych metali jak tytanu, cyrkonu.
Neon stosowany jest w lampach jarzeniowych, gdyż ma niska wartość potencjału katodowego i może jarzyć się już po przyłożeniu zwykłego napięcia sieciowego
Slajd 38
Rozrzedzone gazy szlachetne podczas przepuszczania przez nie wyładowań elektrycznych emitują charakterystyczne barwne światło: neon - czerwone, hel - żółte, mieszanina helu z parami rtęci - niebieskie. Zjawisko to wykorzystuje się w technice oświetleniowej, m. in. w neonowych reklamach świetlnych.
Argon, krypton i ksenon służą do wypełniania żarówek wysokiej mocy, lepiej niż azot przeciwdziałają rozpyleniu drutu wolframowego.
Slajd 39 Bibliografia
Bielański, Podstawy chemii nieorganicznej, PWN, Warszawa 1998.
W. Trzebiatowski, Chemia nieorganiczna, PWN, Warszawa 1965.
J. Kuryłowicz, Chemia nieorganiczna, PWN, Warszawa 1995.
12