Cykl Krebsa: u eukariontów zachodzi w matrix mitochondrialnym a u prokariota w cytozylu. Z niego pochodzi większość atomów wodoru w łańcuchu oddechowym. Główną funkcją jest utlenianie pirogronianu do CO2 i H2O z jednoczesnym uzyskiwaniem energii. Substratami są szczawiooctan i acetyloCoA. Szczawiooctan odtwarza się po jednym obrocie a reszta acetylowi ulega degradacji do CO2 i H2O powstające w łańcuchu oddechowym. Efektem tej degradacji jest utworzenie 12 cząsteczek ATP z czego 11 powstaje w łańcuchu oddechowym a 1 w cyklu Krebsa. Cykl Krebsa polega na całkowitym utlenieniu czynnego octanu (Acetylo-CoA) w szeregu reakcji enzymatycznych do kwasu szczawiooctowego. W tym procesie zachodzi czterokrotnie dehydrogenacja (3NADH i 1FADH) oraz dwukrotnie dekarboksylacja. Jednocześnie odbywają się dwa cykle Krebsa, utleniające dwa Acetylo-CoA, pochodzące z glikolizy. Na tym etapie energetycznym zyskiem jest 24ATP.
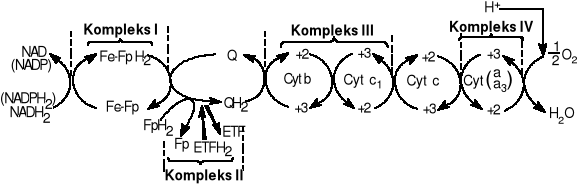
Łańcuch oddechowy: system przenośników elektronów i protonów. Zachodzi w wewnętrznej stronie mitochondrialnej. Celem łańcucha jest nie tylko redukcja O2 i H2O ale także biosynteza ATP. Istnieją 3 drogi wejścia do łańcucha oddechowego. Zyski energetyczne: 3ATP na cząsteczkę utlenionego NADH2 i 2ATP na cząsteczkę FADH2.
Koenzymy biorące udział: FAD FMN NAD. Dwa pierwsze to koenzymy flawinowe oba zawierają jednostkę mononukleotydu flawinowego która ma miejsce reaktywne. FAD ma dodatkową grupę cukrową i zasadę adeninową. Są pochodnymi witaminy B2 czyli ryboflawiny. FAD-dinukleotyd flawinowy adeniny FMN-mononukleotyd flawinowy.
NAD+-dinukleotyd nikotynoamidoadeninowy koenzym mający strukturę opartą na adeninie dwóch cząsteczkach rybozy powiązanych grupami fosforanowymi i pierścieniu nikotynoamidowym- będący częścią reaktywną. Często używany w reakcjach katabolicznych. Z NAD+ powstaje NADP+ który posiada dodatkową grupę fosforanową przyłączoną do jednej z cząsteczek rybozy. Używany w reakcjach anaboliz.
Kolejność podstawowych podjednostek składowych łańcucha oddechowego
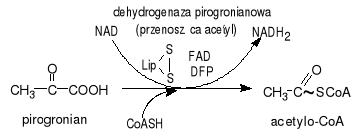
Oksydacyjna dekarboksylacja 2-oksykwasu np. α-ketaglutanonu prowadzi do powstania bursztynylokoenzymu A. Proces ten bardzo przypomina dekarboksylację pirogronianu który jest także α-ketokwasem: pirogronianu +CoA+NAD+acetyloCoA+CO2+NADH. Połączenie z CoA to wiązanie tioestrowe o wysokim potencjale przenoszenia. Enzym biorący udział to dehydrogenaza α-ketoglutanonu. Grupą prostetyczną (niebiałkowa pomocnicza) jest kwas liponowy oraz TPP (pirofosforan tianiny)- koenzym odpowiedzialny za transfer grupy aldehydowej.
TTP- jest pochodną witaminy B1. Niedoborów tiaminy (wit B1) choroba beri-beri zaburzenia neurologiczne pirogronianu sercowo-naczyniowe. Objawami są bóle rąk nóg osłabienie mięśni chorobowe zmiany na skórze. Pirogronianu wypadku zachorowania na beri-beri stężenie pirogronianu: α-glutenonu jest większe od prawidłowego.
Przekształcenie pirogronianu w acetylo-CoA:
1. pirogronianu łączy się z TTP i ulega dekarboksylacji. Protonacja prowadzi do powstania hydroksyetylotianiny 2. grupa hydroksyetylowa przyłączona do TTP jest utleniana do grupy acetylowej i jednocześnie przenoszona na lipoamid pochodną kwasu lipowego. W wyniku tej reakcji powstaje acetylolipoamid. 3. przeniesienie grupy acetylowej z acetylolipoamidu na CoA i utworzenie acetylo-CoA. Postały z pirogronianu acetylo-CoA będzie teraz substratem energetycznym cyklu kwasu cytrynowego.
Fotosynteza: proces asymilacji CO2 przez rośliny zielone przebiegający w chloroplastach.
Faza jasna: zachodzi za dnia zachodzi w talekoidach. Proces ten odbywa się na zasadzie pochłaniania energii przez chlorofil. Reakcje: biosynteza ATP: ADP+PiATP i fotoliza wody (reakcja Hilla) 2H2O4H++4e-+O2 Tlen jest ubocznym produktem fotosyntezy. Z fotolizą H2O sprzężona jest reakcja redukcji NADP: NADP+2H++2e-NADPH+H+ Protony które redukują NADP pochodzą z fotolizy H2O. Cząsteczki chlorofilu A i B oraz cząsteczki ksenofili i karotenoidów są skumulowane w dwa fotosystemy. Pierwszy to PS1 drugi PS2- zależą od długości światła. Wydzielone są cząsteczki chlorofilu- antenowe które znajdują się w centrum reakcji do których wchłonięta jest energia przekazywana do centrum reakcji- jest ona tak duża że mogą z niej być wybite elektrony. Ruch elektronu odbywa się przeciwnie do potencjałów elektrochemicznych. Elektrony pochodzące z fotolizy H2O zostają wprowadzone do fotosystemu aby chlorofil wrócił z kationu do stanu normalnego. Elektrony które wróciły mają swoją energię i idą do P-700 (PS1). Produktami fazy świetlnej jest ATP i NADPH2 oraz O2 jako produkt uboczny.
Faza ciemna: wiązanie CO2 ta faza składa się z dwóch etapów:
1 etap: właściwa asymilacja CO2- przyłączenie cząsteczek CO2 do akceptora rybozy-1,5-bisfosforanu. Jest tu wykorzystywane ATP i NADPH2 do redukcji powstającego 3-fosfoglicerynianu do triody aldehydu 3-fosfoglicerynowego.
2 etap: część cząsteczek trioz jest wykorzystywana do regeneracji akceptora CO2 czyli rybulozo-1,5-bis-P tzw Cykl Calvina. RUBISCO katalizuję karboksylację rybulozo-1,5-bis-P jest to enzym defektywny wykazuje aktywność nie tylko karboksylazy ale również oksygenazy.
Szlak pentozowy: stanowi źródło NADPH (fosforan dinukleotydu nikotynoamidoadeninowego) oraz dostarcza rybozy-5-P który wykorzystywany jest np. do syntezy RNA DNA. Zachodzi w cytozylu i ma ogromne znaczenia w tych tkankach które syntetyzują kwasy tłuszczowe i steroidy. Pełni dwie podstawowe funkcje: tworzenie NADPH i przekształcanie heksos z pentozy. Szlak ma 3 etapy:
1. reakcje utleniania przekształcające glukozo-6-P w rybozo-5-P z wytworzeniem 2NADPH
2. izomeryzacja rybozo-5-P do rybozo-5-P
3. powiązanie szlaku pentozowego z Glikoliza działaniem transektolazy i transaldolazy.
Reakcje transektolazy i transaldolazy są odwracalne co pozwala albo na przekształcenie rybo-5-P w intermediat glikolizy (ald 3-Pglic i fruktozo-6-P) jeżeli nie jest potrzebny w komórce do innych reakcji albo na tworzenie rybozo-5-P z intermediatów glikolizy gdy potrzebny jest w dużych ilościach.
Cykl mocznikowy: powstaje mocznik w postaci którego zwierzęta ureotoliczne wydalają z organizmu amoniak. Nadmiar amoniaku zwiększa syntezę glutaminianu i glutaminy które mają szkodliwy wpływ na czynności mózgu. Cykl mocznikowy- reakcja sumaryczna:
NH4++HCO3-+H2O+3ATP+asparaginianmocznik+2ADP+AMP+2Pi+PPi+fumaran
Glikoliza: Glikoliza jest beztlenowym etapem obróbki glukozy, przy której wydzielana jest energia w postaci ATP. Jest to ciąg reakcji zachodzących w cytoplazmie. Polega na dostarczeniu energii (albo bezpośrednio albo przez substraty dla cyklu kwasu cytrynowego i fosforyzacji oksydacyjnej) oraz wytworzeniu intermeiatów dla szlaków biosyntetycznych. Następuje tutaj degradacja glukozy. Glikoliza jest szlakiem jednosubstratowym ulega degradacji do związków innych niż wyjściowe. Zachodzi w 3 etapach:
1. przygotowanie cząsteczki glukozy do rozszczepienia aldolowego na dwie triozy
2. triozy są utleniane do kwasu pirogronowego Powstają 4 ATP
3. rozkład pirogronianu w zależności od warunków (beztlenowe czy tlenowe)
Zysk energetyczny: 2 cząsteczki AT na jedną cząsteczkę glukozy 2 cząsteczki pirogronianu
β-oksydacja: degeneracja kwasów tłuszczowych (utlenienie długich łańcuchów kwasów tłuszczowych). Rozpad zachodzi w cytozylu u prokariota a w matrix u eukariota.
Etapy: 1. utlenienie acylo-CoA do enoilo-CoA zawierającego w łańcuchu kwasu tłuszczowego wiązanie podwójne czemu towarzyszy powstawanie FADH2
2. uwodnienie enoilo-CoA do 3-hydrijstacylo-CoA
3. utlenienie 3-hydroksyacylo-CoA do 3-ketoacylo-CoA czemu towarzyszy powstawanie NADH
4. rozszczepienie lyb tioliza 3-ketoacylo-CoA przez drugą cząsteczkę CoA prowadzące do powstania acetylo-CoA i acylo-CoA skróconego o 2 atomy węgla.
Zysk energetyczny: 106 cząsteczek ATP.
Rozkład tłuszczy prostych: R1 R2 R3 to reszty arylowe wyższych kwasów tłuszczowych które są estrowo związane z alkoholem i glicerolem. Lipidy rozkładane SA przez lipazy (3klasa) w ustroju zwierzęcym występują dwa rodzaje lipa: trzustkowa i jelitowa. Lipaza trzustkowa odszczepia skrajne reszty arylowe R1 i R3. Lipaza jelitowa odszczeia środkową resztą kwasu tłuszczowego R2.
ATP- adenoztnotrifosforan: biosynteza ATP jest mianem fosforylaji: ADP+PiATP
Fosforyzacja fotosyntetyczna- ATP powstaje na koszt energii światła słonecznego, proces katalizuje syntetaza ATP. Fosforyzacja oksydacyjna- proces polega na biosyntezie ATP sprzężonego z łańcuchem oddechowym i proces katalizowany przez syntetaza ATP. Fosforyzacja substratowi- odbywa się na koszt energii substratu np. w glikolizie oraz w cyklu Krebsa i proces katalizowany przez kinezy bądź syntetaza. Reakcja rozkładu ATP jest katalizowana przez adenozynotrifosfatazę
Fosforan pirydoksalu PLP: jest pochodną witaminy B6 bierze udział w fosforolitycznym rozkładzie glikogenu. Grupa aldehydowa tego koenzymu tworzy zasadę Schiffa ze specyficznym łańcuchem bocznym lizany fosforylazy
Fosforan tiaminy TTP: część czynną TTP jest pierścień tiazolowy który występuje w postaci karbokationu gdzie przyłączają się 2-oksykwasy przez grupę ketonową. Pochodna witaminy B1. bierze udział w cyklu Krebsa i Calvina.
Cytydynotrifosforan CTP: powstaje z trifosforanu urydyny przez wymianę tlenu grupy karbonylowej na grupę aminową. Wykorzystywany do syntezy RNA oraz uczestniczy w biosyntezie fosfolipidów.
Koenzym CoA: koenzym A bierze udział w katabolizmie. Powstaje w wyniku dekarboksylacji oksydacyjnej pirogronianu. Acetylo-CoA jest substratem w cyklu Krebsa. Przenosi reszty arylowe. Wszystkie reszty arylowe SA połażone z tym CoA wiązaniem makroergicznym. CoA jest pochodną kwasu pantotenowego.
Ubichinon- koenzym Q: jest pochodną chinową długim ogonem izoprenowym. Liczba pięciowęglowych jednostek izoprenowych zależy od gatunku. Forma najpowszechniej spotykana u ssaków zawiera 10jednostek izoprenowych (koenzym Q10). Chinony mogą występować w trzech stanach utlenienia. W stanie załkwicie utlenionym Q koenzym Q ma dwie grupy ketonowe. Dołączenie jednego elektronu i jednego protonu powoduje przejście do formy semichionu PH. Forma semichionowa względnie łatwo ulega deprotenacji tworząc rodnik anionowy semichiononu Q-. Po dołączeniu drugiego elektronu i protonu powstaje całkowicie zredukowana forma koenzymu Q, Ubichinon QH2 który bardzo silnie przytrzymuje protony. Ubichinon stanowi ostatnie ogniwo łańcucha oddechowego, do którego dochodzą atomy wodoru. Dalej przenoszone są już tylko elektrony. W łańcuchu oddechowym występuje on w ilości znacznie większej od innych składników łańcucha oddechowego. Ubichinon jest ruchomym elementem łańcucha. Krąży w membranie komórkowej (lub wewnętrznej błonie mitochondrialnej) pomiędzy Kompleksem I, Kompleksem II i cytochromami.
W łańcuchu oddechowym u niektórych Prokariota w okolicach działania ubichinonu mogą występować związki towarzyszące temu koenzymowi: witaminy K oraz witaminy E.
Sacharydy
Cukrowce węglowodany dzielą się na dwie grupy. Monosacharydy czyli cukry proste i disacharydy i polisacharydy cukry złożone. Monosacharydy pod względem chemicznym są alkoholami wielowodorotlenowymi z grupą aldehydową (aldozy) lub ketonową (ketozy). W zależności od ilości atomów węgla w cząsteczce dzielą się one na triozy (3C) tetrozy (4C) pentozy (5C) heksozy (6C) i heptozy (7C). Przedstawicielem aldopentoz jest ryboza i ksyloza-składnik hemiceluloz, aldohektoz- glukoza mannoza i galaktoza, ketoheksoz- fruktoza.
Cykry proste monosacharydy: prócz formy łańcuchowej otwartej tworzą pierścienie heterocykliczne pochodne furanu (pięcioczłonowe) i piranu (sześcioczłonowe). Desmotropia zjawisko cyrkulacji wewnątrz cząsteczkowej cukrów- polega na występowaniu związku chemicznego w dwóch postaciach mogących samorzutnie przechodzić jedna w drugą:
forma łańcuchowa ph<7 pH>7 forma cykliczna
Disacharydy: powstają poprzez połączenie dwóch cukrów prostych wiązaniem glikozydowym. Grupa wodorotlenowa przy anomerycznym atomie węgla monosacharydu (nazywanym węglem glikozydowym) charakteryzuje się dużą reaktywnością i łątwo reaguje z alkoholami tworząc acetale zwane glikozydami. Podstawowe disacharydy to:
Maltoza - α-glukozylo - 4-glukoza wiązania: glukoza α1,4 glukoza dwucukier powstający podczas hydrolizy skrobi i jest dalej hydrolizowana do glukozy przez maltozę
Laktoza - β-galaktozylo - 4-glukoza dwucukier występujący w mleku składa się z galaktozy i glukozy połączonych wiązaniem β-1-4-glikozydowym. Hydroliza laktozy do cukrów prostych katalizuje u ludzi laktaza
Celobioza - β-glukozylo - 4-glukoza wiązania: glukoza β1,4 glukoza
Trehaloza - α-glukozylo - 1-glukozyd
Sacharoza - β-fruktozylo - α-glukozyd wiązania: glukoza α,1 + β,2 fruktoza nie redukuje
na skalę przemysłową otrzymuje się z trzciny cukrowej i buraków cukrowych. Utworzony przez reszty glukozy i fruktozy połączone anomerycznymi atomami węgla. Wiązanie glikozydowy ma konfigurację α dla glukozy i β dla fruktozy. Hydroliza sacharozy do glukozy i fruktozy jest katalizowana przez sacharazę.
Właściwości disacharydów zależą od sposobu powiązania monosacharydów
- od typu wiązania glikozydowego (α i β) - od pozycji węgla w łańcuchu z którym „węgiel glikozydowi” sprzęga się z mostkiem tlenowym - od rodzaju pierścienia cukrowców (furanowy lub piranozowy)
Polisacharydy: są to produkty polikondensacji monosacharydów połączonych z sobą wiązaniami glikozydowymi. W stosunku do mono i disacharydów mają odmienne właściwości fizyczne i chemiczne. W zależności od cukrów tworzących polisacharyd dzielimy je na: homoglikany (homopolisacharydy) (zbudowane wyłącznie z glukozy -skrobia glikogen celuloza dekstran z fruktozy- inulina) heteroglikany (mukopolisacharydy i hemicelulozy)
Skrobia: amyloza -α1,4 glikozydowe, polimer glukozy 24%, amylopektyna -α1,4 i α1,6 glikozydowe 76% (budowa nieregularna krzaczasta)
Glikogen -skrobia zwierzęca (występuje w wątrobie) jeszcze bardziej rozgałęziony
Celuloza: najczęściej produkt roślinny, celuloza bakteryjna jest idealnie prosta. Występują wiązania β1,4 glikozydowe.
Dekstran: różne wiązania α duża lepkość bardzo rozgałęziony stosowany w postacie sit molekularnych. Indulina: polimer zbudowany z fruktozy (w kłączach irysa u cykorii)
Aminokwasy:
Są małocząsteczkowymi związkami organicznymi zawierające dwie grupy funkcyjne aminową -NH2 i kwasową -COOH (karboksylową) są pochodnymi niższych kwasów tłuszczowych (karboksylowych). Ich podstawową funkcją biologiczną jest udział w tworzeniu białek. Jedynie dwadzieścia spośród nich stanowi monomeryczny składnik makropeptydowych łańcuchów nieomal wszystkich białek, nazywamy je proteinogenne. Związki te są pierwszorzędowymi aminami jedynie prolina i hydroksylizyna posiada drugorzędową grupę aminową (są iminokwasami). Obydwie grupy funkcyjne przyłączone są do atomu węgla w pozycji α i występują w konfiguracji izomerów L u wszystkich poza glicyną węgiel α jest atomem asymetrycznym (chiralnym). Różnorodność i fizykochemiczne właściwości warunkuje odmienna struktura łańcuchów bocznych R. podstawniki różnią się wielkością, kształtem, ładunkiem oraz reaktywnością.
Podział aminokwasów poprzez podstawnik -R
- niepolarne: o alifatycznym łańcuchu bocznym: glicyna, alanina, walina, leucyna, izoleucyna i prolina i aromatyczna fenyloalanina
- polarne lecz nie zjonizowane: zawierające siarkę cysteina i metionina posiadające grupę hydroksylową: seryna, treonina i tyrozyna z ugrupowaniem indolowym tryptofan.
- kwasowe: zawierające dodatkową grupę karboksylową kw asparaginowy i glutaminowy oraz ich amidy asparagina i glutamina
- zasadowe: zawierające dodatkową grupę aminową: lizyna z ugrupowaniem guanidynowym arginina oraz z silnie zasadowym pierścieniem imidazolowym histydyna
Kryteria podziału:
- w zależności od wartości pJ
- uwzględniając charakter reszty -R (alifatyczne, aromatyczne)
- obecności dodatkowej grupy funkcyjnej (hydroksyl, półamidy, siarkowe)
- diaminomonokarboksylowe i dikaroksymonoaminowe
Podział wg Karlsona:
- z polarną resztą R, z hydrofobową resztą R: Gly, Ala, Val, Leu, Ile, Pro, Phl
- w reszcie zawierają grupę polarną albo niejonizującą lub trudnojonizującą w warunkach fizjologicznych są mniej polarne: Ser, Hta, Tyr, Trp, Cys, Met, Asn, Gln
- zawierające w cząsteczce R grupę jonizującą z grupą karboksylową w reszcie R: Asp, Glu
- zawierające dodatkową grupę aminową w reszcie R: His, Lys, Arg
Związkami amfoterycznymi (amfoterami bądź amfolitami) określa się substancje zachowujące się zarazem jak kwas i zasada. Aminokwasy spełniają ten warunek dzięki jednoczesnej obecności w cząsteczce grup kwasowych (protonodawców) oraz zasadowych (protonobiorców), a zatem ulegają dysocjacji (dobrze rozpuszczają się w wodzie) i występują w postaci cząsteczek naładowanych w zależności od odczynu środowiska. Jon obojnaczy (amfijon) posiadająca wypadkowy ładunek równy zero (ilość ładunków dodatnich i ujemnych jest taka sama). Punkt izoelektryczny pJ wartość pH przy której cząsteczki występują głównie w postaci amfijonu a ilość formy anionowej i kationowej jest niewielka i zrównoważona. Wartość pJ jest charakterystyczna dla każdego aminokwasu. W punkcie izoelektrycznym aminokwasy wykazują najsłabszą rozpuszczalność oraz posiadają najmniejsze przewodnictwo elektryczne. Wszystkie z wyjątkiem proliny dają reakcję barwną z ninhydryną. Aminokwasy siarkowe budują mostki disiarczkowe które utrzymują sztywną wtórną strukturę białka.
Peptydy
Zbudowane są z aminokwasów połączonych wiązaniem peptydowym -amidowym (w wyniku kondensacji grupy α-COOH i grupy aminowej α-NH2) inaczej amidy kwasowe. Franz Fischer twórca nazwy wiązania peptydowego. Konfiguracja wiązania nie zależy od rodzaju własności łańcuchów bocznych aminokwasów, delokalizacja elektronów i oscylacja wiązania podwójnego między C=O a C=N jest cechą charakterystyczną. Jest to jedno
z najtrwalszych wiązań odległość między atomem C i N jest mniejsza niż w aminach I rzędowych a między C i O większa niż w ketonach. Kąt między atomami i odległości są stałe.
Wyróżniamy:
- oligopeptydy (nie więcej niż 25 aminokwasów)
Właściwości zależą od składu i sekwencji peptydów, większość dobrze rozpuszcza się w wodzie, wszystkie aminokwasy dają dodatnią reakcje biuretową
- polipeptydy (do 100 aminokwasów)
- makropeptydy (powyżej 100 aminokwasów - białka)
Biosynteza peptydów z drobnoustrojów poza systemem rybosomalnym zachodzi z udziałem kompleksów wieloenzymowych i niektórych enzymów. U człowieka w systemie rybosomalnym w postaci białkowych prekursorów których częściowa proteoliza (rozkład) prowadzi do uwolnienia aktywnego peptydu. Peptydy- hormony antybiotyki kodony mediatory. Ich rola: uczestniczą w regulacji metabolizmu, chronią przed inwazją drobnoustrojów, niektóre są prekursorami ścian komórkowych u bakterii. Ulegają dializie w przeciwieństwie do białek. Reakcja biuretowa wykrywa wiązania peptydowe.
Kwasy nukleinowe:
Obok białek należą do podstawowych składników komórek. Są one wielocząsteczkowymi polimerami nukleotydów. Rozróżnia się rybonukleinowe RNA zawierające w składzie β-D-rybofuranozę i deoksyrybonukleinowe DNA zawierające 2-dekoksy-β-D-rybofuranozę.
Nukleozyd- połączenie zasady azotowej ze składnikiem cukrowym. Wiązanie glikozydowi łączy C-1 pentozy z atomem N-1 zasady pirymidynowej lub atomem N-9 zasady purynowej.
Nukleotyd- podstawowa jednoska strukturalna kwasów nukleinowych składa się z zasady azotowej (purynowej lub pirymidynowej) składnika cukrowego -pentozy (rybozy lub deoksyrybozy) oraz kwasu fosforowego. Połączenie nukleozydu wiązaniem estrowym z resztą kw ortofosforowego.
Zasady purynowe: adenina (Ade) i guanina (Gua)
Zasady pirymidynowe: cytozyna (Cyt) uracyl (Ura) i tymina (Thy)
Rna jest skupiony w rybosomach a DNA w jądrze. Występują w kompleksach z białkami -forma nukleoproteid. W roztworach stężonych soli nukleoproteidy dysocjują na kwasy nukleinowe i białka. Wolne kwasy dobrze rozpuszczają się w środowisku zasadowym słabo natomiast w wodzie rozcieńczonych kwasach i alkoholu. Jego obecność nadaje charakter kwaśny. Reakcją ogólną na wykrycie pentoz jest reakcja ortylowa Biala. Dużo jest ich w ikrze i mleczu ryb w wątrobie i biomasie drobnoustrojów. Zaburzenia w przemianie puryn prowadzą do podagry, artretyzmu i kamicy moczanowej.
Fosforylacja fotosyntetyczna: związana z fotosyntezą ATP powstaje na Kost energii światła słonecznego katalizuje ten proces synteza ATP zachodzi w roślinach i cyjanobakteriach
Fosforylacja oksydacyjna: biosynteza ATP sprzężona z łańcuchem oddechowym
Fosforylacja substratowa: odbywa się na koszt energii substratów przykłady znajdują się w beztlenowym szlaku degradacji glukozy oraz w cyklu Krebsa.
Białka - proteiny
Są podstawowym cząsteczkowym elementem każdej żywej komórki i uczestniczą nieomal we wszystkich procesach biologicznych. Spełniają rożne zadania strukturalne (cytoszkielet kolagen elastyna) i funkcjonalne (enzymy receptory regulatory przeciwciała składniki pokarmowe). Makropeptydy są polimerycznymi związkami wielocząsteczkowymi o masie od 10 do 1000 kDa zbudowanymi z ponad 100 do 10000 reszt L-α-aminokwasów. Reszty aminokwasów spinają kowalencyjne wiązania peptydowe (amidowe) powstałe z połączenia grupy α-karboksylowej jednego aminokwasu z grupą α-aminową drugiego. Struktura I-rzędowa -kolejność aminokwasu determinuje strukturę przestrzenną II III i IV-rzędową a zarazem ich właściwości oraz aktywność biologiczną.
Białka posiadają szereg wspólnych fizykochemicznych właściwości:
- mają zbliżony skład pierwiastkowy (C 50-55% H 6,6-7,3% N 15-19% O 19-21%)
- roztwory białek są hydrofilowymi układami koloidalnymi i nie ulegają dializie
- są amfoterami (posiadają zdolność wiązania jonów migrują w polu elektrycznym)
- wypadają z roztworu pod wpływem odpowiednio wysokich stężeń silnych elektrolitów wysalanie (likwidacja wodnej otoczki cząsteczek białka) oraz organicznych rozpuszczalników wytrącanie
- ulegają denaturacji czyli zniszczeniu natywnej konformacji powodują utratę właściwości biologicznej białka
- są związkami optycznie czynnymi: ich roztwory skręcają płaszczyznę światła spolaryzowanego (asymetryczne łańcuchy węgla Cα) oraz pochłaniają światłu UV (reszty aromatyczne)
Biorąc pod uwagę strukturę chemiczną wyróżniamy:
- białka proste (holoproteiny) zbudowane wyłącznie z reszt aminokwasów (albuminy globuliny skleroproteiny)
- białka złożone (heteroproteiny) zawierające w cząsteczce składnik niebiałkowy np. fosforanowy (fosfoproteidy) chromoforowy (chromoproteidy) cukrowy (glikoproteiny)
Mogą przybierać kształt kulisty elipsoidalny (sferyczny globularny) lub pałeczkowaty:
- sferoproteiny czyli białka globularne których cząsteczki mają postać kłębuszków (albuminy globuliny)
- skleroproteiny inaczej białka włókienkowe (fibrylarne): rozpuszczalne (fibrynogen miozyna) lub tworzące nierozpuszczalne odporne na czynniki chemiczne i fizyczne struktury (kreatyny kolagen fibroina)
Przyjmując jako kryterium rozpuszczalność wyróżniamy typy białek:
- albuminy: dobrze rozpuszczalne w wodzie i rozcieńczonych roztworach soli kwasów i zasad, charakteryzuje się małym momentem dipolowym oraz wysoką hydrofilnością
- globuliny: nierozpuszczalne w wodzie z powodu wysokiego momentu dipolowego cząsteczki, wykazuje skłonność do agregacji, do rozpuszczania wymagają obecności niewielkiej ilości dobrze dysocjującej na jony soli (wsalanie).
- prolaminy: rozpuszczalne tylko w 70% etanolu należą do nich białka roślinne
- gluteiny: rozpuszczalne jedynie w rozcieńczonych roztworach kwasów bądź zasad.
Białka globularne:
W białkach globularnych występują jedynie dwa typy struktur drugorzędowych: α-helisa i β-fałdowa.
- albuminy: rozpuszczalne w wodzie zawierają dużo aminokwasów siarkowych
- globuliny: nierozpuszczalne w wodzie ale w rozcieńczonych roztworach soli kwasów i zasad
- gluteiny: rozpuszczalne w kwasach i zasadach występują w ziarnach zbóż
- prolaminy: rozpuszczalne w alkoholu etylowym
- histony: rozpuszczalne w wodzie i rozcieńczonych kwasach
- protaminy: rozpuszczalne w wodzie
Białka podobnie jak aminokwasy są związkami amfoterycznymi. Nie ulegają dializie w przeciwieństwie do peptydów. Reakcja biuretowa wykrywa wiązania peptydowe. Białko jest charakterystycznie pofałdowane co ostatecznie tworzy strukturę białka.
Struktury pierwotne -I-rzędowe: sekwencja aminokwasów, kolejność ich ułożenia w białku determinuje struktury wtórne. Mukowiscydoza zmiana tylko jednego aminokwasu w 509 miejscy z Phe na Tyr, fenyloketonuria, anemia sierpowata Glu na Val.
Struktury wtórne -II-rzędowe: pierwotne zwinięcie łańcucha polipeptydowego, ułożenie w przestrzeni gengodontriplet, kąty dwuścienne między płaszczyznami kolejnych wiązań peptydowych. Warianty sekwencyjne 20100 Utrzymywane dzięki wiązaniami wodorowymi -C=O:::H-N- między grupami peptydów. Podaje się kąty torsyjne fi i psi.Występują oddziaływania hydrofobowe, elektrostatyczne van der Vaalsa.
α-helisa: występuje w białku włosów i miozynie. Na jeden obrót przypada 3,6 reszt aminokwasowych. Zwój prawoskrętny. Struktura stabilizowana jest wiązaniami wodorowymi. Jej struktura podczas wyciągania włoska zmienia się na strukturę β-fałdową.
β-harmonijka (kartka) struktura bardziej rozgałęziona. Reszty aminokwasowe odległe
-III-rzędowe: ostateczne zwinięcie łańcucha w przestrzeni jest stabilizowana przez wiązania wodorowe (inne niż w IIrzędowej) jonowe (elektrostatyczne) hydrofobowe (między aminokwasami hydrofobowymi) van der Vaalsa i disiarczkowe.
Struktury III-rzędowe:
- skleroproteiny (włókienkowe fibrylarne) fibryna miozyna
- sferoproteiny (białka globularne- kłębuszkowe)
-IV-rzędowe: białka oligomeryczne co najmniej 2 jednostki określa wzajemne położenie podjednostek (oligomerów). Struktura ta utrzymuje się przez słabe oddziaływania hydrofobowe jonowe wodorowe van der Vaalsa. Nie mogą występować tu wiązania kowalencyjne oraz mostki disiarczkowe (są zbyt silne). Np.: hemoglobina- białko składa się z 2 podjednostek α i 2 β. Ma cechę kooperatywności czyli łączenia się kolejnych podjednostek powodując zmiany komformacyjne.
Kolagen - włóknisty, elastyczny i mocny (1mm nikta 10kg), ścięgna powierzchni kości spaja komórki. Co trzeci aminokwas to glicyna: Gly-X-Y-Gly-X-Y Pro i Hyp~25% Gly~30% Leu Val Ala Lys Lys-OH, nie zawiera Tryptofanu i Cysterny. Nierozpuszcza się w wodzie odporny na rozciągnięcia. Struktura I-rzędowa kolagenu: tropokolagen. Podczas tworzenia się włókien kolagenowych pralina i lizyna ulegają hydroksylacji. Na każdy jeden skręt przypadają po 3,3 sąsiadujące aminokwasy. Reszty cukrowe w kolagenie powodują że ma on charakterystyczny galaretowatą konsystencję. Poprzez ogrzewanie kolagenu otrzymuje się żelatynę.
Funkcje białek:
- strukturalne: kolagen celuloza
- funkcjonalne: enzymy katalityczne (rybozymy katalityczne RNA) przeciwciała
- magazynują materię i energię -ferrytyna magazynuje żelazo, białkowe pierścienie łańcucha oddechowego w wewnętrznej stronie błony mitochondrialnej
- transport substancji: hemoglobina (tlen) mioglobina (tlen w mięśniach)
- bariera immunologiczna
- warunkują skoordynowane skurcze- miozyna i aktyna
- wzrost i różnicowanie komórek- białkowy czynnik wzrostu nerwów
Oddziaływania:
- jonowe
- hydrofobowe
- van der Vaalsa
- mostki disiarczkowe
- wodorowe
Białka- mogą następować zmiany konformacyjne- podstawy biokatalizy.
- zjawisko wzbudzonego dopasowania: połączenie białka z częścią niebiałkową. Następuje zmiana konformacji białka
- zjawisko allosterii: przyłączenie substancji niebiałkowej nie indukuje komplementarności ale powoduje określone i wyraźne zmiany w konformacji cząsteczki białka, które albo wzmagają albo obniżają jego funkcje
- ligandy: substancje niebiałkowe wiązane przez białko. Mogą być efektorem dodatnim lub ujemnym (aktywator allosteryczny lub inhibitor allosteryczny) może byś inne białko (np. w hemoglobinie)
- zmiana powinowactwa białka do małych cząsteczek wywołana przez zmianę konformacji.
Właściwości białek:
+ pod wpływem czynników ulegają denaturacji- czynnikiem jest utrata właściwości biologicznej, zdolności katalizowania reakcji enzymatycznych reakcji przemian metabolicznych funkcji strukturalnych (rozfałdowanie- 1 łańcuch w formie liniowej)
natywna forma- pofałdowana wykazuje wszystkie funkcje biologiczne
denaturowana forma- rozfałdowana traci na stałe swoje funkcje
Reakcji denaturacji Towarzyszy:
- spadek rozpuszczalności białka szczególnie w ich pJ
- wzrost reaktywności grup chemicznych zamaskowanych w białku natywnym dzięki pofałdowaniu łańcucha grupy -SH i -OH
- wzrost ilości grup jonizujących
- wzrost kąta skręcania płaszczyzny światła spolaryzowanego
- przyrost asymetrii cząsteczki
- utrata zdolności krystalizacji
- zwiększenie podatności na enzymatyczną proteolizę
Czynniki denaturacyjne:
- zbyt wysokie lub niskie pH
- zbyt wysoka lub niska temperatura
- promieniowanie UV i jonizujące
- stężone roztwory mocznika i chlorowodorku guanidyny
- detergenty
- jony metali ciężkich
+ renaturacja - proces odwrotny do denaturacji, cofamy redukcję grup -SH Cys i odtwarzamy mostki -SH natywnego białka, proces długotrwały i nie zawsze skuteczny
+ wykazują cechy koloidów hydrofilowych
+ nie dializują przez błony półprzepuszczalne
+ są zawsze naładowane- ładunek zależy od pH roztworu
+ duża pojemność buforowa- wynik amfoteryczności
+ polielektrolity
+ ulegają wysalaniu pod wpływem niedenaturujących je soli silnych kwasów bądź zasad
+ białka chłoną wodę- ulegają pęcznieniu
+ ulegają wsalaniu w obecności małych stężeń soli następuje wzrost ich rozpuszczalności
Katalizator: substancja która przyspiesza reakcje chemiczną ale nie wchodzi w skład produktu jest taka sama przed i po reakcji.
Szybkość reakcji v=k*[s]: szybkość reakcji jest proporcjonalna do stężenia. Skuteczność zderzających się i reagujących ze sobą cząsteczek zależy od energii kinetycznej. Czynniki wpływające na szybkość reakcji: stężenie reagentów- enzymów substratu koenzymów, czas reakcji, temperatura, pH, obecność związków dodatkowych.
Zwiększenie szybkości reakcji: jest możliwe poprzez dostarczenie energii (zwiększenie o 10% powoduje 2-3 krotne zwiększenie szybkości) Temperatury nie możemy zwiększać w nieskończoność co wynika z jej właściwości termoregulacji oraz poprzez obniżenie energii aktywności.
Stała Michaelisa jest to takie stężenie substratów przy którym szybkość reakcji osiąga połowę wartości maksymalnej wartość stałem w granicach od 10-2 do 10-6 mol/l
Równanie Michaela-Menten obrazuje związki pomiędzy parametrami V= Vmax/ KM/[S] +1
Stała efektywności katalitycznej definiuje całość reakcji enzymatycznej Keff= Kkat/KM
Enzymy:
białka katalizujące o masie od kilku do kilku milionów Daltonów, obniżają barierę energetyczną reakcji. Są to katalizatory działające specyficzne i mają określony charakter działania.
Cechy enzymów:
- wybiórczość działania: czym wybitnie różnią się od katalizatorów nieorganicznych, które tego nie posiadają i działają nieswoiście: 1) decyduje o kierunku reakcji- wybiera tylko jeden możliwy typ reakcji termodynamicznej 2) enzym katalizujący reakcje prowadzi ją tak że nie towarzyszą jej żadne uboczne przemiany substratów 3) wykazują specyficzność kierunkową
- specyficzność substratowa: 1) specyficzność absolutna- przemieniają w określonym kierunku tylko jeden substrat o określonej strukturze 2) specyficzność grupowa- enzym specyficzny do substratu o podanej budowie strukturalnej
Mechanizm działania enzymów: 1) enzym tworzy przejściowy kompleks molekularny z substratem. Kompleks enzym-substrat 2) po przyłączeniu cząsteczki substratu na skutek oddziaływań między określonymi grupami zachodzi aktywacja substratu w kompleksie . aktywacja ta dochodzi do stanu tranzycji (przejścia) czyli stanu w którym substrat z enzymem spontanicznie przechodzi w produkt 3) kompleks enzym-substrat przechodzi w kompleks enzym-produkt i uwalnia się cząsteczka produktu E+S<->E S<->ES*EP->E+P
Centra aktywne: W obszarze centrum aktywnego wyróżnia się dwa podobszary I miejsce wiążące (uczestniczy w wiązaniu substratu) II miejsce katalizujące (uczestniczy w samej reakcji). Reszty pomocnicze- nie z centr aktywnych- aminokwasy stabilizujące.
reszty -hydroksy aminokwasów Ser Thr i Tyr może pełnić rolę nukleofila
reszty -SH Cys (reszty tiulowe i wodorosiarczkowi) grupa hydroksylowa Gln i Asn)
reszty -His (pierścień imidazolowy przyłącza się i odbiera proton) reszty Arg i Lys
Aktywatory: -jony metali dwuwartościowych Zn2+ Mg2+ Ca2+ Fe2+ Mn2+ -jony chlorkowe na α-amylazę śliny -aktywatory allosteryczne
Inhibitory: niespecyficzne- jony metali ciężkich oddziałujące z wiązaniami dwusiarczkowymi i grupami tiulowymi, wbudowują się w mostki disulfidowe powodują ich rozpad i zmianę konformacji specyficzne- współzawodniczące mają na tyle podobną budowę do substratu, że mnogą przyłączyć się do centrum aktywnego enzymu, ale nie mogą ulec przemianie w produkt. Jest to inhibicja odwracalna i zależy od proporcji stężeń substratów i inhibitora. Jeżeli przewaga inhibitora łatwiej powstaje kompleks EJ- aby cofnąć powstanie kompleksu EJ należy zwiększyć stężenie enzymu
Inhibicja odwracalna- gdy inhibitor przyłączy się do enzymu przed substratem
Inhibicja nieodwracalna- gdy inhibitor przyłączy się do kompleksu enzym-substrat ponieważ następuje zakleszczenie substratu w enzymie
Katalizatory nieenzymatyczne: rybozymy- kataliczne RNA abzymy- kataliczne przeciwciała (też zbudowane z białek) mikrozymy- kataliczne peptydy najmniejszym jest lipaza.
Klasyfikacja enzymów:
- oksydoreduktazy: enzymy przenoszące elektrony i najcześciej równoważą ilość wodoru z donora na akceptor. Enzymy te potrzebują do działania koenzymów (FAD+ NAD+). Oksydoreduktazy SA to transferazy wodoru np. katalizy peroksydazy dehydrogenaza
- transferazy: przenoszą grupy funkcyjne inne niż atom wodoru przenosząc je z donora na akceptor. Grupy te to np: aldehydowe ketonowe metylowe. Mogą też przenosić grupy arylowe alkilowe aminowe oraz takie które zawierają w swej budowie atom azotu bądź siarki.
- hydrolazy: enzymy katalizujące rozerwanie wiązania estrowego eterowego peptydowego glikozydowego oraz wiązań bezwodników kwasowych.
- ligazy: odłączają od substratów jakieś grupy ale w reakcji innej niż hydroliza np. w reakcji dehydratacji po oderwaniu grupy poowdują powstawanie wiązania podwójnego.
- izomerazy: katalizują wszelkie wewnątrzcząsteczkowe przekształcenia w cząsteczce substratu. Racenazy- zmiana L i D Epimerazy- zmiana położenia podsta Izomerazy cis i trans
- ligazy: katalizują syntezę wiązań C-O (EC 6.1) C-S (EC 6.2) C-C C-N (EC 6.3) każda ta reakcja jest sprzężona z hydrolizą pirofosforanowego wiązania ATP
Cykl Krebsa: u eukariontów zachodzi w matrix mitochondrialnym a u prokariota w cytozylu. Z niego pochodzi większość atomów wodoru w łańcuchu oddechowym. Główną funkcją jest utlenianie pirogronianu do CO2 i H2O z jednoczesnym uzyskiwaniem energii. Substratami są szczawiooctan i acetyloCoA. Szczawiooctan odtwarza się po jednym obrocie a reszta acetylowa ulega degradacji do CO2 i H2O powstające w łańcuchu oddechowym. Efektem tej degradacji jest utworzenie 12 cząsteczek ATP z czego 11 powstaje w łańcuchu oddechowym a 1 w cyklu Krebsa. Cykl Krebsa polega na całkowitym utlenieniu czynnego octanu (Acetylo-CoA) w szeregu reakcji enzymatycznych do kwasu szczawiooctowego: W tym procesie zachodzi czterokrotnie dehydrogenacja 3NADH i 1FADH i dwukrotnie dekarboksylacja. Jednocześnie odbywają się dwa cykle Krebsa, utleniające dwa Acetylo-CoA, pochodzące z glikolizy. Na tym etapie energetycznym zyskiem jest 24ATP.
Łańcuch oddechowy: system przenośników elektronów i protonów. Zachodzi w wewnętrznej stronie mitochondrialnej. Celem łańcucha jest nie tylko redukcja O2 i H2O ale także biosynteza ATP. Istnieją 3 drogi wejścia do łańcucha oddechowego. Zyski energetyczne: 3ATP na cząsteczkę utlenionego NADH2 i 2ATP na cząsteczkę FADH2.
Koenzymy biorące udział: FAD FMN NAD. Dwa pierwsze to koenzymy flawinowe oba zawierają jednostkę mononukleotydu flawinowego która ma miejsce reaktywne. FAD ma dodatkową grupę cukrową i zasadę adeninową. Są pochodnymi witaminy B2 czyli ryboflawiny. FAD-dinukleotyd flawinowy adeniny FMN-mononukleotyd flawinowy.
NAD+-dinukleotyd nikotynoamidoadeninowy koenzym mający strukturę opartą na adeninie dwóch cząsteczkach rybozy powiązanych grupami fosforanowymi i pierścieniu nikotynoamidowym- będący częścią reaktywną. Często używany w reakcjach katabolicznych. Z NAD+ powstaje NADP+ który posiada dodatkową grupę fosforanową przyłączoną do jednej z cząsteczek rybozy. Używany w reakcjach anaboliz.
Oksydacyjna dekarboksylacja 2-oksykwasu np. α-ketaglutanonu prowadzi do powstania bursztynylokoenzymu A. Proces ten bardzo przypomina dekarboksylację pirogronianu który jest także α-ketokwasem:
pirogronian+CoA+NAD+acetyloCoA+CO2+NADH. Połączenie z CoA to wiązanie tioestrowe o wysokim potencjale przenoszenia. Enzym biorący udział to dehydrogenaza α-ketoglutanonu. Grupą prostetyczną (niebiałkowa pomocnicza) jest kwas liponowy oraz TPP (pirofosforan tianiny)- koenzym odpowiedzialny za transfer grupy aldehydowej.
TTP- jest pochodną wit B1. Niedoborów tiaminy (wit B1) choroba beri-beri zaburzenia neurologiczne pirogronianu sercowo-naczyniowe. Objawami są bóle rąk nóg osłabienie mięśni chorobowe zmiany na skórze. Pirogronianu wypadku zachorowania na beri-beri stężenie pirogronianu: α-glutenonu jest większe od prawidłowego.
Przekształcenie pirogronianu w acetylo-CoA:
1. pirogronianu łączy się z TTP i ulega dekarboksylacji. Protonacja prowadzi do powstania hydroksyetylotianiny
2. grupa hydroksyetylowa przyłączona do TTP jest utleniana do grupy acetylowej i jednocześnie przenoszona na lipoamid pochodną kwasu lipowego. W wyniku tej reakcji powstaje acetylolipoamid.
3. przeniesienie grupy acetylowej z acetylolipoamidu na CoA i utworzenie acetylo-CoA. Postały z pirogronianu acetylo-CoA będzie teraz substratem energetycznym cyklu kwasu cytrynowego.
Fotosynteza: proces asymilacji CO2 przez rośliny zielone przebiegający w chloroplastach.
Faza jasna: zachodzi za dnia zachodzi w talekoidach. Proces ten odbywa się na zasadzie pochłaniania energii przez chlorofil. Reakcje: biosynteza ATP: ADP+PiATP i fotoliza wody (reakcja Hilla) 2H2O4H++4e-+O2 Tlen jest ubocznym produktem fotosyntezy. Z fotolizą H2O sprzężona jest reakcja redukcji NADP: NADP+2H++2e-NADPH+H+
Protony które redukują NADP pochodzą z fotolizy H2O. Cząsteczki chlorofilu A i B oraz cząsteczki ksenofili i karotenoidów są skumulowane w dwa fotosystemy. Pierwszy to PS1 drugi PS2- zależą od długości światła. Wydzielone są cząsteczki chlorofilu- antenowe które znajdują się w centrum reakcji do których wchłonięta jest energia przekazywana do centrum reakcji- jest ona tak duża że mogą z niej być wybite elektrony. Ruch elektronu odbywa się przeciwnie do potencjałów elektrochemicznych. Elektrony pochodzące z fotolizy H2O zostają wprowadzone do fotosystemu aby chlorofil wrócił z kationu do stanu normalnego. Elektrony które wróciły mają swoją energię i idą do P-700 (PS1). Produktami fazy świetlnej jest ATP i NADPH2 oraz O2 jako produkt uboczny.
Faza ciemna: wiązanie CO2 ta faza składa się z dwóch etapów:
1 etap: właściwa asymilacja CO2- przyłączenie cząsteczek CO2 do akceptora rybozy-1,5-bisfosforanu. Jest tu wykorzystywane ATP i NADPH2 do redukcji powstającego 3-fosfoglicerynianu do triody aldehydu 3-fosfoglicerynowego.
2 etap: część cząsteczek trioz jest wykorzystywana do regeneracji akceptora CO2 czyli rybulozo-1,5-bis-P tzw Cykl Calvina. RUBISCO katalizuję karboksylację rybulozo-1,5-bis-P jest to enzym defektywny wykazuje aktywność nie tylko karboksylazy ale również oksygenazy.
Szlak pentozowy: stanowi źródło NADPH (fosforan dinukleotydu nikotynoamidoadeninowego) oraz dostarcza rybozy-5-P który wykorzystywany jest np. do syntezy RNA DNA. Zachodzi w cytoplazmie i ma ogromne znaczenia w tych tkankach które syntetyzują kwasy tłuszczowe i steroidy. Pełni wie podstawowe funkcje: tworzenie NADPH i przekształcanie heksos z pentozy. Szlak ma 3 etapy:
1. reakcje utleniania przekształcające glukozo-6-P w rybozo-5-P z wytworzeniem 2NADPH
2. izomeryzacja rybozo-5-P do rybozo-5-P
3. powiązanie szlaku pentozowego z Glikolizą działaniem transektolazy i transaldolazy.
Reakcje transektolazy i transaldolazy są odwracalne co pozwala albo na przekształcenie rybo-5-P w intermediat glikolizy (ald 3-Pglic i fruktozo-6-P) jeżeli nie jest potrzebny w komórce do innych reakcji albo na tworzenie rybozo-5-P z intermediatów glikolizy gdy potrzebny jest w dużych ilościach.
Cykl mocznikowy: powstaje mocznik w postaci którego zwierzęta ureotoliczne wydalają z organizmu amoniak. Nadmiar amoniaku zwiększa syntezę glutaminianu i glutaminy które mają szkodliwy wpływ na czynności mózgu. Cykl mocznikowy- reakcja sumaryczna: NH4++HCO3-+H2O+3ATP+asparaginian mocznik+2ADP+AMP+2Pi+PPi+fumaran
Glikoliza: Glikoliza jest beztlenowym etapem obróbki glukozy, przy której wydzielana jest energia w postaci ATP. Jest to ciąg reakcji zachodzących w cytoplazmie. Polega na dostarczeniu energii (albo bezpośrednio albo przez substraty dla cyklu kwasu cytrynowego i fosforyzacji oksydacyjnej) oraz wytworzeniu intermeiatów dla szlaków biosyntetycznych. Następuje tutaj degradacja glukozy. Glikoliza jest szlakiem jednosubstratowym ulega degradacji do związków innych niż wyjściowe. Zachodzi w 3 etapach:
1. przygotowanie cząsteczki glukozy do rozszczepienia aldolowego na dwie triozy
2. triozy są utleniane do kwasu pirogronowego Powstają 4 ATP
3. rozkład pirogronianu w zależności od warunków (beztlenowe czy tlenowe)
Zysk energetyczny: 2 cząsteczki AT na jedną cząsteczkę glukozy 2 cząsteczki pirogronianu
β-oksydacja: degeneracja kwasów tłuszczowych (utlenienie długich łańcuchów kwasów tłuszczowych). Rozpad zachodzi w cytozylu u prokariota a w matrix u eukariota.
Etapy: 1. utlenienie acylo-CoA do enoilo-CoA zawierającego w łańcuchu kwasu tłuszczowego wiązanie podwójne czemu towarzyszy powstawanie FADH2
2. uwodnienie enoilo-CoA do 3-hydrijstacylo-CoA
3. utlenienie 3-hydroksyacylo-CoA do 3-ketoacylo-CoA czemu towarzyszy powstawanie NADH
4. rozszczepienie lyb tioliza 3-ketoacylo-CoA przez drugą cząsteczkę CoA prowadzące do powstania acetylo-CoA i acylo-CoA skróconego o 2 atomy węgla.
Zysk energetyczny: 106 cząsteczek ATP.
Rozkład tłuszczy prostych: R1 R2 R3 to reszty arylowe wyższych kwasów tłuszczowych które są estrowo związane z alkoholem i glicerolem. Lipidy rozkładane są przez lipazy (3klasa) w ustroju zwierzęcym występują dwa rodzaje lipa: trzustkowa i jelitowa. Lipaza trzustkowa odszczepia skrajne reszty arylowe R1 i R3. Lipaza jelitowa odszczepia środkową resztą kwasu tłuszczowego R2.
ATP- adenoztnotrifosforan: biosynteza ATP jest mianem fosforylaji: ADP+PiATP
Fosforyzacja fotosyntetyczna- ATP powstaje na koszt energii światła słonecznego, proces katalizuje syntetaza ATP. Fosforyzacja oksydacyjna- proces polega na biosyntezie ATP sprzężonego z łańcuchem oddechowym i proces katalizowany przez syntetaza ATP. Fosforyzacja substratowa- odbywa się na koszt energii substratu np. w glikolizie oraz w cyklu Krebsa i proces katalizowany przez kinezy bądź syntetaza. Reakcja rozkładu ATP jest katalizowana przez adenozynotrifosfatazę
Fosforan pirydoksalu PLP: jest pochodną witaminy B6 bierze udział w fosforolitycznym rozkładzie glikogenu. Grupa aldehydowa tego koenzymu tworzy zasadę Schiffa ze specyficznym łańcuchem bocznym lizany fosforylazy
Fosforan tiaminy TTP: część czynną TTP jest pierścień tiazolowy który występuje w postaci karbokationu gdzie przyłączają się 2-oksykwasy przez grupę ketonową. Pochodna witaminy B1. bierze udział w cyklu Krebsa i Calvina.
Cytydynotrifosforan CTP: powstaje z trifosforanu urydyny przez wymianę tlenu grupy karbonylowej na grupę aminową. Wykorzystywany do syntezy RNA oraz uczestniczy w biosyntezie fosfolipidów.
Koenzym CoA: koenzym A bierze udział w katabolizmie. Powstaje w wyniku dekarboksylacji oksydacyjnej pirogronianu. Acetylo-CoA jest substratem w cyklu Krebsa. Przenosi reszty arylowe. Wszystkie reszty arylowe są połażone z tym CoA wiązaniem makroergicznym. CoA jest pochodną kwasu pantotenowego.
Ubichinon- koenzym Q: jest pochodną chinową długim ogonem izoprenowym. Liczba pięciowęglowych jednostek izoprenowych zależy od gatunku. Forma najpowszechniej spotykana u ssaków zawiera 10jednostek izoprenowych (koenzym Q10). Chinony mogą występować w trzech stanach utlenienia. W stanie całkowicie utlenionym Q koenzym Q ma dwie grupy ketonowe. Dołączenie jednego elektronu i jednego protonu powoduje przejście do formy semichionu PH. Forma semichionowa względnie łatwo ulega deprotenacji tworząc rodnik anionowy semichiononu Q-. Po dołączeniu drugiego elektronu i protonu powstaje całkowicie zredukowana forma koenzymu Q, Ubichinon QH2 który bardzo silnie przytrzymuje protony. Ubichinon stanowi ostatnie ogniwo łańcucha oddechowego, do którego dochodzą atomy wodoru. Dalej przenoszone są już tylko elektrony. W łańcuchu oddechowym występuje on w ilości znacznie większej od innych składników łańcucha oddechowego. Ubichinon jest ruchomym elementem łańcucha. Krąży w membranie komórkowej (lub wewnętrznej błonie mitochondrialnej) pomiędzy Kompleksem I, Kompleksem II i cytochromami.
W łańcuchu oddechowym u niektórych Prokariota w okolicach działania ubichinonu mogą występować związki towarzyszące temu koenzymowi: witaminy K oraz witaminy E.
Peptydy
Zbudowane są z aminokwasów połączonych wiązaniem peptydowym -amidowym (w wyniku kondensacji grupy α-COOH i grupy aminowej α-NH2) inaczej amidy kwasowe. Franz Fischer twórca nazwy wiązania peptydowego. Konfiguracja wiązania nie zależy od rodzaju własności łańcuchów bocznych aminokwasów, delokalizacja elektronów i oscylacja wiązania podwójnego między C=O a C=N jest cechą charakterystyczną. Jest to jedno
z najtrwalszych wiązań odległość między atomem C i N jest mniejsza niż w aminach I rzędowych a między C i O większa niż w ketonach. Kąt między atomami i odległości są stałe.
Wyróżniamy:
- oligopeptydy (nie więcej niż 25 aminokwasów)
Właściwości zależą od składu i sekwencji peptydów, większość dobrze rozpuszcza się w wodzie, wszystkie aminokwasy dają dodatnią reakcje biuretową
- polipeptydy (do 100 aminokwasów)
- makropeptydy (powyżej 100 aminokwasów - białka)
Biosynteza peptydów z drobnoustrojów poza systemem rybosomalnym zachodzi z udziałem kompleksów wieloenzymowych i niektórych enzymów. U człowieka w systemie rybosomalnym w postaci białkowych prekursorów których częściowa proteoliza (rozkład) prowadzi do uwolnienia aktywnego peptydu. Peptydy- hormony antybiotyki kodony mediatory. Ich rola: uczestniczą w regulacji metabolizmu, chronią przed inwazją drobnoustrojów, niektóre są prekursorami ścian komórkowych u bakterii. Ulegają dializie w przeciwieństwie do białek. Reakcja biuretowa wykrywa wiązania peptydowe.
Sacharydy
Cukrowce węglowodany dzielą się na dwie grupy. Monosacharydy czyli cukry proste i disacharydy i polisacharydy cukry złożone. Monosacharydy pod względem chemicznym są alkoholami wielowodorotlenowymi z grupą aldehydową (aldozy) lub ketonową (ketozy). W zależności od ilości atomów węgla w cząsteczce dzielą się one na triozy (3C) tetrozy (4C) pentozy (5C) heksozy (6C) i heptozy (7C). Przedstawicielem aldopentoz jest ryboza i ksyloza-składnik hemiceluloz, aldohektoz- glukoza mannoza i galaktoza, ketoheksoz- fruktoza.
Cukry proste monosacharydy: prócz formy łańcuchowej otwartej tworzą pierścienie heterocykliczne pochodne furanu (pięcioczłonowe) i piranu (sześcioczłonowe). Desmotropia zjawisko cyrkulacji wewnątrz cząsteczkowej cukrów- polega na występowaniu związku chemicznego w dwóch postaciach mogących samorzutnie przechodzić jedna w drugą:
forma łańcuchowa ph<7 pH>7 forma cykliczna
Disacharydy: powstają poprzez połączenie dwóch cukrów prostych wiązaniem glikozydowym. Grupa wodorotlenowa przy anomerycznym atomie węgla monosacharydu (nazywanym węglem glikozydowym) charakteryzuje się dużą reaktywnością i łątwo reaguje z alkoholami tworząc acetale zwane glikozydami. Podstawowe disacharydy to:
Maltoza - α-glukozylo - 4-glukoza wiązania: glukoza α1,4 glukoza dwucukier powstający podczas hydrolizy skrobi i jest dalej hydrolizowana do glukozy przez maltozę
Laktoza - β-galaktozylo - 4-glukoza dwucukier występujący w mleku składa się z galaktozy i glukozy połączonych wiązaniem β-1-4-glikozydowym. Hydroliza laktozy do cukrów prostych katalizuje u ludzi laktaza
Celobioza - β-glukozylo - 4-glukoza wiązania: glukoza β1,4 glukoza
Trehaloza - α-glukozylo - 1-glukozyd
Sacharoza - β-fruktozylo - α-glukozyd wiązania: glukoza α,1 + β,2 fruktoza nie redukuje
na skalę przemysłową otrzymuje się z trzciny cukrowej i buraków cukrowych. Utworzony przez reszty glukozy i fruktozy połączone anomerycznymi atomami węgla. Wiązanie glikozydowy ma konfigurację α dla glukozy i β dla fruktozy. Hydroliza sacharozy do glukozy i fruktozy jest katalizowana przez sacharazę.
Właściwości disacharydów zależą od sposobu powiązania monosacharydów
- od typu wiązania glikozydowego (α i β) - od pozycji węgla w łańcuchu z którym „węgiel glikozydowy” sprzęga się z mostkiem tlenowym - od rodzaju pierścienia cukrowców (furanowy lub piranozowy)
Polisacharydy: są to produkty polikondensacji monosacharydów połączonych z sobą wiązaniami glikozydowymi. W stosunku do mono i disacharydów mają odmienne właściwości fizyczne i chemiczne. W zależności od cukrów tworzących polisacharyd dzielimy je na: homoglikany (homopolisacharydy) (zbudowane wyłącznie z glukozy -skrobia glikogen celuloza dekstran z fruktozy- inulina) heteroglikany (mukopolisacharydy i hemicelulozy)
Skrobia: amyloza -α1,4 glikozydowe, polimer glukozy 24%, amylopektyna -α1,4 i α1,6 glikozydowe 76% (budowa nieregularna krzaczasta)
Glikogen -skrobia zwierzęca (występuje w wątrobie) jeszcze bardziej rozgałęziony
Celuloza: najczęściej produkt roślinny, celuloza bakteryjna jest idealnie prosta. Występują wiązania β1,4 glikozydowe.
Dekstran: różne wiązania α duża lepkość bardzo rozgałęziony stosowany w postacie sit molekularnych. Indulina: polimer zbudowany z fruktozy (w kłączach irysa u cykorii)
Kwasy nukleinowe:
Obok białek należą do podstawowych składników komórek. Są one wielocząsteczkowymi polimerami nukleotydów. Rozróżnia się rybonukleinowe RNA zawierające w składzie β-D-rybofuranozę i deoksyrybonukleinowe DNA zawierające 2-dekoksy-β-D-rybofuranozę.
Nukleozyd- połączenie zasady azotowej ze składnikiem cukrowym. Wiązanie glikozydowi łączy C-1 pentozy z atomem N-1 zasady pirymidynowej lub atomem N-9 zasady purynowej.
Nukleotyd- podstawowa jednoska strukturalna kwasów nukleinowych składa się z zasady azotowej (purynowej lub pirymidynowej) składnika cukrowego -pentozy (rybozy lub deoksyrybozy) oraz kwasu fosforowego. Połączenie nukleozydu wiązaniem estrowym z resztą kw ortofosforowego.
Zasady purynowe: adenina (Ade) i guanina (Gua)
Zasady pirymidynowe: cytozyna (Cyt) uracyl (Ura) i tymina (Thy)
Rna jest skupiony w rybosomach a DNA w jądrze. Występują w kompleksach z białkami -forma nukleoproteid. W roztworach stężonych soli nukleoproteidy dysocjują na kwasy nukleinowe i białka. Wolne kwasy dobrze rozpuszczają się w środowisku zasadowym słabo natomiast w wodzie rozcieńczonych kwasach i alkoholu. Jego obecność nadaje charakter kwaśny. Reakcją ogólną na wykrycie pentoz jest reakcja ortylowa Biala. Dużo jest ich w ikrze i mleczu ryb w wątrobie i biomasie drobnoustrojów. Zaburzenia w przemianie puryn prowadzą do podagry, artretyzmu i kamicy moczanowej.
Fosforylacja fotosyntetyczna: związana z fotosyntezą ATP powstaje na Kosyt energii światła słonecznego katalizuje ten proces synteza ATP zachodzi w roślinach i cyjanobakteriach
Fosforylacja oksydacyjna: biosynteza ATP sprzężona z łańcuchem oddechowym
Fosforylacja substratowa: odbywa się na koszt energii substratów przykłady znajdują się w beztlenowym szlaku degradacji glukozy oraz w cyklu Krebsa.
Aminokwasy:
Są małocząsteczkowymi związkami organicznymi zawierające dwie grupy funkcyjne aminową -NH2 i kwasową -COOH (karboksylową) są pochodnymi niższych kwasów tłuszczowych (karboksylowych). Ich podstawową funkcją biologiczną jest udział w tworzeniu białek. Jedynie dwadzieścia spośród nich stanowi monomeryczny składnik makropeptydowych łańcuchów nieomal wszystkich białek, nazywamy je proteinogenne. Związki te są pierwszorzędowymi aminami jedynie prolina i hydroksylizyna posiada drugorzędową grupę aminową (są iminokwasami). Obydwie grupy funkcyjne przyłączone są do atomu węgla w pozycji α i występują w konfiguracji izomerów L u wszystkich poza glicyną węgiel α jest atomem asymetrycznym (chiralnym). Różnorodność i fizykochemiczne właściwości warunkuje odmienna struktura łańcuchów bocznych R. podstawniki różnią się wielkością, kształtem, ładunkiem oraz reaktywnością.
Podział aminokwasów poprzez podstawnik -R
- niepolarne: o alifatycznym łańcuchu bocznym: glicyna, alanina, walina, leucyna, izoleucyna i prolina i aromatyczna fenyloalanina
- polarne lecz nie zjonizowane: zawierające siarkę cysteina i metionina posiadające grupę hydroksylową: seryna, treonina i tyrozyna z ugrupowaniem indolowym tryptofan.
- kwasowe: zawierające dodatkową grupę karboksylową kw asparaginowy i glutaminowy oraz ich amidy asparagina i glutamina
- zasadowe: zawierające dodatkową grupę aminową: lizyna z ugrupowaniem guanidynowym arginina oraz z silnie zasadowym pierścieniem imidazolowym histydyna
Kryteria podziału:
- w zależności od wartości pJ
- uwzględniając charakter reszty -R (alifatyczne, aromatyczne)
- obecności dodatkowej grupy funkcyjnej (hydroksyl, półamidy, siarkowe)
- diaminomonokarboksylowe i dikaroksymonoaminowe
Podział wg Karlsona:
- z polarną resztą R, z hydrofobową resztą R: Gly, Ala, Val, Leu, Ile, Pro, Phl
- w reszcie zawierają grupę polarną albo niejonizującą lub trudnojonizującą w warunkach fizjologicznych są mniej polarne: Ser, Hta, Tyr, Trp, Cys, Met, Asn, Gln
- zawierające w cząsteczce R grupę jonizującą z grupą karboksylową w reszcie R: Asp, Glu
- zawierające dodatkową grupę aminową w reszcie R: His, Lys, Arg
Związkami amfoterycznymi (amfoterami bądź amfolitami) określa się substancje zachowujące się zarazem jak kwas i zasada. Aminokwasy spełniają ten warunek dzięki jednoczesnej obecności w cząsteczce grup kwasowych (protonodawców) oraz zasadowych (protonobiorców), a zatem ulegają dysocjacji (dobrze rozpuszczają się w wodzie) i występują w postaci cząsteczek naładowanych w zależności od odczynu środowiska. Jon obojnaczy (amfijon) posiadająca wypadkowy ładunek równy zero (ilość ładunków dodatnich i ujemnych jest taka sama). Punkt izoelektryczny pJ wartość pH przy której cząsteczki występują głównie w postaci amfijonu a ilość formy anionowej i kationowej jest niewielka i zrównoważona. Wartość pJ jest charakterystyczna dla każdego aminokwasu. W punkcie izoelektrycznym aminokwasy wykazują najsłabszą rozpuszczalność oraz posiadają najmniejsze przewodnictwo elektryczne. Wszystkie z wyjątkiem proliny dają reakcję barwną z ninhydryną. Aminokwasy siarkowe budują mostki disiarczkowe które utrzymują sztywną wtórną strukturę białka.
Białka - proteiny
Są podstawowym cząsteczkowym elementem każdej żywej komórki i uczestniczą nieomal we wszystkich procesach biologicznych. Spełniają rożne zadania strukturalne (cytoszkielet kolagen elastyna) i funkcjonalne (enzymy receptory regulatory przeciwciała składniki pokarmowe). Makropeptydy są polimerycznymi związkami wielocząsteczkowymi o masie od 10 do 1000 kDa zbudowanymi z ponad 100 do 10000 reszt L-α-aminokwasów. Reszty aminokwasów spinają kowalencyjne wiązania peptydowe (amidowe) powstałe z połączenia grupy α-karboksylowej jednego aminokwasu z grupą α-aminową drugiego. Struktura I-rzędowa -kolejność aminokwasu determinuje strukturę przestrzenną II III i IV-rzędową a zarazem ich właściwości oraz aktywność biologiczną.
Białka posiadają szereg wspólnych fizykochemicznych właściwości:
- mają zbliżony skład pierwiastkowy (C 50-55% H 6,6-7,3% N 15-19% O 19-21%)
- roztwory białek są hydrofilowymi układami koloidalnymi i nie ulegają dializie
- są amfoterami (posiadają zdolność wiązania jonów migrują w polu elektrycznym)
- wypadają z roztworu pod wpływem odpowiednio wysokich stężeń silnych elektrolitów wysalanie (likwidacja wodnej otoczki cząsteczek białka) oraz organicznych rozpuszczalników wytrącanie
- ulegają denaturacji czyli zniszczeniu natywnej konformacji powodują utratę właściwości biologicznej białka
- są związkami optycznie czynnymi: ich roztwory skręcają płaszczyznę światła spolaryzowanego (asymetryczne łańcuchy węgla Cα) oraz pochłaniają światłu UV (reszty aromatyczne)
Biorąc pod uwagę strukturę chemiczną wyróżniamy:
- białka proste (holoproteiny) zbudowane wyłącznie z reszt aminokwasów (albuminy globuliny skleroproteiny)
- białka złożone (heteroproteiny) zawierające w cząsteczce składnik niebiałkowy np. fosforanowy (fosfoproteidy) chromoforowy (chromoproteidy) cukrowy (glikoproteiny)
Mogą przybierać kształt kulisty elipsoidalny (sferyczny globularny) lub pałeczkowaty:
- sferoproteiny czyli białka globularne których cząsteczki mają postać kłębuszków (albuminy globuliny)
- skleroproteiny inaczej białka włókienkowe (fibrylarne): rozpuszczalne (fibrynogen miozyna) lub tworzące nierozpuszczalne odporne na czynniki chemiczne i fizyczne struktury (kreatyny kolagen fibroina)
Przyjmując jako kryterium rozpuszczalność wyróżniamy typy białek:
- albuminy: dobrze rozpuszczalne w wodzie i rozcieńczonych roztworach soli kwasów i zasad, charakteryzuje się małym momentem dipolowym oraz wysoką hydrofilnością
- globuliny: nierozpuszczalne w wodzie z powodu wysokiego momentu dipolowego cząsteczki, wykazuje skłonność do agregacji, do rozpuszczania wymagają obecności niewielkiej ilości dobrze dysocjującej na jony soli (wsalanie).
- prolaminy: rozpuszczalne tylko w 70% etanolu należą do nich białka roślinne
- gluteiny: rozpuszczalne jedynie w rozcieńczonych roztworach kwasów bądź zasad.
Białka globularne:
W białkach globularnych występują jedynie dwa typy struktur drugorzędowych: α-helisa i β-fałdowa.
- albuminy: rozpuszczalne w wodzie zawierają dużo aminokwasów siarkowych
- globuliny: nierozpuszczalne w wodzie ale w rozcieńczonych roztworach soli kwasów i zasad
- gluteiny: rozpuszczalne w kwasach i zasadach występują w ziarnach zbóż
- prolaminy: rozpuszczalne w alkoholu etylowym
- histony: rozpuszczalne w wodzie i rozcieńczonych kwasach
- protaminy: rozpuszczalne w wodzie
Białka podobnie jak aminokwasy są związkami amfoterycznymi. Nie ulegają dializie w przeciwieństwie do peptydów. Reakcja biuretowa wykrywa wiązania peptydowe. Białko jest charakterystycznie pofałdowane co ostatecznie tworzy strukturę białka.
Struktury pierwotne -I-rzędowe: sekwencja aminokwasów, kolejność ich ułożenia w białku determinuje struktury wtórne. Mukowiscydoza zmiana tylko jednego aminokwasu w 509 miejscy z Phe na Tyr, fenyloketonuria, anemia sierpowata Glu na Val.
Struktury wtórne -II-rzędowe: pierwotne zwinięcie łańcucha polipeptydowego, ułożenie w przestrzeni gengodontriplet, kąty dwuścienne między płaszczyznami kolejnych wiązań peptydowych. Warianty sekwencyjne 20100 Utrzymywane dzięki wiązaniami wodorowymi -C=O:::H-N- między grupami peptydów. Podaje się kąty torsyjne fi i psi.Występują oddziaływania hydrofobowe, elektrostatyczne van der Vaalsa.
α-helisa: występuje w białku włosów i miozynie. Na jeden obrót przypada 3,6 reszt aminokwasowych. Zwój prawoskrętny. Struktura stabilizowana jest wiązaniami wodorowymi. Jej struktura podczas wyciągania włoska zmienia się na strukturę β-fałdową.
β-harmonijka (kartka) struktura bardziej rozgałęziona. Reszty aminokwasowe odległe
-III-rzędowe: ostateczne zwinięcie łańcucha w przestrzeni jest stabilizowana przez wiązania wodorowe (inne niż w IIrzędowej) jonowe (elektrostatyczne) hydrofobowe (między aminokwasami hydrofobowymi) van der Vaalsa i disiarczkowe.
Struktury III-rzędowe:
- skleroproteiny (włókienkowe fibrylarne) fibryna miozyna
- sferoproteiny (białka globularne- kłębuszkowe)
-IV-rzędowe: białka oligomeryczne co najmniej 2 jednostki określa wzajemne położenie podjednostek (oligomerów). Struktura ta utrzymuje się przez słabe oddziaływania hydrofobowe jonowe wodorowe van der Vaalsa. Nie mogą występować tu wiązania kowalencyjne oraz mostki disiarczkowe (są zbyt silne). Np.: hemoglobina- białko składa się z 2 podjednostek α i 2 β. Ma cechę kooperatywności czyli łączenia się kolejnych podjednostek powodując zmiany komformacyjne.
Kolagen - włóknisty, elastyczny i mocny (1mm nikta 10kg), ścięgna powierzchni kości spaja komórki. Co trzeci aminokwas to glicyna: Gly-X-Y-Gly-X-Y Pro i Hyp~25% Gly~30% Leu Val Ala Lys Lys-OH, nie zawiera Tryptofanu i Cysterny. Nierozpuszcza się w wodzie odporny na rozciągnięcia. Struktura I-rzędowa kolagenu: tropokolagen. Podczas tworzenia się włókien kolagenowych pralina i lizyna ulegają hydroksylacji. Na każdy jeden skręt przypadają po 3,3 sąsiadujące aminokwasy. Reszty cukrowe w kolagenie powodują że ma on charakterystyczny galaretowatą konsystencję. Poprzez ogrzewanie kolagenu otrzymuje się żelatynę.
Funkcje białek:
- strukturalne: kolagen celuloza
- funkcjonalne: enzymy katalityczne (rybozymy katalityczne RNA) przeciwciała
- magazynują materię i energię -ferrytyna magazynuje żelazo, białkowe pierścienie łańcucha oddechowego w wewnętrznej stronie błony mitochondrialnej
- transport substancji: hemoglobina (tlen) mioglobina (tlen w mięśniach)
- bariera immunologiczna
- warunkują skoordynowane skurcze- miozyna i aktyna
- wzrost i różnicowanie komórek- białkowy czynnik wzrostu nerwów
Oddziaływania:
- jonowe
- hydrofobowe
- van der Vaalsa
- mostki disiarczkowe
- wodorowe
Białka- mogą następować zmiany konformacyjne- podstawy biokatalizy.
- zjawisko wzbudzonego dopasowania: połączenie białka z częścią niebiałkową. Następuje zmiana konformacji białka
- zjawisko allosterii: przyłączenie substancji niebiałkowej nie indukuje komplementarności ale powoduje określone i wyraźne zmiany w konformacji cząsteczki białka, które albo wzmagają albo obniżają jego funkcje
- ligandy: substancje niebiałkowe wiązane przez białko. Mogą być efektorem dodatnim lub ujemnym (aktywator allosteryczny lub inhibitor allosteryczny) może byś inne białko (np. w hemoglobinie)
- zmiana powinowactwa białka do małych cząsteczek wywołana przez zmianę konformacji.
Właściwości białek:
+ pod wpływem czynników ulegają denaturacji- czynnikiem jest utrata właściwości biologicznej, zdolności katalizowania reakcji enzymatycznych reakcji przemian metabolicznych funkcji strukturalnych (rozfałdowanie- 1 łańcuch w formie liniowej)
natywna forma- pofałdowana wykazuje wszystkie funkcje biologiczne
denaturowana forma- rozfałdowana traci na stałe swoje funkcje
Reakcji denaturacji Towarzyszy:
- spadek rozpuszczalności białka szczególnie w ich pJ
- wzrost reaktywności grup chemicznych zamaskowanych w białku natywnym dzięki pofałdowaniu łańcucha grupy -SH i -OH
- wzrost ilości grup jonizujących
- wzrost kąta skręcania płaszczyzny światła spolaryzowanego
- przyrost asymetrii cząsteczki
- utrata zdolności krystalizacji
- zwiększenie podatności na enzymatyczną proteolizę
Czynniki denaturacyjne:
- zbyt wysokie lub niskie pH
- zbyt wysoka lub niska temperatura
- promieniowanie UV i jonizujące
- stężone roztwory mocznika i chlorowodorku guanidyny
- detergenty
- jony metali ciężkich
+ renaturacja - proces odwrotny do denaturacji, cofamy redukcję grup -SH Cys i odtwarzamy mostki -SH natywnego białka, proces długotrwały i nie zawsze skuteczny
+ wykazują cechy koloidów hydrofilowych
+ nie dializują przez błony półprzepuszczalne
+ są zawsze naładowane- ładunek zależy od pH roztworu
+ duża pojemność buforowa- wynik amfoteryczności
+ polielektrolity
+ ulegają wysalaniu pod wpływem niedenaturujących je soli silnych kwasów bądź zasad
+ białka chłoną wodę- ulegają pęcznieniu
+ ulegają wsalaniu w obecności małych stężeń soli następuje wzrost ich rozpuszczalności
Katalizator: substancja która przyspiesza reakcje chemiczną ale nie wchodzi w skład produktu jest taka sama przed i po reakcji.
Szybkość reakcji v=k*[s]: szybkość reakcji jest proporcjonalna do stężenia. Skuteczność zderzających się i reagujących ze sobą cząsteczek zależy od energii kinetycznej. Czynniki wpływające na szybkość reakcji: stężenie reagentów- enzymów substratu koenzymów, czas reakcji, temperatura, pH, obecność związków dodatkowych.
Zwiększenie szybkości reakcji: jest możliwe poprzez dostarczenie energii (zwiększenie o 10% powoduje 2-3 krotne zwiększenie szybkości) Temperatury nie możemy zwiększać w nieskończoność co wynika z jej właściwości termoregulacji oraz poprzez obniżenie energii aktywności.
Stała Michaelisa jest to takie stężenie substratów przy którym szybkość reakcji osiąga połowę wartości maksymalnej wartość stałem w granicach od 10-2 do 10-6 mol/l
Równanie Michaela-Menten obrazuje związki pomiędzy parametrami V= Vmax/ KM/[S] +1
Stała efektywności katalitycznej definiuje całość reakcji enzymatycznej Keff= Kkat/KM
Enzymy:
białka katalizujące o masie od kilku do kilku milionów Daltonów, obniżają barierę energetyczną reakcji. Są to katalizatory działające specyficzne i mają określony charakter działania.
Cechy enzymów:
- wybiórczość działania: czym wybitnie różnią się od katalizatorów nieorganicznych, które tego nie posiadają i działają nieswoiście: 1) decyduje o kierunku reakcji- wybiera tylko jeden możliwy typ reakcji termodynamicznej 2) enzym katalizujący reakcje prowadzi ją tak że nie towarzyszą jej żadne uboczne przemiany substratów 3) wykazują specyficzność kierunkową
- specyficzność substratowa: 1) specyficzność absolutna- przemieniają w określonym kierunku tylko jeden substrat o określonej strukturze 2) specyficzność grupowa- enzym specyficzny do substratu o podanej budowie strukturalnej
Mechanizm działania enzymów: 1) enzym tworzy przejściowy kompleks molekularny z substratem. Kompleks enzym-substrat 2) po przyłączeniu cząsteczki substratu na skutek oddziaływań między określonymi grupami zachodzi aktywacja substratu w kompleksie . aktywacja ta dochodzi do stanu tranzycji (przejścia) czyli stanu w którym substrat z enzymem spontanicznie przechodzi w produkt 3) kompleks enzym-substrat przechodzi w kompleks enzym-produkt i uwalnia się cząsteczka produktu E+S<->E S<->ES*EP->E+P
Centra aktywne: W obszarze centrum aktywnego wyróżnia się dwa podobszary I miejsce wiążące (uczestniczy w wiązaniu substratu) II miejsce katalizujące (uczestniczy w samej reakcji). Reszty pomocnicze- nie z centr aktywnych- aminokwasy stabilizujące.
reszty -hydroksy aminokwasów Ser Thr i Tyr może pełnić rolę nukleofila
reszty -SH Cys (reszty tiulowe i wodorosiarczkowi) grupa hydroksylowa Gln i Asn)
reszty -His (pierścień imidazolowy przyłącza się i odbiera proton) reszty Arg i Lys
Aktywatory: -jony metali dwuwartościowych Zn2+ Mg2+ Ca2+ Fe2+ Mn2+ -jony chlorkowe na α-amylazę śliny -aktywatory allosteryczne
Inhibitory: niespecyficzne- jony metali ciężkich oddziałujące z wiązaniami dwusiarczkowymi i grupami tiulowymi, wbudowują się w mostki disulfidowe powodują ich rozpad i zmianę konformacji specyficzne- współzawodniczące mają na tyle podobną budowę do substratu, że mnogą przyłączyć się do centrum aktywnego enzymu, ale nie mogą ulec przemianie w produkt. Jest to inhibicja odwracalna i zależy od proporcji stężeń substratów i inhibitora. Jeżeli przewaga inhibitora łatwiej powstaje kompleks EJ- aby cofnąć powstanie kompleksu EJ należy zwiększyć stężenie enzymu
Inhibicja odwracalna- gdy inhibitor przyłączy się do enzymu przed substratem
Inhibicja nieodwracalna- gdy inhibitor przyłączy się do kompleksu enzym-substrat ponieważ następuje zakleszczenie substratu w enzymie
Katalizatory nieenzymatyczne: rybozymy- kataliczne RNA abzymy- kataliczne przeciwciała (też zbudowane z białek) mikrozymy- kataliczne peptydy najmniejszym jest lipaza.
Klasyfikacja enzymów:
- oksydoreduktazy: enzymy przenoszące elektrony i najcześciej równoważą ilość wodoru z donora na akceptor. Enzymy te potrzebują do działania koenzymów (FAD+ NAD+). Oksydoreduktazy SA to transferazy wodoru np. katalizy peroksydazy dehydrogenaza
- transferazy: przenoszą grupy funkcyjne inne niż atom wodoru przenosząc je z donora na akceptor. Grupy te to np: aldehydowe ketonowe metylowe. Mogą też przenosić grupy arylowe alkilowe aminowe oraz takie które zawierają w swej budowie atom azotu bądź siarki.
- hydrolazy: enzymy katalizujące rozerwanie wiązania estrowego eterowego peptydowego glikozydowego oraz wiązań bezwodników kwasowych.
- ligazy: odłączają od substratów jakieś grupy ale w reakcji innej niż hydroliza np. w reakcji dehydratacji po oderwaniu grupy poowdują powstawanie wiązania podwójnego.
- izomerazy: katalizują wszelkie wewnątrzcząsteczkowe przekształcenia w cząsteczce substratu. Racenazy- zmiana L i D Epimerazy- zmiana położenia podsta Izomerazy cis i trans
- ligazy: katalizują syntezę wiązań C-O (EC 6.1) C-S (EC 6.2) C-C C-N (EC 6.3) każda ta reakcja jest sprzężona z hydrolizą pirofosforanowego wiązania ATP
- 2 -
Wyszukiwarka