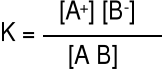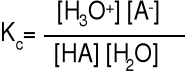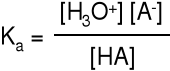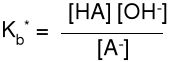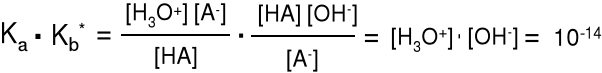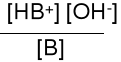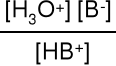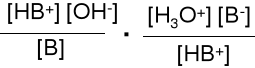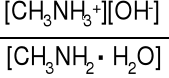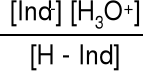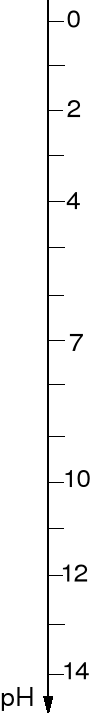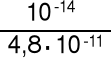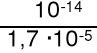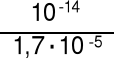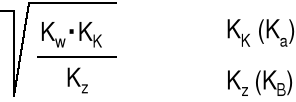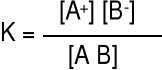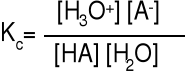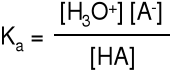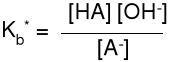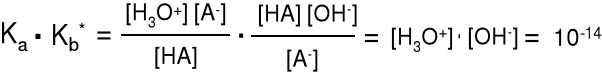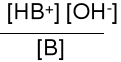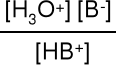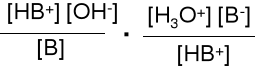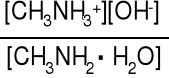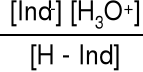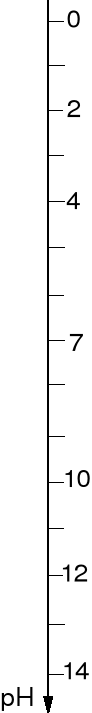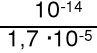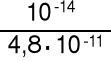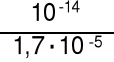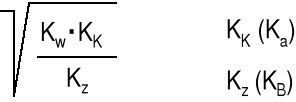Elektrolity. dysocjacja ElektRolityczna
Woda - najbardziej pospolity rozpuszczalnik. Duża stała dielektryczna wody ε = 78,4. Zasada Lewisa, właściwości wody są w dużym stopniu określone przez występowanie silnych wiązań wodorowych.
Elektrolit - substancja, która rozpuszczając się we wodzie, daje roztwór zawierający jony, czyli naładowane poruszające się w roztworze cząstki. Elektrolit w stanie stałym (nie rozpuszczony we wodzie lub nie stopiony) nie przewodzi prądu elektrycznego.
Svante Arrhenius 1887r. Prze-
wodnictwo elektryczne roztwo-
Elektrolity - większość soli, kwasy (HNO3, H2SO4, HCl, CH3COOH), zasady (KOH, Ca(OH)2, NH3.H2O)
Nieelektrolity - glukoza, sacharoza, alkohol, eter, aceton.
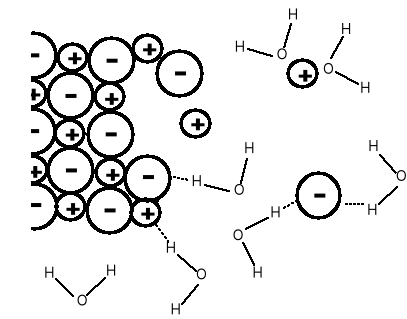
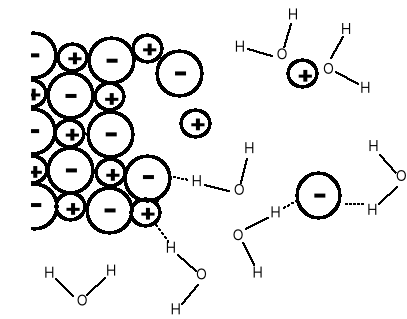
Proces rozpuszczania NaCl -
kryształ jonowy, wiązanie
jonowe, utrzymywany siłami
elektrostatycznymi. Jony są
przyciągane i solwatowane
(hydratowane) przez cząs-
teczki wody.
W roztworze zarówno ujemne aniony Cl- jak i dodatnie kationy otoczo-
ne są przez cząsteczki wody, co znacznie zmniejsza przyciąganie elektrostatyczne między kationami i anionami.
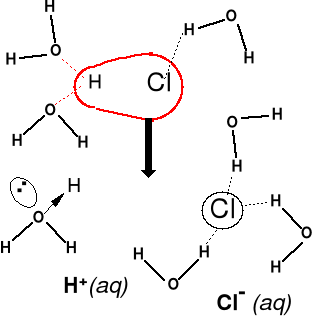
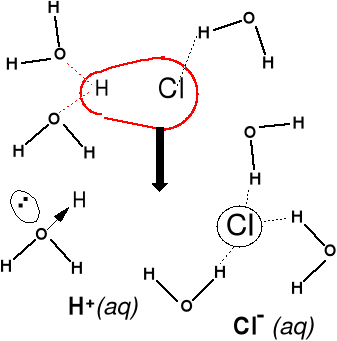
Proces rozpuszczania HCl -
wiązanie H—Cl kowalencyjne
spolaryzowane. Stały i ciekły
HCl nie przewodzi prądu elek-
trycznego, jony powstają dopie-
ro w procesie rozpuszczania
i hydratacji. Roztwór przewodzi
prąd elektryczny.
Proces rozpuszczania glukozy, kryształu molekularnego, utrzymywanego w całości przede wszystkim przez wiązania wodorowe między poszczególnymi cząsteczkami glukozy.
Następuje hydratacja i zastąpienie wiązań wodorowych glukoza - glukoza przez wiązania wodorowe glukoza - woda. Brak jonów, roztwór nie przewodzi prądu elektrycznego.
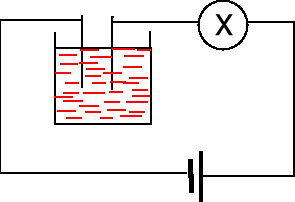
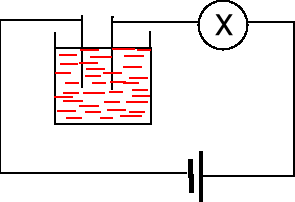
Badanie przewodnictwa soli stałych NaCl i NH4SCN. Sole stałe są izolatorami. Brak możliwości ruchu nośników ładunku czyli jonów.
Badanie przewodnictwa roztworów NaCl i NH4SCN. Roztwory tych soli przewodzą prąd elektryczny.
Badanie przewodnictwa stopionego NH4SCN (tt. 150 oC). Stopiony NH4SCN przewodzi prąd elektryczny.
Badanie przewodnictwa alkoholu metylowego i roztworu alkoholu metylowego we wodzie. Alkohol metylowy CH3OH nie przewodzi prądu elektrycznego. Cukier nie przewodzi prądu elektrycznego.
Badanie przewodnictwa wody destylowanej i wody wodociągowej. Woda destylowana nie przewodzi prądu elektrycznego, woda wodociągowa słabo.
Elektrolity mocne i słabe.
1 M roztwór HCl bardzo dobrze przewodzi prąd elektryczny, 1 M roztwór HF słabo. Stopień dysocjacji α dla 1 M HCl * 1 (100 %), dla 1 M HF α * 0,08 (8 %). Stopień dysocjacji α dla 1 M roztworu może być w pewnym stopniu miarą mocy elektrolitu.
α = c - stężenie molowe zdysocjowanej części elektrolitu
co - całkowite stężenie molowe elektrolitu
Elektrolity mocne. Zbudowane z jonów, α = 100 %.
NaCl - kryształ zbudowany z jonów Na+ i Cl-.
ai - aktywność, efektywne stężenie jonów (i) mocnego elektrolitu
fi - współczynnik aktywności, współczynnik korygujący, ai = ci·fi
log fi = -0,509·zi2 I I - siła jonowa roztworu, I = ½ cz2
Elektrolity słabe. Stopień dysocjacji α niewielki, substancja w roztworze istnieje przede wszystkim w formie niezdysocjowanej.


AB A+ + B-

HF + H2O H3O+ + F- słaby kwas
NH3 + H2O 

NH4+ + OH- słaba zasada
Fe(OH)2 

[Fe(OH)]+ + OH- słaba zasada
Miarą mocy elektrolitu jest stała dysocjacji K, natomiast nie jest α
[A+] = α c0 [B-] = α c0 [AB] = c0 - α c0
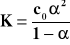
dla α < 0,05 K ≈ c0 α2
Im większe rozcieńczenie tym stopień dysocjacji α większy. Nawet
słabe elektrolity w bardzo rozcieńczonym roztworze są silnie zdysocjonowane (Ostwald).
Badanie przewodnictwa kwasu octowego w funkcji stężenia kwasu
octowego CH3COOH. Kwas lodowaty nie przewodzi prądu. Przy rozcieńczaniu wodą przewodnictwo wzrasta.
Teoria Arrheniusa (nagroda Nobla 1903 r).
Kwas - każda substancja, która dostarcza jony H+ do roztworu.


HA H+ + A-
Zasada - każda substancja, która dostarcza jony OH- do roztworu.


MOH M+ + OH-
Reakcja zobojętnienia kwas + zasada woda + sól


HA + MOH MA + H2O HCl + KOH KCl + H2O


H+ A- + M+ OH- M+ A- + H2O H+(aq) + OH-(aq) H2O(l)
1. Brak wyjaśnienia roli wody w procesie dysocjacji
2. Sole powinny mieć zawsze odczyn obojętny
3. Dlaczego amoniak NH3 jest zasadą


4. Wolny proton H+ jest niezwykle reaktywny, reaguje on z wodą
H2O + H+ H3O+ ΔHotw = -799,3 kJ·mol-1 [H+] = 10-130 M
Teoria Brønsted'a - Lowry'ego (nagroda Nobla 1923 r).
Kwas jest to substancja z której proton może zostać usunięty. Jest to donor protonu. Utrata protonu to deprotonowanie.
Zasada jest to substancja zdolna do oderwania protonu z kwasu i jego zaakceptowania. Jest to akceptor protonu.
Definicje te dotyczą substancji protycznych, nie muszą dotyczyć roztworów wodnych.
Teoria ta dobrze tłumaczy reakcje kwasowo-zasadowe jako polegające na konkurowaniu o proton przez dwie zasady.
Mocny kwas chlorowodorowy (solny) HCl.


HCl(aq) + H2O(l) H3O+(aq) + Cl-(aq) K' - Z' i K”- Z” są to
K' Z” K” Z' sprzężone kwas- zasada
HCl(aq) jest mocniejszym kwasem niż H3O+(aq), a H2O(l) mocniejszą zasadą niż Cl-(aq), dlatego równowaga reakcji ustala się po stronie produktów. H3O+ jest to najsilniejszy kwas w roztworze wodnym.
Mocny kwas ulega we wodzie całkowicie deprotonowaniu z wytworzeniem jonów oksoniowych (hydronowych) H3O+. Innymi słowami, mocny kwas jest całkowicie zjonizowany w roztworach wodnych.
Jon wodorowęglanowy jest słabym kwasem, jon H3O+ jest dość silnym kwasem a jon węglanowy CO32- jest dość silną zasadą, zatem równowaga poniższej reakcji leży po lewej stronie.


HCO3-(aq) + H2O(l) H3O+(aq) + CO32-(aq)
kwas I zasada II sprzężony kwas II sprzężona zasada I
Kwas oddaje proton i przechodzi w sprzężoną zasadę tego kwasu, zasada przyłącza proton i przechodzi w sprzężony kwas tej zasady.

Jon O2- jest mocną zasadą. O2-(aq) + H2O(c) OH-(aq) + OH-(aq)
zasada I kwas II sprzężony sprzężona


NH3 jest słabą zasadą. NH3(aq) + H2O(c) NH4+(aq) + OH-(aq)
zasada I kwas II sprzężony sprzężona


Mocne zasady reagują z wodą całkowicie dając jony wodorotlenkowe (hydroksylowe) OH-. OH- + H2O H2O + OH-
Inaczej, mocna zasada jest we wodzie całkowicie sprotonowana. Słaba zasada jest we wodzie tylko częściowo sprotonowana.
OH- jest to najsilniejsza zasada w roztworze wodnym.
Podaj kwas i zasadę, oraz sprzężony kwas i sprzężoną zasadę.


HCO3-(aq) + H3O+(aq) H2O(c) + H2CO3(aq)

O2- + NH3 OH- + NH2-


NH4+(aq) + H2O(c) NH3(aq) + H3O+(aq)
Wskaż substancję która może być: a) kwasem Brønsted'a b) zasadą Brønsted'a c) kwasem i zasadą Brønsted'a. Podaj odpowiednio sprzężony kwas lub zasadę.
SO32-, HPO42-, NH4+, NH3, Br-, HClO4, H2O, OH-
Badanie przewodnictwa elektrycznego 2M HCl

HCl + H2O Cl- + H3O+
Badanie przewodnictwa elektrycznego 2M CH3COOH


CH3COOH + H2O CH3COO- + H3O+
Zasady. Badanie przewodnictwa elektrycznego 2M NaOH. Silna zasada. Kryształy jonowe [(Na+)(OH-)]n, już są gotowe jony OH-.

NaOH Na+ + OH-
Badanie przewodnictwa elektrycznego 2M wodnego roztworu amoniaku, słaba zasada.


NH3·H2O NH4+ + OH-

Badanie przewodnictwa elektrycznego CH3COONH4 w porównaniu z 2N CH3COOH i z 2N NH3·H2O. Octan amonu bardzo dobrze przewodzi prąd: CH3COONH4 NH4+ + CH3COO-. Dysocjacja soli z reguły 100 %.
Sole. Z reguły silne elektrolity. Ale są wyjątki. np. HgCl2 (sublimat - silna trucizna) i Hg(CN)2. Roztwór sublimatu kiepsko przewodzi prąd, podobnie jak roztwór Hg(CN)2.
Właściwą miarą mocy kwasu jest stała równowagi reakcji dysocjacji.
Ka > 102 kwasy mocne (HClO4, H2SO4, HNO3, HMnO4, HCl, HBr, HI)
102 > Ka > 10-2 kwasy średniej mocy (HSO4-, H2CrO4, H2SO3)
Ka < 10-2 (H3PO4, HF, H2CO3, HCOOH, CH3COOH)
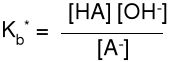
Moc sprzężonej zasady
A- + H2O 
HA + OH- pKb* = -lg Kb*
Im silniejszy kwas, tym słabsza sprzężona z nim zasada.

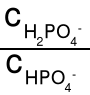
Kwasy H3PO4 + H2O H2PO4- + H3O+ K(H3PO4) = 7,1·10-3

wielo- H2PO4- + H2O HPO42- + H3O+ K(H2PO4-) = 6,3·10-8

protonowe HPO42- + H2O PO43- + H3O+ K(HPO42-) = 4,4·10-13
Właściwą miarą mocy zasady jest stała równowagi reakcji dysocjacji.


B + H2O HB+ + OH- Kb = pKb = -lg Kb


HB+ + H2O H3 O+ + B Ka* =
Kb·Ka* = = [H3O+]·[OH-] = 10-14
Im silniejsza zasada, tym słabszy sprzężony z nią kwas.
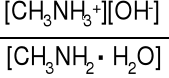
Reakcja dysocjacji zasadowej metyloaminy


CH3NH2·H2O CH3NH3+ + OH- Kb = = 4,4·10-4
Silne zasady 100 % dysocjacja: KOH, NaOH, Ca(OH)2, Ba(OH)2.
Słabe zasady: amoniak NH3, aminy.
ODCZYN ROZTWORU, SKALA pH.
pH = -lg [H3O+] pOH = -lg [OH-]
[H3O+]·[OH-] = 10-14 pH + pOH = 14
Dla czystej wody [H3O+] = [OH-] = 10-7 zatem pH = 7
Są to substancje, które zmieniają barwę gdy zmienia się pH roztworu.
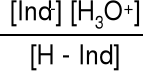
Chemicznie wskaźnik jest to słaby kwas, którego sprzężona zasada ma inną barwę.


H—Ind + H2O H3O+ + Ind- Kind =

Dla barwy przejściowej [H—Ind] = [Ind-] Kind = [H3O+]

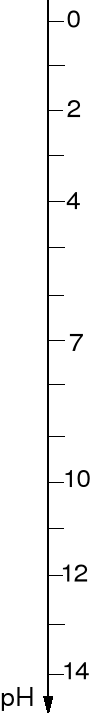
Popularne wskaźniki (indykatory) i zakres pH zmiany barwy

Błękit tymolowy: czerwona (1,2 - 2,8) żółta
Czerwień kongo: niebieska (2,0 - 4,0) czerwona
Oranż metylowy: czerwona (3,1 - 4,4) żółta
Czerwień metylowa: czerwona (4,2 - 6,3) żółta
Błękit bromotym.: żółta (6,0 - 7,6) niebieska
Lakmus czerwona (6,3 - 7,6) niebieska
Fenoloftaleina: bezbarwna (8,3 - 10) czerwona
Żółcień alizaryn.: żółta (10,0 - 12,0) fioletowa
Od czego zależy moc kwasów beztlenowych
Od czego zależy moc kwasów tlenowych XOm(OH)n, najbardziej od m.
Obok wartości pKa - im większe tym kwas słabszy
m = 0 b. Słabe m = 1 słabe m = 2 silne m =3 b. silne
HClO 7,2 HNO2 3,3 HNO3 -1,4 HClO4 -10
H3BO3 9,2 HClO2 2,0 HClO3 -1,0 HMnO4 -6
H4SiO4 10,0 H2CO3 3,9 H2SO4 ~ 0

H6TeO6 8,8 H3AsO4 2,3
Elektroujemność atomu centralnego: HNO3 > HClO3 > HBrO3 > HIO3
Przy rozcieńczaniu tych roztworów pH nie ulega zmianie. Dodatek pewnych ilości kwasu lub zasady tylko minimalnie zmienia pH.
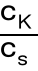
bufor kwaśny np. octanowy - kwas octowy + octan sodu
[H3O+] = Ka
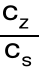
bufor zasadowy np. amoniakalny - amoniak + chlorek amonu
[OH-] = Kb
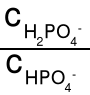
bufor obojętny np. fosforanowy - diwodoroortofosforan (V) sodu i
wodoroortofosforan (V) sodu. [H3O+] = K(H2PO4-)
Do 45 cm3 buforu fosforanowego dodajemy 5 cm3 0,01 M HCl. pH prawie nie ulega zmianie. Przy dodaniu 5 cm3 0,01 M HCl do 45 cm3 czys-
tej wody odczyn jest zdecydowanie kwaśny (oranż metylowy)
Do 45 cm3 buforu fosforanowego dodajemy 5 cm3 0,01 M NaOH. pH prawie nie ulega zmianie. Przy dodaniu 5 cm3 0,01 M NaOH do 45 cm3 czystej wody odczyn jest zdecydowanie zasadowy (fenoloftaleina).
KWASY - GŁÓWNE REAKCJE I OTRZYMYWANIE
Reakcje z metalami - kwasy nieutleniające, wydzielanie wodoru.

Zn + H2SO4 Zn SO4 + H2 Szybka reakcja

Zn + 2 CH3COOH (CH3COO)2Zn + H2 Powolna reakcja
Kwasy utleniające, HNO3 i stężony H2SO4 - wydzielanie tlenków azotu lub SO2. Reakcja nawet z metalami stosunkowo szlachetnymi.
Hg + HNO3 = Hg(NO3)2 + NO + H2O dobierz współczynniki.
Cu + H2SO4 = CuSO4 + H2O + SO2 dobierz współczynniki.
Reakcje z solami słąbszych kwasów - wypieranie tych kwasów z soli.

Na2CO3 + 2 HCl = H2CO3 + 2 NaCl
H2CO3 = CO2 + H2O kwas słaby, nietrwały.

CH3COONa + H2SO4 = NaHSO4 + CH3COOH
FeS + 2HCl = FeCl2 + H2S kwas słaby, lotny.
Reakcje H2SO4 z solami lotnych kwasów, niekoniecznie słabych - wypieranie bardziej lotnych kwasów.


NaCl + H2SO4 = NaHSO4 + HCl NaCl + NaHSO4 = Na2SO4 + HCl

Wypieranie mocniejszych kwasów przez słabsze, siłą napędową takich reakcji jest z reguły tworzenie się nierozpuszczalnych soli.
(CH3COO)2Pb + H2S = PbS + 2CH3COOH
PbS + HNO3 = PbSO4 + NO + H2O dobrać współczynniki reakcji.
Reakcje kwasów z tlenkami metali - tworzą się sole.
PbO + 2HNO3 = Pb(NO3)2 + H2O azotan (V) ołowiu (II)
Reakcje kwasów z wodorotlenkami metali - tworzą się sole.
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O azotan (V) wapnia
Otrzymywanie i nazewnictwo
Tlenki kwasowe - tlenki niemetali i tlenki metali na wysokich stopniach utlenienia.
SO2 + H2O = H2SO3 Tlenek siarki (IV), kwas siarkowy (IV)
Kwas siarkawy, Sole siarczany (IV), siarczyny.
SO3 + H2O = H2SO4 Tlenek siarki (VI) kwas siarkowy (VI)
Kwas siarkowy, Sole siarczany (VI), siarczany
CrO3 + H2O = H2CrO4 Tlenek chromu (VI) kwas chromowy (VI)
Kwas chromowy, Sole chromiany (VI), chromiany
HClO - kw. chlorowy (I), kw. podchlorawy, chlorany (I) podchloryny.
HClO2 - kwas chlorowy (III), kwas chlorawy, chlorany (III) chloryny.
HClO3 - kwas chlorowy (V), kwas chlorowy, chlorany (V), chlorany.
HClO4 - kwas chlorowy (VII), kwas nadchlorowy, chlorany (VII)., nadchlorany, zupełnie poprawna nazwa tetraoksochloran wodoru lub kwas tetraoksochlorowy (VII).
HCl - roztwór we wodzie, kwas chlorowodorowy, kwas solny, chlorek
HCN - kwas cyjanowodorowy, cyjanek
H2Te - kwas tellurowodorowy, tellurek
ZASADY - GŁÓWNE REAKCJE I OTRZYMYWANIE
Zasada - roztwór wodorotlenku we wodzie. pH > 7.
Reakcje z kwasami - otrzymywanie soli.
Ca(OH)2 + 2 HCl = 2 H2O + CaCl2
Reakcje z tlenkami kwasowymi - otrzymywanie soli.
2NaOH + SiO2 = Na2SiO3 + H2O

Wypieranie słabszych zasad z ich soli przez mocniejsze zasady.


NH4Cl + KOH KCl + NH3 + H2O
2 NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2 H2O w fazie stałej

FeCl3 + 3 NH3·H2O = Fe(OH)3 + 3 NH4Cl
Otrzymywanie i nazewnictwo
Tlenki zasadowe + woda BaO + H2O = Ba(OH)2
Metale + woda 2Li + 2 H2O = 2LiOH + H2
Wodorki metali + woda LiH + H2O = LiOH + H2
Fe(OH)2 - wodorotlenek żelaza (II), wodorotlenek żelazawy.
Fe(OH)3 - wodorotlenek żelaza (III), wodorotlenek żelazowy.
CaCl(OH) - chlorek wodorotlenek wapnia
WODOROTLENKI I TLENKI AMFOTERYCZNE
Niektóre wodorotlenki lub (tlenki metali) zachowują się wobec zasad jak kwasy lub (tlenki kwasowe), wobec kwasów natomiast jako wodorotlenki zasadowe (tlenki zasadowe).
Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2.
Al(OH)3 + 3HCl = AlCl3 + 3 H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
2 Al + 6 HCl = 2 AlCl3 + 3 H2
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6 H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Pb(OH)2 + 2 HNO3 = Pb(NO3)2 + 2 H2O
Pb(OH)2 + NaOH = Na[Pb(OH)3]
PbO + 2 HNO3 = Pb(NO3)2 + H2O
PbO + NaOH + H2O = Na[Pb(OH)3]
Napisz reakcję Zn z wodnym roztworami KOH. Powstaje miedzy innymi
K2[Zn(OH)4]. Napisz reakcję SnO z roztworem NaOH. Powstają sole cyniany(II), pochodne anionu [Sn(OH)4]2-.
Im wyższy stopień utlenienia tym wyraźniejsze są właściwości kwasowe tlenków. CrO - tylko właściwości zasadowe, reaguje tylko z kwasami, Cr2O3 - właściwości amfoteryczne, reaguje z kwasami i zasadami, CrO3 - właściwości wyłącznie kwasowe, reaguje tylko z zasadami.
SOLE - OTRZYMYWANIE, NAZEWNICTWO
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
3. Kwas + wodorotlenek metalu
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Mg + S = MgS 2 Na + Cl2 = 2 NaCl
5. Tlenek niemetalu + tlenek metalu
6. Tlenek niemetalu + wodorotlenek metalu
2 NaOH + SiO2 = Na2SiO3 + H2O
CuBr bromek miedzi (I), bromek miedziawy
CuBr2 bromek miedzi (II, bromek miedziowy
Fe(ClO3)3 chloran (V) żelaza (III), chloran żelazowy.
Wodorosole (sole kwaśne) Mn(HpR)m
MgHPO4 - wodoroortofosforan (V) magnezu,
Ca(H2PO4)2 - diwodoroortofosforan (V) wapnia, ( dwuwodoro-)
Ba(HSO4)2 - wodorosiarczan (VI) baru
NaOH + H3PO4 = NaH2PO4 + H2O
2NaOH + H3PO4 = Na2HPO4 + 2H2O
BaSO4 + H2SO4 = Ba(HSO4)2
Hydroksosole (sole zasadowe).
2Mg(OH)2 + H2SO4 = [Mg(OH)]2SO4 + 2 H2O
siarczan (VI) wodorotlenek magnezu
albo siarczan (VI) hydroksomagnezu
[Fe(OH)2]3PO4 - ortofosforan (V) diwodorotlenek żelaza (III) albo
ortofosforan (V) dihydroksożelaza (III)
Reakcja soli z wodą, odwrotna do reakcji zobojętnienia jest reakcją hydrolizy. Reakcja hydrolizy przebiega z reguły w niewielkim stopniu. Ulegają hydrolizie sole:
jako 0,01 M zasadę o Kb* = = 2,1·10-4 KHCO3- = 4,8·10-11
Wszystkie jony metali oprócz jonów litowców i berylowców (bez berylu) oraz kationów metali o ładunku +1 można traktować jak słabe kwasy. Zatem np. 0.01 M Al2(SO4)3 można traktować jako 0,02 M kwas o Ka = 1,14·10-5 (znane są tabele)
Niekiedy reakcje idą dalej, aż do wydzielenia się nierozpuszczalnych soli zasadowych albo nierozpuszczalnych okso soli. Dodatek kwasu (tutaj HCl) cofa hydrolizę.
SbCl3 + H2O SbOCl + 2 HCl chlorek antymonylu
BiCl3 + H2O BiOCl + 2 HCl chlorek bizmutylu
Np. octan amonu CH3COONH4. Błękit bromotymolowy - zielony.
(NH4)2CO3, Błękit bromotymolowy - niebieski ( odczyn zasadowy).
Przeważa silnie zasadowy anion CO32- nad nie tak silnie kwaśnym kationem NH4+.
Sole silnych kwasów i silnych zasad nie ulegają we wodzie hydrolizie.
Odczyn roztworu takich soli jest obojętny. Zbadajmy odczyn Ba(NO3)2 i odczyn AgNO3.
Proszę przerobić ten dział (zadania ) z książki K. M. Pazdro „Zbiór
zadań z chemii dla szkół średnich”