Ekotoksykologia
Ekotoksykologia -wprowadzenie
Termin „ekotoksykologia” został po raz pierwszy powszechnie użyty i przez to wprowadzony do potocznego języka przez Truhauta w 1969r. Wyraz ten został skonstruowany z dwóch słów: „ekologia” i „toksykologia”, a jego wprowadzenie odzwierciedlało rosnące zainteresowanie skutkami obecnych w środowisku związków chemicznych dla organizmów innych niż człowiek. Pozwoliło to na skoncentrowaniu badań na szkodliwych skutkach oddziaływania związków chemicznych (toksykologia) w kontekście ekologicznym. Dotychczas przedmiot toksykologia środowiska zasadniczo dotyczył szkodliwych skutków substancji chemicznych obecnych w środowisku dla człowieka, np. skutki zadymienia obszarów miejskich, toksycznego oddziaływania metali ciężkich itp. Natomiast toksykologia środowiska, w najszerszym tego słowa znaczeniu, obejmuje skutki działania czynników chemicznych zarówno w ekosystemach, jak i u człowieka. Ekotoksykologia jest więc dyscyplina naukową realizowaną w ramach szerszego pola toksykologii środowiska.
Rys.1 Schemat - zależności powiązań między reakcjami zachodzącymi na różnych poziomach organizacji.
. W ujęciu najprostszym ekotoksykologię można zdefiniować jako: „badanie szkodliwych skutków działania związków chemicznych dla ekosystemów”, co rozumieć należy jako bezpośrednie zmiany w organizmach, jak również wynikające z nich konsekwencje na poziomie populacji i wyższym. Interesującą cechą ekotoksykologii jest fakt, że reprezentuje ona podejście badawcze „od cząsteczek do ekosystemów” w myśl podejścia sformułowanego przez Clarke'a (1975) „od genów do fizjologii”. Takie podejście pozwala na ocenę i w konsekwencji całego ekosystemu. Podczas gdy tradycyjna toksykologia zajmuje się toksycznością związków chemicznych wobec poszczególnych organizmów, ekotoksykolodzy są szczególnie zainteresowani skutkami oddziaływań na różnych poziomach organizacji
Skutkami na poziomie populacji mogą być zmiany w liczebności osobników, zmiany częstości występowania określonego genu (zjawisko oporności) lub tez zmiany w funkcjonowaniu całego ekosystemu (obieg pierwiastków w glebie). Opisane powyżej zmiany mogą być w większym stopniu rezultatem oddziaływań subletalnych (np. zmiany fizjologiczne lub behawioralne), niż toksyczności letalnej. Czasami zmiany takie mogą być również skutkiem pośrednim , jak w przypadku zmniejszenia liczby drapieżników spowodowane bezpośrednim oddziaływaniem substancji toksycznej na jego ofiary.
Głównym zadaniem toksykologii i ekotoksykologii jest określenie zależności pomiędzy ilością związku chemicznego, na działanie którego organizm jest narażony, a rodzajem i stopniem szkodliwych, toksycznych następstwem będących wynikiem tej ekspozycji. Zależność pomiędzy dawką a odpowiedzią organizmu daje podstawę do oceny zagrożeń (hazards) i ryzyka (risk) powodowanego przez substancje zanieczyszczające środowisko. W myśl słów Paracelsusa: „Dawka czyni truciznę”, żaden związek chemiczny nie jest trucizną, jeśli dawka jest zbyt mała, natomiast wszystkie związki chemiczne są trujące, jeżeli dawka jest wystarczająco duża.
Testy ekotoksykologiczne
Początki laboratoryjnych testów toksyczności sięgają czasów przed II wojną światową, kiedy badania prowadzono tzw. metodą "ryba w słoiku". Obecnie opracowanych jest wiele testów toksykologicznych z udziałem wielu gatunków, od roślin poprzez bezkręgowce do drapieżników kończących łańcuch pokarmowy. Ze względów praktycznych możliwe jest przeprowadzenie testów toksyczności tylko na ograniczonej liczbie gatunków, można również prowadzić stałą hodowlę organizmów testowych (bioindykatorów), co oczywiście pociąga za sobą odpowiednie koszty inwestycyjne i eksploatacyjne. Dlatego też obecnie coraz częściej przeprowadza się gotowe testy zawierające bioindykatory w formie kryptobiotycznej ze standardowej hodowli.
Kryteria przydatności testów toksykologicznych:
Wynik testu powinien dawać odpowiedź na pytanie z zakresu oceny ryzyka ekologicznego.
Powinna istnieć możliwość ekstrapolacji wyników na inne organizmy testowe i całe ekosystemy;
Test powinien być dobrany z uwzględnieniem „wrażliwość” organizmów testowych.
Test powinien być prosty w wykonaniu i powinna istnieć możliwość standaryzacji uzyskanych wyników.
Wyniki testu powinny być jednoznaczne i powtarzalne.
Istnieje wiele sposobów jakimi można dokonać pomiaru toksyczności. Jednym z kryteriów podziału testów toksykologicznych jest mierzalny efekt końcowy, którym mogą być zarówno obserwowalne zmiany biochemiczne, fizjologiczne, wpływ na rozmażanie czy zachowanie organizmów testowych. Najczęściej stosowaną miarą (mierzalnym efektem końcowym „end-point”) jest śmierć organizmu testowego.
Podział testów z uwagi na obserwowalny efekt:
TESTY PRZEŻYWALNOŚCI polegające na oznaczaniu dawki śmiertelnej z zastosowaniem wybranych organizmów (głównie organizmów wodnych).
TESTY WZROSTOWE dotyczące oceny hamowania wzrostu bakterii, grzybów lub glonów w obecności związków toksycznych.
TESTY ENZYMATYCZNE polegające na określeniu stopnia hamowania aktywności jednego enzymu lub grupy enzymów katalizujących określoną reakcję enzymatyczną.
TESTY GENOTOKSYCZNOŚCI (mutagenności).
TESTY BIOAKUMULACJI polegające na ocenie stopnia nagromadzenie substancji chemicznej w tkankach i narządach organizmów.
Podział badań ekotoksykologicznych
W zależności od miejsca wykonania:
laboratoryjne;
polowe;
pół-polowe;
W zależności od czasu trwania:
krótkoterminowe (ostre)- Badające szkodliwe zmiany w organizmach testowych wywołane oddziaływaniem związku chemicznego w krótkim czasie ekspozycji do 96h, które mogą prowadzić do zaburzeń czynności fizjologicznych i śmierci. Najczęściej jako wynik oznaczenia podaje się wartość LC(EC)50.
długoterminowe (chroniczne)- Badające szkodliwe zmiany w organizmach testowych wywołane oddziaływaniem związku chemicznego w dłuższym czasie - na ogół od 1/10 cyklu życiowego do uzyskania pierwszego pokolenia potomstwa. W testach stosowane są niższe niż śmiertelne stężenia substancji (subletalnej). Obserwacje polegają na ocenie zmian aktywności fizjologicznej np. pokarmowej, rozrodczej, zaburzeń genetycznych i zakłóceń
w funkcjonowaniu narządów. Jako wynik oznaczenia podaje się wartość NOEC, LOEC.
W zależności od liczby gatunków:
jednogatunkowe;
wielogatunkowe;
Wartość średnia
Odchylenie standardowe
Test t-Dunnetta
Średnią wartość inhibicji luminescencji dla danego stężenia
Odchylenie standardowe wartości średniej
Procentowy efekt inhibicji luminescencji
Metoda logarytmiczno - probitową wyznacz wartość IC50 (wartość odczytaj z równania prostej, podaj współczynnik korelacji Pearsona R)
Określ istotność różnic toksyczności związków 1,2 i 3
Walker C.H., Hopkin S.P., Sibly R.M., Peakall D.B.: Podstawy ekotoksykologii. Wydawnictwo Naukowe PWN, Warszawa 2002.
Wyniki testów ekotoksykologicznych
Oceną zależności pomiędzy dawką, a efektem wywołanym działaniem badanego ksenobiotyku zajmuje się toksykometria. Jeżeli jest to możliwe, reakcję organizmu na podaną toksynę określa się ilościowo, na podstawie przeprowadzonych badań. Zależność efektu od dawki może być wówczas przedstawiona za pomocą równania matematycznego: f(D) = aD + b , a wykres zależności przyjmuje wówczas postać liniową.
|
|
Najczęściej jednak reakcje organizmu na działanie ksenobiotyku można opisywać wyłącznie jakościowo. Oznacza to, że obserwuje się wystąpienie reakcji/lub całkowity brak reakcji, bez stanów pośrednich. Tego typu efekty (np. śmierć, unieruchomienie, itp.) nazywa się jednostkowymi lub kwantalnymi. Natężenie reakcji kwantalnej bada się nie u jednego osobnika, ale wśród pewnej populacji zwierząt i wyraża się w procentach osobników populacji, u których zaobserwowano efekt działania określonej dawki toksyny. Natężenie to wyraża zależność „dawka - odpowiedź”, która przyjmuje postać krzywej sigmoidalnej. |
|
Testy toksykologiczne pozwalają na szacowanie wielkość dawki (ewentualnie stężenia w pokarmie, wodzie czy powietrzu), które może wywołać odpowiedź toksyczną na poziomie np. 50%, tj. medianie dawki letalnej, czyli takiej, która spowoduje śmierć 50% populacji. Popularne jest także szacowanie największego stężenia/dawki, które nie wywołuje żadnego efektu.
Wskaźniki ekotoksykologiczne:
LC50 (LD50)- (ang. lethal concentration, lethal dose) - mediana stężenia śmiertelnego. Wartość LC50 oznacza takie stężenie związku, które powoduje śmierć połowy populacji gatunku organizmów testowych po odpowiednim czasie ekspozycji;
EC50(ED50)- (ang. effect concentration, effect dose) -Wartość EC50 oznacza takie stężenie związku, które powoduje określony efekt (spadek aktywności, reprodukcji itp.) u połowy populacji gatunku organizmów testowych, po odpowiednim czasie ekspozycji;
NOEC (NOED) - (ang. no observed effect concentration (dose)) - najwyższe stężenie (dawka) toksykanta, które w określonym czasie trwania badań nie powoduje żadnych spostrzegalnych zmian w organizmach testowych.
LOEC (LOED) - (ang. lowest observed effect concentration) - najniższe stężenie toksykanta, które w określonym czasie trwania badań toksyczności chronicznej lub subchronicznej wywołuje zmiany w organizmach testowych
Wyznaczanie wartości wskaźników ekotoksykologicznych
Tabela 1 Zamiana efektu toksycznego [%] na jednostkę probitową
% |
PROBITY |
% |
PROBITY |
% |
PROBITY |
% |
PROBITY |
0,2 |
2,122 |
21 |
4,194 |
51 |
5,025 |
82 |
5,915 |
0,4 |
2,348 |
22 |
4,228 |
52 |
5,050 |
83 |
5,954 |
0,6 |
2,488 |
23 |
4,261 |
53 |
5,075 |
84 |
5,994 |
0,8 |
2,591 |
24 |
4,294 |
54 |
5,100 |
85 |
6,036 |
1,0 |
2,574 |
25 |
4,326 |
55 |
5,126 |
86 |
6,080 |
1,2 |
2,743 |
26 |
4,357 |
56 |
5,151 |
87 |
6,126 |
1,4 |
2,803 |
27 |
4,387 |
57 |
5,176 |
88 |
6,175 |
1,6 |
2,856 |
28 |
4,417 |
58 |
5,202 |
89 |
6,227 |
1,8 |
2,903 |
29 |
4,447 |
59 |
5,228 |
90 |
6,282 |
2,0 |
2,946 |
30 |
4,476 |
60 |
5,235 |
91 |
6,341 |
2,5 |
3,040 |
31 |
4,504 |
61 |
5,278 |
92 |
6,405 |
3,0 |
3,123 |
32 |
4,532 |
62 |
5,305 |
93 |
6,476 |
3,5 |
3,188 |
33 |
4,560 |
63 |
5,332 |
94 |
6,555 |
4,0 |
3,249 |
34 |
4,588 |
64 |
5,358 |
95 |
6,645 |
4,5 |
3,305 |
35 |
4,615 |
65 |
5,385 |
95,5 |
6,695 |
5,0 |
3,355 |
36 |
4,642 |
66 |
5,412 |
96 |
6,751 |
6,0 |
3,445 |
37 |
4,668 |
67 |
5,440 |
96,5 |
6,812 |
7,0 |
3,524 |
38 |
4,695 |
68 |
5,468 |
97 |
6,881 |
8,0 |
3,595 |
39 |
4,722 |
69 |
5,496 |
97,5 |
6,960 |
9,0 |
3,659 |
40 |
4,747 |
70 |
5,524 |
98 |
7,054 |
10 |
3,718 |
41 |
4,772 |
71 |
5,553 |
98,2 |
7,096 |
11 |
3,773 |
42 |
4,798 |
72 |
5,583 |
98,4 |
7,144 |
12 |
3,825 |
43 |
4,824 |
73 |
5,613 |
98,6 |
7,197 |
13 |
3,874 |
44 |
4,849 |
74 |
5,643 |
98,8 |
7,257 |
14 |
3,920 |
45 |
4,874 |
75 |
5,674 |
99 |
7,326 |
15 |
3,964 |
46 |
4,900 |
76 |
5,706 |
99,2 |
7,409 |
16 |
4,006 |
47 |
4,925 |
77 |
5,739 |
99,4 |
7,512 |
17 |
4,046 |
48 |
4,950 |
78 |
5,772 |
99,6 |
7,652 |
18 |
4,085 |
49 |
4,975 |
79 |
5,806 |
99,8 |
7,878 |
19 |
4,122 |
50 |
5,000 |
80 |
5,842 |
|
|
20 |
4,158 |
|
|
81 |
5,878 |
|
|
Analiza statystyczna
Wartość średnią z pomiarów wyznaczyć korzystając ze wzoru:
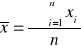
(8)
gdzie:
xi- wynik i-tego pomiaru, i=1,2,...,n,
n- liczebność próby.
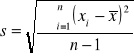
(9)
gdzie:
xi- wynik i-tego pomiaru, i=1,2,...,n,
n- liczebność próby,
![]()
- wartość średnia.
Procedura doboru testu istotności różnic pomiędzy średnimi
Statystykę t-Dunnetta obliczyć w oparciu o następujące wzory :
![]()
(10)
![]()
(11)
![]()
(12)
Istotna różnica ![]()
(13)
gdzie:
v- stopnie swobody,
T- liczba kombinacji,
N- liczba pomiarów w każdej kombinacji,
![]()
suma kwadratów pomiarów,
![]()
liczba pomiarów w każdym powtórzeniu ![]()
suma kwadratów ze średniej,
t- wartość wzięta z tablic Dunnetta (zał.1),
SE- błąd standardowy.
Przykład:
Toksyczność 3 związków chemicznych badano testem inhibicji luminescencji Microtox. Ekspozycja mikroorganizmów trwała 15 min. Po tym czasie mierzono intensywność luminescencji bakterii. Wyniki pomiarów przedstawiają tabele 1-3
Tabela 1. Związek 1
Sample |
Conc mg/l |
It |
Control |
0.000 |
84,93 # |
Control |
0.000 |
89,85 # |
Control |
0.000 |
89,47 # |
1 |
6.50 |
77,09 |
2 |
6.50 |
76,64 |
3 |
6.50 |
77,91 |
4 |
12.00 |
64,70 |
5 |
12.00 |
63,39 |
6 |
12.00 |
65,57 |
7 |
25.00 |
41,81 |
8 |
25.00 |
43,72 |
9 |
25.00 |
45,24 |
10 |
50.0 |
10,41 |
11 |
50.0 |
13,07 |
12 |
50.0 |
8,61 |
Tabela 2. Związek 2
Sample |
Conc mg/l |
It |
Control |
0.000 |
93,90 # |
Control |
0.000 |
91,93 # |
Control |
0.000 |
100,02 # |
1 |
3.75 |
98,41 |
2 |
3.75 |
91,13 |
3 |
3.75 |
89,41 |
4 |
6.50 |
70,37 |
5 |
6.50 |
68,40 |
6 |
6.50 |
69,75 |
7 |
12.00 |
53,75 |
8 |
12.00 |
55,59 |
9 |
12.00 |
55,29 |
10 |
25.0 |
40,66 |
11 |
25.0 |
39,28 |
12 |
25.0 |
39,15 |
Tabela 3. Związek 3
Sample |
Conc mg/l |
It |
Control |
0.000 |
92,05 # |
Control |
0.000 |
91,80 # |
Control |
0.000 |
91,90 # |
1 |
12.00 |
68,51 |
2 |
12.00 |
66,31 |
3 |
12.00 |
64,14 |
4 |
25.00 |
56,96 |
5 |
25.00 |
58,41 |
6 |
25.00 |
64,28 |
7 |
50.00 |
46,37 |
8 |
50.00 |
43,26 |
9 |
50.00 |
40,97 |
10 |
100.0 |
30,77 |
11 |
100.0 |
27,40 |
12 |
100.0 |
28,02 |
Dla podanych wartości oblicz:
Literatura:
Strona | 9
Zmiany fizjologiczne
Zmiany w populacji
ekosystem
Skład gatunkowy zbiorowiska
Substancja skażająca
Reakcje na poziomie organizmu
Zmiany biochemiczne
Wydłużający się czas wystąpienie reakcji
Wzrastająca trudność przypisania reakcji działaniu konkretnych substancji
Wzrastające znaczenie reakcji
Dawka ksenobiotyku [mg/kg]
Efekt
LC50
LOEL
NOEL
logarytm stężenia
Śmiertelność (%)
100
50
PROBITY
Logarytm stężenia
Wykres logarytmiczno-probitowy
Wykres zależności efektu toksycznego od stężenia
stężenie
Wyszukiwarka