AMINY
Amoniak amina I-rzedowa amina II-rzedowa amina III-rzedowa
Dobrze rozpuszczają się w wodze. Aminy z wyższymi grupami alifatycznymi są ciekłe lub stałe i ze wzrostem długości łańcuchów węglowych coraz gorzej rozpuszczają się w wodzie.
Maja odczyn zasadowy (zielony lub niebieski kolor na papierku uniwersalnym).
Dysocjacja amin:
R-NH2 + H2O -> RNH3OH <--> RNH3(+) + OH(-)
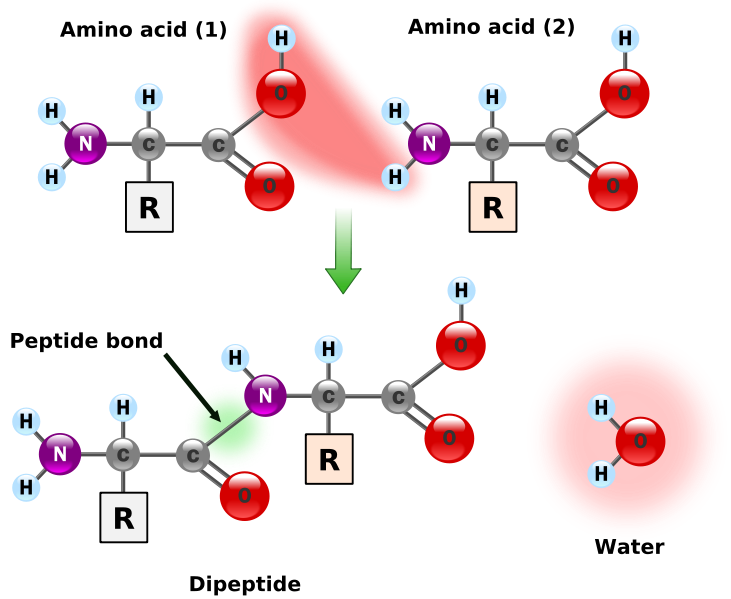
Najważniejszą reakcją amin jest reakcja z kwasami karboksylowymi prowadząca do powstania wiązań peptydowych.Ważne są też możliwości reakcji amin z chlorkami, bromkami i jodkami metali, prowadzące do powstawania trwałych kompleksów tych metali:2 R-NH2 + FeCl2 --> R-NH-Fe-NH-R + 2 HCL
AMINOKWASY
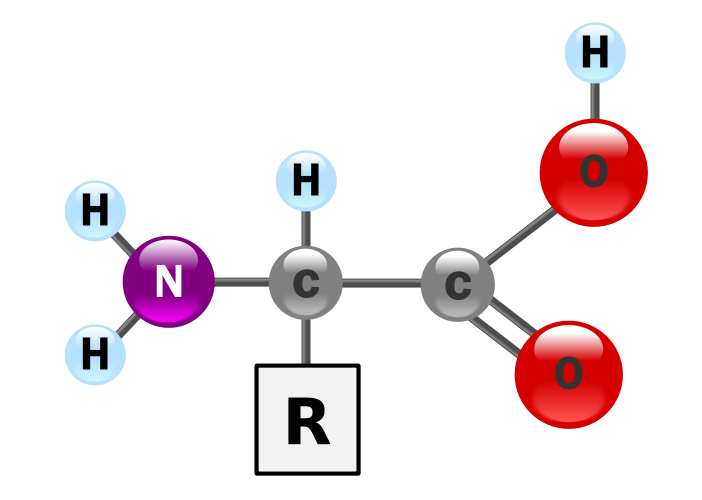
Schemat budowy aminokwasu
grupa aminowa po lewej i karboksylowa po
prawej
Ze względu na liczbę grup aminowych i karboksylowych wyróżnia się aminokwasy:
- obojętne - gdy jest tyle samo (zwykle po jednej) grup aminowych i karboksylowych
- kwasowe - gdy przeważa liczba grup karboksylowych
- zasadowe - gdy przeważa liczba grup aminowych
Aminokwasy - to organiczne związki chemiczne, zawierające grupę aminową -NH2 (zasadową) oraz grupę karboksylową -COOH (kwasową) lub - w ujęciu ogólniejszym - dowolną grupę kwasową, np. sulfonową.
Aminokwasy są amfoteryczne tzn. reagują z kwasami i zasadami.
BIAŁKA
Białka składają się z kilkuset reszt kwasowych połączonych wiązaniami peptydowymi. Charakteryzuje się je podając ich struktury I II III IV rzędowe.
I rzędowa określa kolejność reszt aminokwasów w łańcuchu białkowym. Jest to struktura stosunkowo trwała.
II rzędowa wskazuje jaki układ przestrzenny stabilizowany za pomocą wiązań wodorowych tworzą różne fragmenty tego samego łańcucha, lub różne łańcuchy polipeptydowe. Rozróżnia się 2 struktury II rzędowe
-Alfa linii śrubowej tzw. HELISA
-Beta pofałdowanej kartki
III rzędowa wskazuje sposób ułożenia poszcz. fragmentów łańcucha polipeptydowego względem siebie w przestrzeni. Struktura ta odnosi się do kształtu przestrzennego całej cząsteczki białka. Związana jest z różnego typu oddziaływaniami bocznych grup aminokwasów, z których najważniejsze są mostki disiarczkowe tworzące się między dwoma resztami cysteiny.
IV rzędowa dotyczy białek zbudowanych z 2 lub więcej łańcuchów peptydowych połączonych za pomocą różnego typu wiązań i oddziaływań. Jest znana dla bardzo małej liczby białek. (białko hemoglobiny krwi z 4 łańcuchów polipeptydowych)
Wysalanie - odwracalny proces ścinania białka, nie naruszający jego struktury przestrzennej. Zachodzi pod wpływem soli metali lekkich i soli aminokwasowych NACl, KNO3, NH4Cl
Denaturacja - nie odwracalny proces ścinania białka. Zdenaturyzowane białko ma zniszczoną strukturę II III IV rz. traci swoje czynności biologiczne. (alkohol -temperatura -stężone kwasy zasadowe -sole metali ciężkich)
Reakcja Biuretowa - z wodorotlenkiem miedzi II Cu(OH)2 na zimno wykrywanie wiązania peptydowego zabarwia się na różowo fioletowy kolor.
Ksantoproteinowa - stężony kwas HNO3 Powoduje żółte zabarwianie się białek. W reakcji tej zachodzi nitrowanie pierścieni aromatycznych zawartych w łańcuchach bocznych niektórych aminokwasów białkowych, np Tyrozyny.
Wyszukiwarka