Enzym - biokatalizator, białko o zdolnościach katalizatora.
Katalizator - substancja, która zwiększa szybkość reakcji lecz sama nie ulega przemianom. Budowa i właściwości katalizatora po reakcji są takie same jak przed reakcją.
Aby umożliwić zajście reakcji możliwe są dwie strategie:
Dostarczenie określonej ilości energii, aby cząsteczki substratu ponieść z ich podstawowego poziomu energetycznego na poziom odpowiadający barierze energetycznej co uzyskujemy przez ogrzanie mieszaniny reagującej
Użyć katalizatora, który obniży energie aktywacji do poziomu umożliwiającego rozpoczęcie reakcji w danej temperaturze
Energia aktywacji - najmniejsza ilość energii, którą trzeba dostarczyć 1 molowi substratu, aby stal się reaktywny
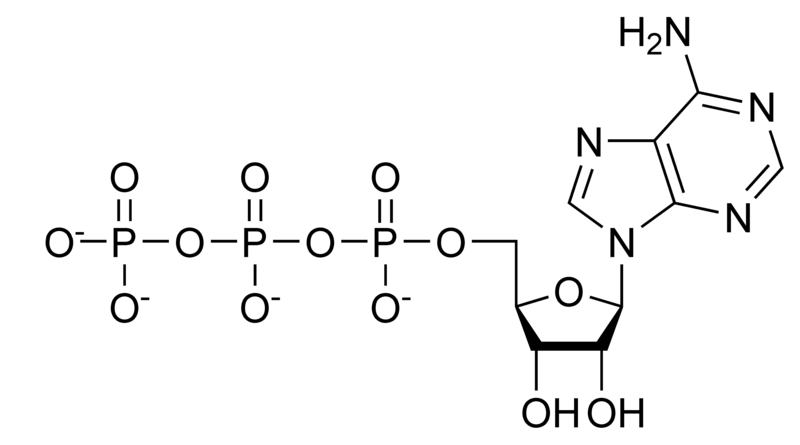
ATP (adenozynotrójfosforan) - jest uniwersalnym akumulatorem i przenośnikiem energii. Jeden z wielu w organizmie związków, z którego czerpie on energię do życia i jego przejawów. Wszystkie procesy energetyczne służą, w końcowym rozrachunku, do tworzenia ATP lub jego redukcji. Związek ten nie jest magazynowany, tylko tworzony na bieżąco. (źródło: http://pl.wikipedia.org/wiki/ATP)
|
Połowiczny czas reakcji I rzędu w temperaturze 270C
|
62,7
|
|
|
Przyspieszenie reakcji 20 mln x
|
Wszystkie enzymy są białkami i są syntetyzowane przez żywe organizmy. Struktury białek:
Pierwszorzędowa: wiązania kowalentne. Sekwencja aminokwasów w łańcuchu polipeptydu
Drugorzędowa: łańcuch polipeptydu o strukturze helisy
Trzeciorzędowa: przestrzenne, trójwymiarowe pofałdowanie polipeptydu - kłębuszek
Czwartorzędowa: przestrzenne połączenie podjednostek - kilka podjednostek połączonych w makrocząsteczkę
Struktury III- i IV- rzędowe są aktywne enzymatycznie. W cząsteczce tworzy się centrum aktywne, tj. miejsce przyłączenia substratu.
W skład enzymu wchodzi cząsteczka białka, ale może nią być związany kofaktor, tj. część niebiałkowa.
Kofaktorami mogą być niskocząsteczkowe związki organiczne lub jony metali. Są one obecne w centrum aktywnym enzymu. Wyróżnia się trzy typy kofaktorów:
Koenzymy - związki organiczne luźno związane z białkiem - enzymem (zwykle witaminy)
Grupy prostetyczne - ściśle związane z białkiem
Kofaktory = zwykle jony metalowe
HOLOENZYM = APOENZYM + KOFAKTOR
Apoenzym i kofaktor współdziałają ze sobą w katalizie reakcji chemicznych. Ten sam kofaktor (koenzym) może wchodzić w skład wielu różnych enzymów i może katalizować odmienne reakcje chemiczne. Może być jednak tak, że obecność danego koenzymu wiąże się tylko z katalizą jednego rodzaju reakcji - swoistość enzymu.
Do odpadów zanieczyszczających środowisko - enzymy o szerokim spektrum działania
Do leczenia chorób - enzym wyspecjalizowany
Enzymy wykazują specyficzność:
Wobec jednej reakcji chemicznej
Zasada zamka i klucza - przestrzenne dopasowanie
Enzymy pozakomórkowe posiadają szeroka specyficzność np. enzymy trawienne.
Reakcja enzymatyczna wymaga fizycznego połączenia się substratów z centrum aktywnym enzymu.
SUBSTRAT + ENZYM = KOMPLEKS E-S <─> ENZYM + PRODUKT
Rys. 1 Komplementarne wiązania chemiczne
Szybka dyfuzja pozwala spotkać się enzymowi z substratem.
Typowy enzym może związać się z substratem i go „obrobić” z szybkością 1000 x na sekundę!!
Dlaczego? Ponieważ ruch na poziomie cząsteczkowym jest niezmiernie szybki.
Dyfuzja = „chaotyczny ruch” - działa dobrze tylko na krótkich dystansach
Liczba obrotów - górna granica aktywności
W większości przypadków szlak przemian obejmuje wiele etapów. Po drodze powstają produkty pośrednie, aż w końcu tworzony jest produkt końcowy. W reakcji bierze udział wiele enzymów.
In viva - w organizmie żywym
In vitro - w laboratorium
Inhibicja kompetecyjna (współzawodnicza), substrat i inhibitor współzawodniczą o dostęp do centrum aktywnego. Budowa inhibitora jest bardzo podobna do substratu. Zwiększając stężenie cząsteczek substratu zwiększamy jego szanse na kontakt z centrum aktywnym.
Inhibicja niewspółzawodnicza - inhibitor wiązany jest przez enzym w innym miejscu, poza centrum aktywnym. Dochodzi wówczas do odkształcenia allosterycznego cząsteczki enzymu. Oznacza to, że centrum aktywne traci swój układ konformacyjny i tym samym przestaje być aktywne. Także substrat nie może się związać z aktywnym centrum. Zwiększenie stężenia substratu nic nie daje, gdyż nie zwiększa się szansa na jego przyłączenie.
Hamowanie przez substrat i przez produkt - przy zwiększonym stężeniu substratu nie następuje zwiększenie szybkości reakcji, gdyż prawdopodobnie cząsteczki substratu przyłączone do centrum nakładają się na siebie co utrudnia reakcję - duże stężenie produktu faworyzuje z kolei reakcję w odwrotnym kierunku - enzymy, które służyły rozwalaniu substancji (depolimerazy), będą mogły je teraz syntezować (syntazy)
Sposoby wyrażania aktywności enzymów
Aktywność enzymu - szybkość katalizowanej reakcji
Szybkość reakcji może być mierzona przez pomiar zmian stężenia substratu lub produktu w czasie reakcji
Międzynarodowa Jednostką Aktywności Enzymatycznej (IU) jest taka ilość enzymu, która powoduje przekształcenie 1 mikromola substratu w ciągu 1 minuty w optymalnych warunkach reakcji przy stężeniu substratu gwarantującego pełne wysycenie enzymu 1J (ang. U) = μM/min
Jednostki aktywności przelicza się na 1 mL lub 1 g badanej próbki, która zawiera enzym.
Czynniki wpływające na aktywność enzymów:
Stężenie substratu i stopień jego rozpuszczalności
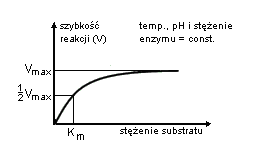
Km - takie stężenie substratu przy którym szybkość reakcji osiąga połowę maksymalnej wielkości (im mniejsza Km tym szybsza reakcja)
Rys. 2 Wykres zależności szybkości reakcji od stężenia substratu - krzywa Michealisa.
Rozpuszczalność - wszystkie enzymy są rozpuszczalne. Gdy substrat jest nierozpuszczalny to reakcja zachodzi gorzej niż gdyby był rozpuszczalny.
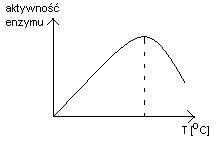
Temperatura reakcji
Każdy enzym ma swoją temperaturę minimalną i maksymalną, które wytyczają temperaturowy zakres działania enzymu. Najważniejsza jest znajomość temperatury optymalnej (wraz z zakresem działania jest podawana przez producenta).
Enzymy działają zwykle w wąskim zakresie pH.
pH optimum - pH przy którym stwierdza się najwyższą szybkość reakcji.
Siła jonowa roztworu - zasolenie (bo w solach są silne wiązania jonowe)
Obecność inhibitorów i czynników denaturujących
Obecność kofaktorów/koenzymów i aktywatorów
Hamujący efekt obecności produktów reakcji
Enzymy pozyskuje się przez ekstrakcję i odfiltrowanie z organizmów zwierzęcych i roślinnych.
Enzymy pochodzenia mikrobiologicznego:
Grzyby (drożdże, pleśnie)
Chodzi o naprawdę wyrafinowane szczepy o niezwykłych uzdolnieniach. Potem je modyfikujemy.
Rozdrobniona masa roślinna
Rozdrobnione tkanki zwierzęce (trzustka, soki żołądkowe, wątroba)
Bioreaktor - sporządzamy pożywkę hodowlaną, która musi być bardzo sterylna. Zapewniamy to przez ogrzewanie mieszaniny w reaktorze w temperaturze 1210C przez 15 minut. Następnie chłodzimy, dodajemy mikroby. Proces może zachodzić tlenowo (pleśnie) lub beztlenowo. Musi być określone pH, T, stymulatory wzrostu. Staruje hodowla. Jest mieszanie. Mikroby rosną i zachodzi reakcja. Powstaje produkt - związek chemiczny, który może zakumulować się w komórce, bądź wydzielić na zewnątrz. Jeśli jest w komórce to musimy go wyodrębnić, a nie jest to takie proste, ponieważ trzeba się przebić przez ścianę komórkową. Nawet jeśli nam się uda, to w komórce jest mnóstwo związków, a nam chodzi tylko o jeden. Stosujemy różne metody separacji.
Produkcja preparatów nieczyszczonych
Surowiec: masa roślinna; materiały zwierzęce; podłoże przerośnięte mikroorganizmami; ciecz pohodowlana
Wymieszanie z nośnikiem (nie będzie się sklejało, lepiej się suszy)
Rozdrobnienie i dobre wymieszanie
Gotowy, suchy, sproszkowany preparat
Preparaty ciekłe niezagęszczone
Materiał roślinny Hodowla wgłębna
Materiał zwierzęcy
Ekstrakcja ciało stale/ciecz
Separacja zawiesin (koagulacja, filtrowanie, wirowanie, ew. sedymentacja)
Roztwór enzymów (musimy błyskawicznie zużyć, bo inaczej sfermentuje)
Preparaty ciekłe zagęszczone
Wyparka próżniowa ultrafiltracja, odwrócona osmoza

Chłodzenie
Chromatografia jonowymienna
Chromatografia powinowactwa
Oczyszczony koncentrat enzymów
Preparaty suche
Oczyszczony koncentrat enzymów
Suszenie rozpyłowe lub fluidalne lub sublimacyjne
(zamrażamy i dajemy tylko tyle ciepła, żeby lód odparował)
Standaryzacja - jakość musi być stabilna, jednakowa
Stabilizacja - trwałość (dodawanie konserwantów, antyoksydantów)
Chromatografia jonowymienna - wykorzystanie ładunku białka do jego selektywnej separacji (siły elektrostatyczne)
Chromatografia powinowactwa - przyłączenia białka do matrycy za pomocą specyficznych ligandów: analog substratu lub produktu, przeciwciało, analog inhibitora, kofaktor/koenzym
Specyficzne białka są eluowane przez dodatek reagentu, który współzawodniczy o połączenie do ligandu
Na bazie rozmiarów cząsteczki
Do separacji wykorzystuje się porowate matryce. Małe cząsteczki penetrują do wnętrza matrycy i przez to droga ich wypływu jest dłuższa i później opuszczają kolumną
Duże cząsteczki wypływają szybciej
Elektroforeza - mamy płytkę, na która nanosimy żel i przykładamy prąd. Przykładamy grzebień, żeby w żelu było rowki. Do rowków nakładamy substancje. Włączamy prąd i powstaje pole, wytwarzają się bieguny i substancje się przesuwają - jedna dalej, drugie bliżej
Roztwór enzymów Wytrącanie acetonem lub alkoholem 

Wypalanie (NH4)2SO4
Oczyszczony koncentrat enzymów
Biotechnologia - Enzymy 7/7