Wstęp teoretyczny
W procesach chemicznych często wykorzystuje się reaktory z wypełnieniem. Mogą być to dowolne cząsteczki o małych rozmiarach, np. immobilizowane enzymy. Zadaniem upakowanego złoża jest poprawienie kontaktu między dwoma substancjami znajdującymi się w reaktorze. Reaktory te są rurowe i wypełnione stałymi cząsteczkami katalizatora - najczęściej są używane w celu przyśpieszania reakcji gazowych. Reakcja chemiczna zachodzi na powierzchni katalizatora.
Zaletami wykorzystywania reaktorów ze złożem upakowanym są: wyższa konwersja substancji w przeliczeniu na masę katalizatora niż w innych reaktorach, niskie koszty operacyjne i możliwość przeprowadzania procesu ciągłego. Dodatkowo, szybkość reakcji zależy od ilości katalizatora, a nie objętości reaktora.
Wady: stosunkowo duże spadki ciśnienia przy przepływach mieszanin gazowych, gradienty temperaturowe, ograniczona możliwość kontroli temperatury.
W przemyśle wykorzystuje się kolumny z wypełnieniem w procesach separacji, takich jak absorpcja i destylacja. Kolumna z wypełnieniem jest podłużnym zbiornikiem ciśnieniowym, w którym znajduje się upakowane złoże. Ciecze mają tendencję do zwilżania powierzchni tego złoża, w następstwie czego następuje transfer masy. W celu poprawy separacji w kolumnach destylacyjnych wykorzystuje się złoże upakowane zamiast półek - poprawia to wydajność procesu. Innymi czynnikami wpływającymi na wydajność są kształt i powierzchnia upakowanego złoża oraz pary i ciecz wnikające do złoża.
Kolumny upakowane mają ciągłą krzywą równowagi pary, w przeciwieństwie do konwencjonalnych półek teoretycznych, gdzie każda półka stanowi oddzielny punkt równowagi para-ciecz. Jakkolwiek, użytecznym jest policzenie liczby półek teoretycznych w celu określenia skuteczności separacji upakowanej kolumny. Najpierw określa się liczbę niezbędnych teoretycznych etapów równowagi, a następnie wysokość upakowania, równą teoretycznemu stadium równowagi, zwaną też wysokością równą półce teoretycznej (HETP). Całkowita wysokość wymaganego złoża to liczba teoretycznych etapów, pomnożona przez HETP.
W doświadczeniu wykorzystano izomerazę glukozową, przeprowadzającą reakcję izomeryzacji D-glukozy do D-fruktozy. Enzym do aktywności wymaga między innymi jonów Co2+ i Mg2+. Reakcja jest równowagowa, izomeraza wykazuje powinowactwo zarówno do substratu (glukozy) jak i produktu (fruktozy). Podczas wyznaczania parametrów kinetycznych, szybkość reakcji w różnych stężeniach substratu mierzy się w warunkach początkowych, a więc zanim stopień przereagowania przekroczy 3%. Przy założeniu, że część enzymu nie jest dostępna dla substratu z racji obecności produktu w mieszaninie reakcyjnej, szybkość reakcji izomeryzacji można policzyć modelem wynikającym z inhibicji kompetycyjnej (jest to różnica między szybkością reakcji GF a FG).
Źródła
Instrukcja „Reaktory przepływowe - kolumna ze złożem upakowanym” do wykonania ćwiczenia (Politechnika Wrocławska)
A.Jaworek, T.Czech, A.Krupa, T.Antes, „Kierunki rozwoju elektrostatycznych urządzeń do oczyszczania gazów odlotowych”, V Konferencja Naukowo-Techniczna ELEKTROFILTRY'2000, Kraków 14-16 września 2000, 59-68
http://pubserv.uprp.pl/PublicationServer/Temp/e78279p824bhlpn6acb94vs612/PL113309B2.pdf (opis patentowy unieruchamiania izomerazy glukozowej)
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z procedurą postępowania przy wyznaczaniu stałych równania kinetycznego reakcji równowagowej izomeryzacji D-glukozy do D-fruktozy oraz prowadzenie procesu w kolumnie ze złożem upakowanym z immobilizowaną izomerazą glukozową.
Materiały i metody
- immobilizowana izomeraza glukozowa (ksylozowa) otrzymana nieodpłatnie od firmy Novozyme
- 0.05 M bufor Tris-HCl + 3mmol Mg, ph 7.8 w 40 st.C
- odczynniki do enzymatycznego oznaczania stężenia glukozy
- spektrofotometr UV-VIS Shimadzu
- termostatowane reaktory kolumnowe
- pompy tłokowe Prominent
- roztwory glukozy i fruktozy
* objętość całkowita złoża - 18,5 ml
* objętość wolna reaktora - 6,29 ml
* temperatura procesu: 40 st.C
Wykonanie doświadczenia
Pomiar zmiany stężeń reagentów w warunkach początkowej szybkości reakcji: Przygotowano roztwory glukozy i fruktozy o zadanych stężeniach w zakresie od 50 do 1750 mM, odważając odpowiednią ilość glukozy i fruktozy i dopełniając buforem do 500 cm3. Roztwory dokładnie wymieszano aż do całkowitego rozpuszczenia się kryształów. Do termostatowanych (40 st.C) reaktorów kolumnowych ze złożem upakowanym dozowano substrat z podanymi szybkościami przepływu (pompa „mała” - 60/120; 40/120; 20/120; 10/120; pompa „duża” - 15/120; 7,5/120; 2,5/120; 0/120), jednocześnie mierząc strumień przepływu (pomiar czasu napełniania cylindra na 50 cm3). Pobrano próbki do dalszej analizy.
Oznaczanie stężenia glukozy testem enzymatycznym: do suchych i czystych probówek wprowadzono po 1 cm3 roztworu roboczego, przygotowano również 2 probówki na standard glukozy i próbę kontrolną. Z próbek pobierano po 10 μl i dodawano do probówek z roztworem roboczym, dokładnie przepłukując końcówki. Roztwory wstawiono do łaźni wodnej ustawionej na 37 st.C na 5 minut, a następnie zmierzono absorbancję przy 500 nm wobec próby kontrolnej. Jako wartość absorbancji dla standardu glukozy przyjęto 15 mM i dalsze obliczenia wykonano z proporcji. Przy stosowaniu glukozy jako substratu, pobranych próbek nie rozcieńczano, natomiast przy wykorzystaniu jako substrat glukozy wykonano rozcieńczenia zgodnie z danymi podanymi w tabeli poniżej.
Wyznaczanie wartości Keq reakcji izomeryzacji: Do probówki wprowadzono 5 cm3 0.05 M roztworu glukozy i dodano 50 μl natywnej izomerazy glukozowej. Wstawiono do łaźni wodnej ustawionej na temperaturę 40 st.C. Odczekano w celu osiągnięcia przez układ równowagi termodynamicznej.
Stężenie glukozy [mM] |
Rozcieńczenie [-] |
Objętość roztworu badanego [l] |
Objętość wody [ml] |
50 |
2x |
1000 |
1 |
100 |
3x |
1000 |
2 |
200 |
10x |
1000 |
9 |
400 |
20x |
500 |
9,5 |
600 |
20x |
500 |
9,5 |
800 |
40x |
250 |
9,75 |
1000 |
40x |
250 |
9,75 |
1250 |
50x |
200 |
9,8 |
1500 |
50x |
200 |
9,8 |
1750 |
100x |
100 |
9,9 |
Reakcje izomeryzacji glukozy do fruktozy
Stężenie standardu Cst = 15 mM
Objętość próbki Vp = 50 ml
Objętość wolna reaktora Vr = 6,29 ml
Przykładowe obliczenia dla próbki nr 1
Cs = 50 mM
Absśr,standardu = 0,965
Absśr,substratu = 1,548
Stężenie początkowe rzeczywiste substratu (glukozy):
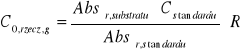
[mM]
![]()
[mM]
Stężenie początkowe substratu (glukozy) dla RP = 30:
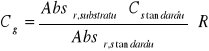
[mM]
![]()
[mM]
Stężenie produktu (fruktozy):
![]()
[mM] ![]()
[mM]
Strumień przepływu V:
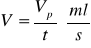
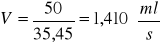
Czas przebywania τ:
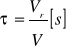
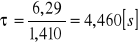
Stopień przereagowania α:
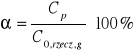
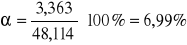
Szybkość reakcji r:
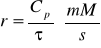
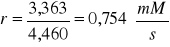
Wyniki zestawione zostały w tabelach:
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
30 |
35,45 |
1,440 |
48,114 |
44,751 |
3,363 |
1,410 |
4,460 |
6,98902 |
0,75403 |
20 |
56,93 |
1,525 |
R=2x |
47,409 |
0,705 |
0,878 |
7,162 |
1,46457 |
0,09839 |
10 |
80 |
1,516 |
|
47,140 |
0,974 |
0,625 |
10,064 |
2,02455 |
0,09679 |
0 |
179 |
1,640 |
|
50,974 |
-2,860 |
0,279 |
22,518 |
-5,94443 |
-0,12701 |
Cs = 100 mM
Absśr,standardu = 1,003
Absśr,substratu = 2,101
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
30 |
34,71 |
1,820 |
94,263 |
81,671 |
12,592 |
1,441 |
4,367 |
13,35872 |
2,88385 |
20 |
51,73 |
2,056 |
R=3x |
92,253 |
2,010 |
0,967 |
6,508 |
2,13283 |
0,30894 |
10 |
74 |
1,946 |
|
87,307 |
6,956 |
0,676 |
9,309 |
7,37920 |
0,74720 |
0 |
181 |
1,967 |
|
88,261 |
6,002 |
0,276 |
22,770 |
6,36753 |
0,26361 |
Cs = 400 mM
Absśr,standardu = 0,949
Absśr,substratu = 1,246
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
80 |
68 |
1,133 |
394,027 |
358,398 |
35,629 |
0,735 |
8,554 |
9,04227 |
4,16499 |
60 |
86 |
1,242 |
R=20x |
392,604 |
1,423 |
0,581 |
10,819 |
0,36116 |
0,13153 |
40 |
117 |
1,348 |
|
426,283 |
-32,256 |
0,427 |
14,719 |
-8,18620 |
-2,19150 |
20 |
273 |
1,281 |
|
404,989 |
-10,963 |
0,183 |
34,343 |
-2,78224 |
-0,31921 |
Cs = 800 mM
Absśr,standardu = 1,235
Absśr,substratu = 1,577
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
30 |
37 |
1,379 |
766,199 |
669,897 |
96,301 |
1,351 |
4,655 |
12,56871 |
20,68949 |
20 |
57 |
1,661 |
R=40x |
807,181 |
-40,983 |
0,877 |
7,171 |
-5,34884 |
-5,71538 |
10 |
82 |
1,367 |
|
664,066 |
102,133 |
0,610 |
10,316 |
13,32981 |
9,90081 |
0 |
213 |
1,269 |
|
616,685 |
149,514 |
0,235 |
26,795 |
19,51374 |
5,57984 |
Cs = 1250 mM
Absśr,standardu = 1,010
Absśr,substratu = 1,665
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
15 |
67,42 |
1,438 |
1235,9782 |
1067,469 |
168,509 |
0,742 |
8,481 |
13,63363 |
19,86795 |
7,5 |
117,05 |
1,520 |
R=50x |
1128,340 |
107,638 |
0,427 |
14,725 |
8,70871 |
7,30992 |
0 |
169,5 |
1,637 |
|
1215,193 |
20,785 |
0,295 |
21,323 |
1,68168 |
0,97477 |
<0 |
235,59 |
1,446 |
|
1073,037 |
162,941 |
0,212 |
29,637 |
13,18318 |
5,49786 |
Cs = 1500 mM
Absśr,standardu = 0,891
Absśr,substratu = 1,812
RP |
t [s] |
średnia Abs |
C0,rzecz,g [mM] |
Cg [mM] |
Cp [mM] |
|
s] |
α [%] |
r [mM/s] |
30 |
38,57 |
1,817 |
1524,8316 |
1529,040 |
-4,209 |
1,296 |
4,852 |
-0,27601 |
-0,86741 |
20 |
57,81 |
1,850 |
R=50x |
1557,239 |
-32,407 |
0,865 |
7,272 |
-2,12531 |
-4,45616 |
10 |
97,39 |
1,867 |
|
1571,128 |
-46,296 |
0,513 |
12,252 |
-3,03616 |
-3,77878 |
0 |
218,35 |
1,859 |
|
1564,394 |
-39,562 |
0,229 |
27,468 |
-2,59453 |
-1,44028 |
Do dalszych obliczeń wzięto wyniki z tabel zaznaczone kolorem zielonym, tj. spełniające warunek ![]()
Cs [mM] |
r [mM/s] |
48,114 |
0,09679 |
94,263 |
0,30894 |
394,027* |
0,13153* |
1235,97823 |
0,975 |
* w celu nakreślenia wykresu M-M usunięto ten punkt
1. Wykres Michaelisa-Menten dla reakcji izomeryzacji glukozy do fruktozy.
Policzono odwrotności powyższych wartości w celu stworzenia wykresu Lineweavera-Burka:
1/Cs [1/mM] |
1/r [s/mM] |
0,020784 |
10,33166 |
0,010609 |
3,23687 |
0,002538 |
7,602544 |
0,000809 |
1,025878 |
2. Wykres Lineweavera-Burka dla reakcji izomeryzacji glukozy do fruktozy.
Korzystając z równania funkcji policzono parametry kinetyczne reakcji (KM i Vmax):
y = 467,35x + 0,1517
Stąd: Vmax = 1 / 0,1517 = 6,592
KM = 467,35 / 0,1517 = 3080,751
Reakcje izomeryzacji fruktozy do glukozy
Stężenie standardu Cst = 15 mM
Objętość próbki Vp = 50 ml
Objętość wolna reaktora Vr = 6,29 ml
Przykładowe obliczenia dla próbki nr 1
Cs = 50 mM
Absśr,standardu = 1,170
Stężenie produktu dla RP = 15:
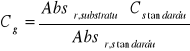
[mM]
![]()
[mM]
Strumień przepływu V:
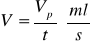
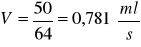
Czas przebywania τ:
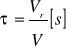
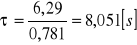
Stopień przereagowania α:
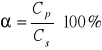
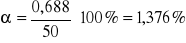
Szybkość reakcji r:
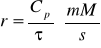
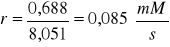
Wyniki zestawione zostały w tabelach:
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
15 |
64 |
0,054 |
0,688 |
0,781 |
8,051 |
1,37646 |
0,08548 |
7,5 |
94 |
0,110 |
1,415 |
0,532 |
11,825 |
2,82987 |
0,11965 |
0 |
148 |
0,176 |
2,257 |
0,338 |
18,618 |
4,51411 |
0,12123 |
<0 |
249 |
0,283 |
3,629 |
0,201 |
31,324 |
7,25848 |
0,11586 |
Cs = 100 mM
Absśr,standardu = 1,199
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
15 |
67 |
0,148 |
1,846 |
0,746 |
8,429 |
1,84606 |
0,21902 |
7,5 |
93 |
0,209 |
2,620 |
0,538 |
11,699 |
2,61994 |
0,22394 |
0 |
144 |
0,311 |
3,886 |
0,347 |
18,115 |
3,88611 |
0,21452 |
<0 |
358 |
0,539 |
6,740 |
0,140 |
45,036 |
6,73967 |
0,14965 |
Cs = 200 mM
Absśr,standardu = 1,204
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
15 |
82 |
0,244 |
3,040 |
0,610 |
10,316 |
1,51993 |
0,29469 |
7,5 |
112 |
0,402 |
5,012 |
0,446 |
14,090 |
2,50623 |
0,35576 |
0 |
147 |
0,521 |
6,495 |
0,340 |
18,493 |
3,24751 |
0,35122 |
<0 |
249 |
0,895 |
11,150 |
0,201 |
31,324 |
5,57517 |
0,35597 |
Cs = 400 mM
Absśr,standardu = 0,963
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
30 |
28,25 |
0,083 |
1,288 |
1,770 |
3,554 |
0,32208 |
0,36251 |
20 |
44,59 |
0,217 |
3,382 |
1,121 |
5,609 |
0,84545 |
0,60288 |
10 |
77,69 |
0,337 |
5,257 |
0,644 |
9,773 |
1,31429 |
0,53790 |
0 |
242,02 |
1,168 |
18,195 |
0,207 |
30,446 |
4,54870 |
0,59761 |
Cs = 600 mM
Absśr,standardu = 1,216
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
30 |
28,95 |
0,321 |
3,964 |
1,727 |
3,642 |
0,66064 |
1,08839 |
20 |
48,55 |
0,341 |
4,206 |
1,030 |
6,108 |
0,70107 |
0,68872 |
10 |
79,5 |
0,519 |
6,402 |
0,629 |
10,001 |
1,06702 |
0,64014 |
0 |
186,57 |
1,158 |
14,278 |
0,268 |
23,471 |
2,37973 |
0,60835 |
Cs = 800 mM
Absśr,standardu = 1,216
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
30 |
33,75 |
0,357 |
4,471 |
1,481 |
4,246 |
0,55889 |
1,05309 |
20 |
53,93 |
0,473 |
5,932 |
0,927 |
6,784 |
0,74153 |
0,87440 |
10 |
79,9 |
0,743 |
9,319 |
0,626 |
10,051 |
1,16482 |
0,92709 |
0 |
170,59 |
1,224 |
15,351 |
0,293 |
21,460 |
1,91890 |
0,71533 |
Cs = 1000 mM
Absśr,standardu = 0,953
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
R [mM/s] |
80 |
45,86 |
0,177 |
2,780 |
1,090 |
5,769 |
0,27795 |
0,48179 |
60 |
68,51 |
0,403 |
6,346 |
0,730 |
8,619 |
0,63465 |
0,73637 |
40 |
102,48 |
0,712 |
11,213 |
0,488 |
12,892 |
1,12126 |
0,86973 |
20 |
252,86 |
1,467 |
23,097 |
0,198 |
31,810 |
2,30971 |
0,72610 |
Cs = 1250 mM
Absśr,standardu = 0,927
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
80 |
53,74 |
0,619 |
10,014 |
0,930 |
6,760 |
0,80115 |
1,48131 |
60 |
69,05 |
0,595 |
9,637 |
0,724 |
8,686 |
0,77094 |
1,10939 |
40 |
67,91 |
0,859 |
13,910 |
0,736 |
8,543 |
1,11281 |
1,62823 |
20 |
169,89 |
1,858 |
30,081 |
0,294 |
21,372 |
2,40647 |
1,40748 |
Cs = 1500 mM
Absśr,standardu = 0,937
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
80 |
55 |
0,955 |
15,293 |
0,909 |
6,919 |
1,01957 |
2,21036 |
60 |
69 |
0,764 |
12,231 |
0,725 |
8,680 |
0,81537 |
1,40901 |
40 |
111 |
1,043 |
16,697 |
0,450 |
13,964 |
1,11313 |
1,19573 |
20 |
274 |
2,058 |
32,940 |
0,182 |
34,469 |
2,19602 |
0,95564 |
Cs = 1750 mM
Absśr,standardu = 0,941
RP |
t [s] |
średnia Abs |
Cp [mM] |
|
[s] |
α [%] |
r [mM/s] |
80 |
55,09 |
1,003 |
15,994 |
0,908 |
6,930 |
0,91394 |
2,30783 |
60 |
72,68 |
0,718 |
11,444 |
0,688 |
9,143 |
0,65394 |
1,25165 |
40 |
103,54 |
0,903 |
14,394 |
0,483 |
13,025 |
0,82252 |
1,10508 |
20 |
295,87 |
2,081 |
33,179 |
0,169 |
37,220 |
1,89592 |
0,89141 |
Do dalszych obliczeń wzięto wyniki z tabel zaznaczone kolorem zielonym, tj. spełniające warunek ![]()
Cs [mM] |
r [mM/s] |
50 |
0,11965 |
100 |
0,22394 |
200 |
0,35576 |
400* |
0,53790* |
600 |
0,60835 |
800 |
0,71533 |
1000* |
0,72610* |
1250* |
1,40748* |
1500 |
0,95564 |
1750* |
0,89141* |
* w celu nakreślenia wykresu M-M usunięto te punkty
3. Wykres Michaelisa-Menten dla reakcji izomeryzacji fruktozy do glukozy.
Policzono odwrotności powyższych wartości w celu stworzenia wykresu Lineweavera-Burka:
1/Cs [1/mM] |
1/r [s/mM] |
0,02 |
8,3574 |
0,01 |
4,4655 |
0,005 |
2,8109 |
0,0025* |
1,8591* |
0,001667 |
1,6438 |
0,00125 |
1,3980 |
0,001* |
1,3772* |
0,0008* |
0,7105* |
0,000667 |
1,0464 |
0,000571* |
1,1218* |
* w celu nakreślenia wykresu L-B usunięto te same punkty, co w poprzednim zestawieniu
4. Wykres Lineweavera-Burka dla reakcji izomeryzacji fruktozy do glukozy.
Korzystając z równania funkcji policzono parametry kinetyczne reakcji (KM i Vmax):
y = 370x + 0,9077
Stąd: Vmax = 1 / 0,9077 = 1,102
KM = 370 / 0,9077 = 407,624
Wyznaczenie stałej równowagi Keq na podstawie stanu równowagi termodynamicznej:
Przyjęto założenie: A ~ C, zatem wartości absorbancji są w dobrym przybliżeniu równe wartościom odpowiednich stężeń. Wartości zaznaczone na czerwono nie były brane pod uwagę przy obliczaniu średnich (które posłużyły do dalszych obliczeń) :
Abs |
Cg,0 (G) [mM] |
Cg* (G+E) [mM] |
CF* [mM] |
Cg,0,śr [mM] |
Cg*,śr [mM] |
CF*,śr [mM] |
Keq |
1 |
1,909 |
1,102 |
0,807 |
1,920 |
1,069 |
0,859 |
0,803 |
2 |
1,67 |
1,085 |
0,585 |
|
|
|
|
3 |
1,931 |
1,021 |
0,910 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1,866 |
1,055 |
0,811 |
1,841 |
1,090 |
0,752 |
0,690 |
2 |
1,872 |
1,085 |
0,787 |
|
|
|
|
3 |
1,786 |
1,129 |
0,657 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1,663 |
1,048 |
0,615 |
1,750 |
1,025 |
0,725 |
0,708 |
2 |
1,793 |
1,011 |
0,782 |
|
|
|
|
3 |
1,793 |
1,015 |
0,778 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
0,693 |
0,376 |
0,317 |
0,678 |
0,362 |
0,316 |
0,874 |
2 |
0,671 |
0,364 |
0,307 |
|
|
|
|
3 |
0,669 |
0,345 |
0,324 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2,029 |
1,032 |
0,997 |
2,005 |
1,088 |
0,917 |
0,843 |
2 |
2,019 |
1,116 |
0,903 |
|
|
|
|
3 |
1,967 |
1,116 |
0,851 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1,464 |
0,778 |
0,686 |
1,473 |
0,785 |
0,688 |
0,877 |
2 |
1,483 |
0,792 |
0,691 |
|
|
|
|
3 |
1,473 |
0,785 |
0,688 |
|
|
|
|
Przykładowe obliczenia:
Stężenie CF*:
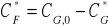
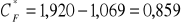
[mM]Stała równowagi Keq (ze stężeń równowagowych):
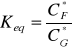
![]()
Średnia stała równowagi Keq,śr (średnia arytmetyczna):
![]()
Obliczono również stałą równowagi Keq z równania Haldana, używając wyliczonych wcześniej wartości parametrów kinetycznych:
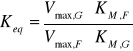
gdzie indeksy G/F oznaczają odpowiednio wyliczone wartości dla glukozy i fruktozy.
![]()
0,791
Wnioski
Przy tworzeniu wykresów Michaelisa-Menten oraz Lineweavera-Burka, odpowiednio dla glukozy i fruktozy, pod uwagę brane były te punkty szybkości reakcji, dla których stopień przereagowania α był mniejszy lub równy 3% (początkowe warunki reakcji). W przypadku wykresu dla glukozy, wiele wartości było ujemnych, bądź też stopień przereagowania był zbyt duży, w związku z czym należało znaczną część punktów odrzucić, co z kolei wpłynęło negatywnie na dokładność wykresów. Co ciekawe, wykres dla fruktozy nie sprawił aż takich problemów i wartości na nim wydają się być wiarygodne.
Ze wspomnianych wykresów wyliczono tzw. pozorne parametry kinetyczne reakcji: Vmax i KM, porównując je następnie ze sobą. Wartości prezentują się następująco:
GLUKOZA |
FRUKTOZA |
||
Vmax |
6,592 |
Vmax |
1,102 |
Km |
3080,751 |
Km |
407,624 |
Stałą równowagi Keq wyznaczono korzystając z dwóch metod: doświadczalnie oraz ze stałej równowagi termodynamicznej. Wyliczone wartości są do siebie bardzo zbliżone, różnią się o wartość ΔKeq = 0,799 - 0,791 = 0,008, a więc bardzo niewiele - pozwala to stwierdzić poprawność wykonanych obliczeń.
Rozbieżności można tłumaczyć różną dostępnością dla substratu enzymu, który jest immobilizowany na złożu w porównaniu do enzymu natywnego, który jest „wolny”. Wpływ na wyniki może mieć też temperatura, w której przeprowadzono proces (tj. 40 st.C), podczas gdy optimum temperaturowe dla izomerazy to ok.65 st.C (dane literaturowe).
Sprawozdanie 3. Strona 10 z 13 |
Politechnika Wrocławska Wydział Chemiczny |
Dr hab. Jolanta Bryjak, prof. PWr Pon, godz. 13:15, bud.C6/123A |
Laboratorium Inżynieria Bioreaktorów |
Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D-glukozy do D-fruktozy |
Wojciech Ślęczek 168560 Maciej Duda 168516 |
Wyszukiwarka