13. REAKCJE STRĄCANIA OSADÓW. ILOCZYN ROZPUSZCZALNOŚCI.
Roztwór nasycony. Rozpuszczalność substancji.
Reakcje strącania osadów. Równania reakcji strąceniowych.
Zapis jonowy reakcji strąceniowych.
Iloczyn rozpuszczalności
Molowa rozpuszczalność (S)
Tabela rozpuszczalności. Związki wytrącające się jako osady
Roztwór nasycony to roztwór pozostający w równowadze z substancją rozpuszczaną, która więcej się już w nim nie rozpuszcza.
Rozpuszczalność substancji wyraża masę tej substancji wyrażoną w gramach, którą możemy rozpuścić w 100 gramach rozpuszczalnika z utworzeniem roztworu nasyconego. Inaczej jest to stężenie substancji rozpuszczonej w jej roztworze nasyconym.
Reakcje strąceniowe - przykłady, zapis jonowy:
AgNO3 + HCl → HNO3 + AgCl↓ Ag+ + Cl- → AgCl↓
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓ Cu2+ + 2OH- → Cu(OH)2↓
nAm+ + mBn- (AnBm )osad
W nasyconym roztworze trudno rozpuszczalnego elektrolitu o wzorze ogólnym AB, pozostającego w kontakcie z osadem, ustala się stan równowagi dynamicznej:
(AB)osad A+ + B-
Stała równowagi tego typu reakcji ma postać:
K = [A+][B-] / [AB]osad
Stężenie osadu [AB]osad ma w stałej temperaturze wartość stałą, a zatem stałą K oraz stałą wartość [AB]osad można wyrazić za pomocą wspólnej stałej LAB zwanej iloczynem rozpuszczalności. (LAB = K * [AB])
LAB = [A+][B-]
Iloczyn rozpuszczalności jest to iloczyn stężeń jonów trudnorozpuszczalnego elektrolitu w jego roztworze nasyconym. LAB jest miarą.. rozpuszczalności trudno rozpuszczalnych elektrolitów.
W przypadku kiedy trudno rozpuszczalny elektrolit dysocjuje na kilka jonów, najczęściej o wyższej wartościowości:
(AnBm )osad nAm+ + mBn-
wyrażenie na iloczyn rozpuszczalności przyjmuje postać: LAnBm = [Am+]n . [Bn-]m
Przykład: Bi2S3 <=> 2Bi3+ + 3S2- L = [Bi3+]2 . [S2-]3
Molową rozpuszczalność trudno rozpuszczalnego elektrolitu w nasyconym roztworze, wyrażoną w [mol/dm3] oznaczono literą S.
Uwzględniając rozpuszczalność molową S mamy:
LAnBm = [Am+]n . [Bn-]m = (nS)n . (mS)m = nn . mm . S(n+m)
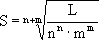
i ostatecznie: S = (LAnBm /nn . mm)(n+m)
Dla wyżej napisanego przykładu możemy odczytać, że z jednego mola Bi2S3 otrzymamy dwa mole Bi3+ i trzy mole S2-. Po podstawieniu stężeń do iloczynu jonowego otrzymuje się:
L = [Bi3+]2 . [S2-]3 = (2S)2 . (3S)3 = 108 S5
Stąd: S = (L/108)0.2
Grupa substancji rozpuszczalnych
wszystkie azotany są rozpuszczalne
wszystkie octany są rozpuszczalne
wszystkie chlorki, bromki i jodki są rozpuszczalne w wyjątkiem srebrowych, rtęci(I) i ołowiu(II)
wszystkie siarczany są rozpuszczalne z wyjątkiem siarczanów baru, strontu i ołowiu; CaSO4, Ag2SO4 i Hg2SO4 są słabo rozpuszczalne
wszystkie sole sodowe, potasowe i amonowe są rozpuszczalne z wyjątkiem NaSb(OH)6, K2PtCl6, KClO4
Grupa substancji praktycznie nierozpuszczalnych
wszystkie wodorotlenki z wyjątkiem wodorotlenków metali alkalicznych, amonowego i barowego są nierozpuszczalne;
Ca(OH)2 i Sr(OH)2 są gorzej rozpuszczalne,wszystkie obojętne węglany i fosforany są nierozpuszczalne z wyjątkiem węglanów i fosforanów amonowych oraz metali alkalicznych,
wszystkie siarczki z wyjątkiem siarczków amonowych, siarczków metali alkalicznych i metali ziem alkalicznych są nierozpuszczalne.
Zad.1.
Oblicz wartość iloczynu rozpuszczalności AgCl jeżeli w 200 ml roztworu rozpuszcza się 0.3 mg soli.
RAgCl = 0.3 mg/0.2 dm3 . 143.32 g/mol = 1.047x10-5 mol/dm3
AgCl Ag+ + Cl-
[Ag+] = [Cl-] = 1.047x10-5 mol/dm3
LAgCl = [Ag+][Cl-] = 1.1x10-10 mol/dm3
Zad.2.
Obliczyć rozpuszczalność (sm) Fe2S3 w g/dm3, jeśli jego iloczyn rozpuszczalności wynosi 1.0x10-88.
Fe2S3 2Fe3+ + 3S2-
LFe2S3 = [Fe3+]2[S2-]3 = (2s)2(3s)3 = 108s5
108s5 = 1.0x10-88, s = (1.0x10-88/108)0.2
s = 9.847 . 10-19 mol/dm3
M = 207.996 g/mol
sm = s . M = 9.847 . 10-19 mol/dm3 . 207.996 g/mol = 2.047x10-16g/dm3
Zad.3.
Zmieszano 150 ml 0.0015 molowego roztworu KJ i 100 ml 0,01 molowego roztworu AgNO3. Czy wytraci się osad AgJ, jeśli LAgJ = 8.3x10-17?
V = (150 + 100)ml = 250 ml
[KJ] = [J-] = 150x0.0015/250 mol/dm3 = 0.0009 mol/dm3
[AgNO3] = [Ag+] = 100x0.01/250 mol/dm3 = 0.004 mol/dm3
[Ag+][J-] = 0.004 mol/dm3 x 0.0009 mol/dm3 = 3.6x10-6(mol/dm3)2 > LAgJ = 8.3x10-17
Osad AgJ wytrąci się, ponieważ iloczyn rozpuszczalności AgJ został przekroczony.
Tabela rozpuszczalności |
KATIONY |
|||||||||||||
|
NH4+ |
Na+ |
K+ |
Ag+ |
Mg2+ |
Ca2+ |
Ba2+ |
Zn2+ |
Cu2+ |
Pb2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
A |
OH- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S2- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO3- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3COO- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO32- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO42- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PO43- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SiO44- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bardzo słabo rozpuszczalny |
|
słabo rozpuszczalny |
|
rozpuszczalny |
|
bardzo dobrze rozpuszczalny |
|
zachodzą skomplikowane reakcje |
Wyszukiwarka