PODZIA* SZCZEG**OWY LEK*W P/NOWOTWOROWYCH
1. Klasyczne leki alkiluj*ce i leki o podobnym mechani*mie dzia*ania:
Pochodne chloroetyloaminy:
ad. a. grupa chlormetyny (grupa iperytów azotowych):
Chlormethini hydrochloridum (Chlormetyna, Nitrogranulogen)
Chlorambucilum (Leukeran)
Melphalanum (Alkeran, Melfalan, Sardysin)
Estramustini phosphas (Estracyt)
ad. b. pochodne oksazafosforyny:
Cyclophosphamidum (Endoxan)
Ifosfamidum (Holoxan, Macdafen)
ad. c. pochodne nitrozomocznika:
!! Fotemustinum (synnonim: Cecenu, Belustine)
2. Pochodne metanosulfonianów alkanodioli:
Busulfanum (Busulfan, Myleran)
3. Pochodna alkilohydrazyny:
ad. b. pochodna triazenu:
Dacarbazinum (Deticene, DTIC)
Temazolamidum (Temodal)
4. Zwi*zki kompleksowe platyny (quasialkiluj*ce):
Cisplatinum (Blastolem, Cisplatil, Platimine, Platidiam, Platinol)
Carboplatinum (Cycloplatin, Carboplat)
2. ANTYMETABOLITY
Hydroksycarbamidum (Hydroksyn)
Istot* dzia*ania leków p/nowotworowych jest hamowanie podzia*u kom*rek nowotworowych. Jest to efekt dzia*ania cytostatycznego. Nie jest to dzia*anie wybi*rcze, dotyczy tak*e komórek zdrowych, np. komórek szpiku, komórek nab*onkowych, gametocyt*w i opuszek w*osowych. Cytostatyki stosowane s* w leczeniu nowotwor*w rozsianych, pigmentacyjnych oraz jako leki wspomagaj*ce po zabiegach chirurgicznych.
Cytostatyki podawane s* okresowo w celu umo*liwienia kom*rkom zdrowym odnowy. Leki te mog* dzia*a* na kom*rki znajduj*ce si* w jednej z faz podzia*u lub na wszystkie fazy jednocze*nie.
1). Leki swoiste dla cyklu podzia*owego - dzia*aj* na kom*rki poliferuj*ce (nie działają na kom*rki znajduj*ce si* w stanie spoczynku - faza G0).
2). Leki swoiste dla fazy cyklu podzia*owego - dzia*aj* niszcz*co na komórki znajdujące się w okre*lonej fazie cyklu, np. G0, G1 itp.
3). Leki nieswoiste dla fazy i cyklu - niszcz* kom*rki rakowe poliferuj*ce, bez wzgl*du na faz* w jakiej si* znajduj*, tak*e na komórki w fazie spoczynkowej.
rys. Kinetyczny model cyklu komórkowego
„Farmakologia” - W. Kostowski
Wydawnictwo Lekarskie PZWL, Warszawa 1998 (strona 1076)
* Faza G0 - faza spoczynkowa;
* Faza G1 - faza pomitotycznego wzrostu kom*rki; charakteryzuje si* wzmo*on* syntez* RNA i bia*ek;
* Faza G2 - faza przedmitotycznego wzrostu kom*rek; charakteryzuje si* wzmo*on* syntez* RNA i bia*ek;
* Faza S - nast*puje podwojenie garnituru chromosomowego;
* M - mitoza;
OGÓLNY PODZIA* LEK*W P/NOWOTWOROWYCH
I. Leki cytostatyczne - dzia*aj* g**wnie w fazie mi*dzypodzia*owej - w fazie G1, G2, S. Hamuj* one syntez* DNA, RNA i bia*ek.
II. Leki antymitotyczne - dzia*aj* w fazie podzia*owej. Uszkadzaj* struktury kom*rkowe, niezb*dnie potrzebne do przeprowadzenia podzia*u komórki, np. hamujące syntezę wrzeciona podzia*owego.
PODZIA* SZCZEG**OWY LEK*W P/NOWOTWOROWYCH
1. Klasyczne leki alkiluj*ce i leki o podobnym mechani*mie dzia*ania.
2. Antymetabolity.
3. Antybiotyki p/nowotworowe.
4. Hormony i antyhormony.
5. Leki ro*linne: alkaloidy, lignany, taksany (najnowsze).
6. Enzymy - asparaginaza.
7. Inne - pochodne akrydyny, pochodne mocznika, interferon.
ad. 1. Klasyczne leki alkiluj*ce i leki o podobnym mechani*mie dzia*ania:
Leki te zawierają w swojej strukturze jedną lub więcej grup alkilowych (względnie posiadają zdolność do ich tworzenia). Związki te w środowisku wodnym w obecności jonów wodorowych tworzą kationy (karbokationy) łatwo reagujące z ugrupowaniami nukleofilowymi DNA, RNA i białek. Substytucja nukleofilowa może mieć miejsce przy ugrupowaniach aminowych, hydroksylowych, fosforanowych, tiolowych, imidazolowych. W podwójnej spirali DNA najbardziej wrażliwy na alkilację jest atom azotu w pozycji 7 guaniny. Uczwartorzędowienie azotu w pozycji 7 zmniejsza trwałość pierścienia imidazolowego. Pierścień pęka, w efekcie czego guanina wypada z DNA - dochodzi do uszkodzenia struktury DNA.
Leki zawierające dwa ugrupowania alkilowe - leki bifunkcyjne - mogą tworzyć mostki pomiędzy dwoma centrami nukleofilowymi jednej nici DNA lub pomiędzy obiema nićmi DNA. Dzięki temu utrudnione jest rozwinięcie DNA i powstrzymana zostaje replikacja DNA.
Podzia* *rodk*w alkiluj*cych
1. Pochodne β-chloroetyloaminy:
a. grupa chlorometyny (grupa iperyt*w azotowych):
- chlormetyna;
- pochodne kwasu p-aminofenyloalkanokarboksylowego;
- po**czenia z hormonami;
b. pochodne oksazafosforyny;
c. pochodne nitrozomocznika;
2. Pochodne etylenoiminy (azyrydyny);
3. Metanosulfoniany alkanodioli;
4. Alkilohydrazyny:
a. pochodne metylohydrazyny;
b. pochodne triazenu;
5. Zwi*zki kompleksowe platyny (quasialkiluj*ce);
ad. 1. Pochodne chloroetyloaminy:
ad. a. grupa chlormetyny (grupa iperytów azotowych):
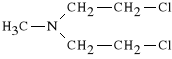
Chlormethini hydrochloridum (synonim: Chlormetyna, Nitrogranulogen)

chlorowodorek metylo-bis-(-chloroetylo)-aminy
Nitrogranulogen jest związkiem bifunkcyjnym. W *rodowisku wodnym, pod wp*ywem jon*w wodorowych (w kom*rkach nowotworowych jest niskie pH ze wzgl*du na intensywn* glikoliz*) zachodzi alkilacja.
Lek znalaz* zastosowanie w ziarnicy złośliwej, w chłoniakach złośliwych i bia*aczce. Może być stosowany tylko dożylnie. Roztwory Chlormetyny przygotowuje się ex-tempore, gdyż są one trwałe tylko przez 15 minut. Lek dzia*a kr*tko (szybko ulega biotransformacji). Jest rzadko stosowany ze względu na toksyczność w stosunku do układu krwiotwórczego (mielotoksyczność).
M E C H A N I Z M D Z I A Ł A N I A
|
Aktywność p/nowotworowa i toksyczność tej grupy leków zależą od szybkość tworzenia się kationu azirydyniowego.
Żeby zmniejszyć toksyczność tej grupy leków należy zmniejszyć charakter zasadowy. Można to uzyskać podstawiając atom azotu podstawnikiem elektronowiążącym.
Chlorambucilum (synonim: Leukeran)
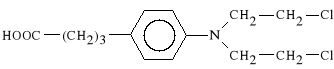
kwas 4-p-[bis-(-chloroetylo)-amino]-fenylomasłowy
Jest wchłaniany z przewodu pokarmowego. Nie działa drażniąco. Może być stosowany doustnie. Jest to lek bifunkcyjny. Podobnie jak lek poprzedni jest on niespecyficzny dla fazy i cyklu. Działa wolniej od Chlormetyny. Stosowany jest w ziarniakach złośliwych, w chłoniakach, a także w ciężkich przypadkach reumatoidalnego zapalenia stawów, które nie poddają się innemu leczeniu.
Melphalanum (synonim: Alkeran, Melfalan, Sardysin)
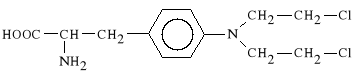
4-[bis-(2-chloroetylo)-amino]-L-fenylo-alanina
Lek bifunkcjonalny. Dobrze wchłania się z przewodu pokarmowego. Jest wolno metabolizowany i wolno wydalany. Stosowany jest w szpiczaku mnogim, w czerniaku, nowotworze jajnika, mi*sakach.
__________________________________
Specyficzną grupę leków stanowią połączenia iperytów azotowych z hormonami. Przykładem może być połączenie estradiolu z chlormetyną.
Estramustini phosphas (synonim: Estracyt)
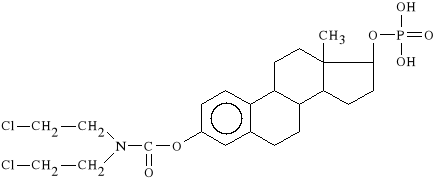
17 -fosforan-3-[N-bis-(2-chloroetylo)-karbaminianu]-
-estra-1,3,5-trieno-1,17 -diolu
Lek ulega rozkładowi w komórkach nowotworowych. Estradiol hamuje 5-reduktazę. Jest to enzym odpowiedzialny za przekształcanie testosteronu w 5-dihydrotestosteron, który jest czynnikiem stymulującym rozrost gruczołu krokowego. Reszta iperytowa działa alkilująco na składniki komórek nowotworowych. Estracyt jest stosowany w zaawansowanej chorobie nowotworowej gruczo*u krokowego.
Prednimustinum (synonim: Stereocyt, Sterecyt)
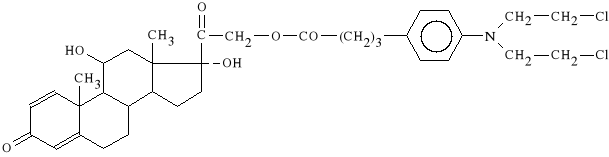
21-{4-[4-[bis-(2-chloroetylo)-amino]-fenylo]-1-oksobutoksy}-
-11b,17a-dihydroksy-pregna-1,4-dieno-3,20-dion
Lek działa p/rozrostowo (pochodna prednizolonu) i jako środek alkilujący. Jako glikokortykosteroid hamuje syntezę i powoduje rozpad białek, głównie limfocytów. Lek znalazł zastosowanie w białaczce, ziarnicy złośliwej i w ch*oniakach.
ad. b. pochodne oksazafosforyny:
Cyclophosphamidum (synonim: Endoxan)
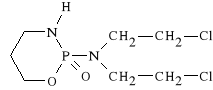
2-tlenek-N,N-[bis-(2-chloroetylo)]-tetrahydro-
-2 H-1,3,2-oksazafosforyno-2-aminy
Jest to prolek. Jego właściwości alkilujące ujawniają się dopero po biotransformacji w wątrobie i komórkach nowotworowych. W wątrobie ulega on hydroksylacji do 4-hydroksycyklofosfamidu. Związek ten utlenia się do czynnego aldofosfamidu lub do 4-ketopochodnej, która jest nieczynna farmakologicznie. Aldofosfamid ulega częściowemu utlenieniu do karboksyfosfamidu, który jest metabolitem nieczynnym farmakologicznie. Częściowo aldofosfamid jest transportowany wraz z krwią do tkanki nowotworowej, gdzie ulega rozszczepieniu, tworząc akroleinę i iperyt fosforamidowy. Powstały iperyt jest bardzo wrażliwy na hydrolizę, dlatego bardzo łatwo przechodzi w nor-N-iperyt, który w kwaśnym środowisku tkanki nowotworowej odszczepia kation, przechodząc w kation azirydyniowy. Jest to lek swoisty dla cyklu. Hamuje aktywno** enzym*w bior*cych udzia* w syntezie DNA. Jest stosowany w różnych typach nowotworów. Silnie niszczy opuszki włosowe.
M E C H A N I Z M D Z I A Ł A N I A
|
A - aldofosfamid;
B - karboksyfosfamid;
C - iperyt fosforamidowy;
D - akroleina;
E - nor-N-iperyt;
F - kation azirydyniowy;
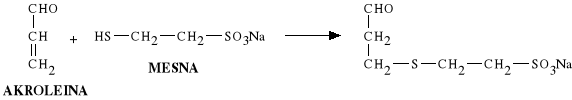
Powstała akroleina również wykazuje działanie p/nowotworowe. Jest związkiem bardzo silnie drażniącym drogi moczowe. Powoduje ciężkie stany zapalne dróg moczowych. Dlatego podczas leczenia Cyklofosfamidem stosuje się antidotum - Mesna (2-merkaptoetanosulfonian sodowy), który zapobiega nefrotoksyczności. Sama Mesna jest stosowana jako lek o działaniu mukolitycznym.
Ifosfamidum (synonim: Holoxan, Macdafen)
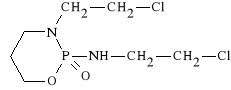
2-tlenek-N,3-bis-(2-chloroetylo)-tetrahydro-2 H-1,3,2-oksazafosforyno-2-aminy
Lek jest aktywowany podobnie jak lek poprzedni. Wykazuje słabsze działanie mielotoksyczne, lecz silniejsze nefrotoksyczne. Stosuje się razem z Mesną. Holoxan podaje się tylko dożylnie. Stosuje się go w raku jąder, chłoniakach, mięsakach oraz w czerniakach. Daje pozytywne rezultaty u chorych, u których leczenie cyklofosfamidem nie dało pożądanego rezultatu (ale tylko u niektórych)
ad. c. pochodne nitrozomocznika:
Lomustinum (synonim: Cecenu, Belustine)
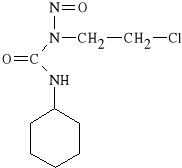
N-(2-chloroetylo)-N`-cykloheksylo-N-nitrozomocznik
Pochodne mocznika są bardzo reaktywne chemicznie. Są metabolizowane w wątrobie. Produkty biotransformacji mają właściwości alkilujące i acylujące. Leki te dzięki aktywności swoich metabolitów hamują polimerazę DNA, uniemożliwiają procesy reparacji DNA oraz zaburzają syntezę RNA. Są nieswoiste dla cyklu i fazy. Odznaczają się znaczną lipofilnością, w związku z czym mogą przenikać barierę krew-mózg, dlatego bywają stosowane w pierwotnych i wtórnych nowotworach mózgu, a tak*e w mi*sakach i czerniakach.
Lomustina słabo wchłania się z przewodu pokarmowego, dlatego podaje się ją dożylnie. Inne pochodne nitrozomocznika mogą wchłaniać się z przewodu pokarmowego, więc można je podawać doustnie.
ad. 2. Pochodne etylenoiminy (azyrydyny):
Thiotepum (synonim: Thiophosphamide, Thiotepa)
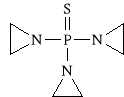
siarczek tris-(azyrydynylo)-fosfinowy
Jest to prolek. Ulega on oksydatywnej desulfuracji. Z Tiotepy tworzy się tepa, która w kwaśnym środowisku tworzy kation azirydyniowy. Lek ten jest lekiem trójfunkcyjnym. Hamuje syntezę DNA, RNA i białek. Działa w fazie S, G1 i G2. Roztwory leku przygotowuje się ex-tempore. Znalazł on zastosowanie w chorobie nowotworowej sutka, jajnika, pęcherza moczowego itp.
M E C H A N I Z M D Z I A Ł A N I A
|
ad. 3. Pochodne metanosulfonianów alkanodioli:
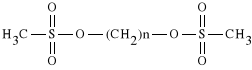
WZÓR OGÓLNY
Najkorzystniej działającym lekiem z tej grupy jest taki lek, który zawiera łańcuch czterowęglowy, ponieważ przy tej długości łańcuch najłatwiej tworzą się poprzeczne mostki pomiędzy nićmi DNA.
Busulfanum (synonim: Busulfan, Myleran)
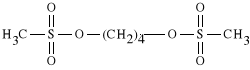
dimetylosulfonian butano-1,4-diolu
W środowisku kwaśnym lek rozpada się. Pęka wiązanie pomiędzy węglem łańcucha środkowego, a tlenem grupy metylosulfonowej. Lek jest związkiem bifunkcyjnym. Jest to jeden z leków najsilniej hamujących wybiórczo czynność szpiku kostnego. Stosuje się do w białaczce szpikowej oraz w czerwienicy. Jest lekiem nieswoistym dla cyklu i fazy. Dobrze wchłania się z przewodu pokarmowego. Może więc być stosowany doustnie.
M E C H A N I Z M D Z I A Ł A N I A
|
ad. 4. Pochodna alkilohydrazyny:
ad. a. pochodne metylohydrazyny:
Procarbazini hydrochloridum (synonim: Natulan)
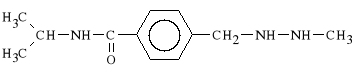
chlorowodorek N-(1-metyloetylo)-4-[(2-metylohydrazyno)-metylo]-benzamidu
Prokarbazyna bardzo dobrze wch*ania si* z przewodu pokarmowego. Ulega biotransformacji w w*trobie do dw*ch metabolit*w alkiluj*cych i wolnorodnikowych, uszkadzaj*cych struktur* kwas*w nukleinowych. Lek jest stosowany w ziarnicy z*o*liwej oraz w ch*oniakach nieziarnistych.
ad. b. pochodna triazenu:
Dacarbazinum (synonim: Deticene, DTIC)
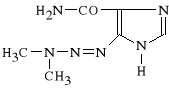
5-(3,3-dimetylo-1-triazenylo)-1 H-imidazolo-4-karboksamid
Jest to pochodna triazenu. Jest prolekiem, który w wątrobie ulega zmetabolizowaniu, dając aktywny jon metylodiazoniowy. Lek wykazuje zdolność metylowania RNA i białek oraz w mniejszym stopniu DNA. Stosuje się go w czerniaku złośliwym, w mięsakach i ziarnicach złośliwych. Jest lekiem swoistym dla fazy i cyklu. Słabo przenika barierę krew-mózg. Jest mniej toksyczny od innych.
ad. 5. Zwi*zki kompleksowe platyny (quasialkiluj*ce):
Związki kompleksowe platyny - reagują z centrami nukleofilowymi DNA i białek, dając efekt podobny do efektu działania środków alkilujących. Czynne są tylko formy cis. Izomery trans są nieaktywne farmakologicznie. Związki te działają cytostatycznie i immunosupresyjnie.
Cisplatinum (synonim: Blastolem, Cisplatil, Platimine, Platidiam, Platinol)
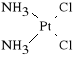
cis-diamino-dichloro-platyna
Łatwo tworzy w środowisku wodnym elektrofilne akwakompleksy, które łączą się z centrami nukleofilnymi substratów komórkowych. Lek jest stosowany z innymi cytostatykami w raku pęcherza moczowego, w raku płuc, jąder, jajników oraz w ziarnicach. Jest to związek nieswoisty dla fazy i cyklu. Preparat ten cechuje wysoka nefro-, neuro- i ototoksyczność.
M E C H A N I Z M D Z I A Ł A N I A
|
Carboplatinum (synonim: Cycloplatin, Carboplat)
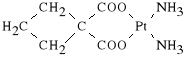
diamino-(1,1-cyklbutano-dikarboksylano)-platyna
Cycloplatin jest lepiej rozpuszczalny w wodzie niż Cisplatin. Lek wykazuje także mniejszą toksyczność (ma jednak bardziej nasilone działanie mielotoksyczne). Związek ten jest stosowany w raku sutka, jajnika, płuc, w raku litym g*owy, szyi oraz w r**nych nowotworach z*o*liwych.
11