
Wyniki:
Płytka 1 |
Czynnik wywołujący: Jod |
Roztwór nanoszony na płytkę: |
Roztwór kwasu askorbinowego , stężenie 0,01 mol/dm3, |
Barwa plam uwidocznionych związków:
|
żółta |
Wartość współczynnika Rf: |
|
Substancja chemiczna:
|
kwas askorbinowy |
Wzór strukturalny:
|
|
Płytka 2 |
|
Czynnik wywołujący: |
jod |
Roztwór nanoszony na płytkę: |
sok z cytryny
|
Barwa plam uwidocznionych związków:
|
żółta |
Wartości współczynników Rf uwidocznionych związków: |
|
Wynik porównania z chromatogramem wzorca: |
|
Nazwa wykrytej substancji:
Przesłanki identyfikacji (wymień w punktach):
|
Kwas askorbinowy
|
Płytka 3 |
|
Czynnik wywołujący: |
jod |
Roztwór nanoszony na płytkę: |
sok z kiwi
|
Barwa plam uwidocznionych związków: |
żółta |
Wartości współczynników Rf uwidocznionych związków: |
|
Wynik porównania z chromatogramem wzorca: |
|
Nazwa wykrytej substancji:
Przesłanki identyfikacji (wymień w punktach):
|
Kwas askorbinowy
|
CZĘŚĆ II - Pokazy doświadczeń - metody rozdzielania substancji
POKAZ I Destylacja prosta wodnego roztworu chlorku miedzi (II).
Wstęp teoretyczny
Destylacja to proces stosowany do oczyszczania cieczy z niewielkich zanieczyszczeń lub do rozdzielania mieszaniny kilku cieczy.
W procesie destylacji przeprowadza się ciecz w parę w wyniku ogrzewania jej do wrzenia. Powstałe opary kieruje się do chłodnicy gdzie ulegają skropleniu i następnie są zbierane w odbieralniku.
Destylacja możliwa jest jedynie w przypadku, gdy składniki mieszaniny wykazują znaczną różnicę lotności, czyli jednocześnie temperatury wrzenia. W przypadku gdy różnica ta jest niewielka należy przeprowadzać rektyfikację, zwaną także destylacją frakcyjną, polegającą na wielu kolejnych destylacjach przeprowadzanych w specjalnych zestawach.
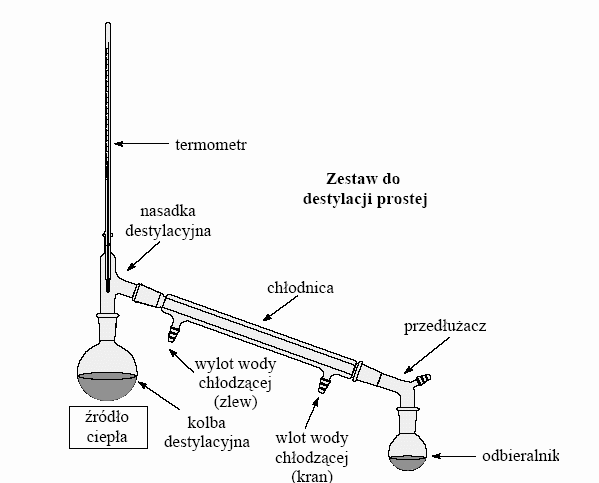
Do destylacji cieczy można stosować chłodnice powietrzną - dla cieczy wrzących powyżej 120OC lub chłodnicę wodną - dla cieczy wrzących poniżej 120OC. Dodatkowo stosujemy zasadę: im bardziej lotna ciecz tym dłuższą chłodnicę stosujemy w trakcie destylacji.
Przebieg doświadczenia
W kolbie destylacyjnej umieszczono destylowany wodny roztwór chlorku miedzi (II) i kamyczki wrzenie. Kolbę ogrzewano za pomocą płaszcza grzejnego. Po ogrzaniu do ok. 100OC Z roztworu w postaci pary zaczęła ulatniać się woda. Jej pary przeszły przez chłodnicę Liebiega, gdzie uległy skropleniu i spłynęły do odbieralnika. Po zakończeniu procesu w kolbie destylacyjnej znajdował się oczyszczona ciecz wyczerpana - chlorek miedzi (II) zaś w odbieralniku destylat- woda. Rys.1 Zestaw do destylacji prostej
POKAZ II Sublimacja jodu.
Wstęp teoretyczny:
Sublimacja to proces przejścia ze stanu stałego do gazowego z pominięciem fazy ciekłej. Można ją stosować w celu oddzielenia substancji sublimującej od niesublimującej. Przykładowe substancje sublimujące to jod, antracen, naftalen, chlorek amonu.
Przebieg:
W suchej zlewce o poj. 100cm3 umieszczono mieszaninę jodu i piasku. Zlewkę przykryto kolbą okrągłodenną wypełnioną do ¾ zimną wodą. Zlewkę ogrzewano płomieniem palnika gazowego.
W trakcie ogrzewania w zlewce pojawiły się fioletowe pary gazowego jodu. Po zaprzestaniu ogrzewania na dnie kolby okrągłodennej pojawiły się srebrzyste kryształki jodu. W zlewce pozostał oczyszczony z jodu piasek.
POKAZ III Ekstrakcja ciągła barwników z liści mlecza za pomocą roztworu etanolu.
Wstęp teoretyczny:
Ekstrakcja to proces wydzielania składnika z roztworu lub mieszaniny stałej (surówki) rozpuszczalnikiem (ekstrahentem) nie mieszającym się z rozpuszczalnikiem ekstrahowanego roztworu.
Ekstrakcje z roztworu można prowadzić w sposób okresowy, posługując się rozdzielaczem stożkowym lub w sposób ciągły w odpowiednich zestawach. Ekstrakcja ciągła jest bardziej skuteczna w przypadku ekstrahowania składnika z mieszaniny stałej. Nawet w przypadku stosowania ekstrakcji nieciągłej zaleca się ekstrahowanie kilkukrotne, niewielkimi porcjami ekstrahenta,
i połączenie uzyskanych ekstraktów.
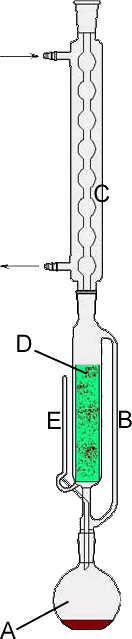
Przykładem zestawu do ekstrakcji ciągłej jest aparat Soxhleta.
Przebieg doświadczenia:
Do ekstrakcji barwników z liści mlecza za pomocą etanolu zastosowano aparat Soxhleta (Rysunek 1.). Liście mlecza umieszczono w nasadce Soxhleta D. Następnie kolbę okrągłodenną A wypełniono etanolem do 2/3 wysokości.. Kolbe umieszczono
w płaszczu grzejnym. Na skutek ogrzewania, powstające pary rozpuszczalnika przechodziły przez rurkę B, a następie w chłodnicy zwrotnej C uległy skropleniu. Skroplony rozpuszczalnik spływał do nasadki Soxhleta D, powoli go wypełniając, co skutkowało ekstrakcją związków z substancji. W momencie, kiedy poziom skroplonego rozpuszczalnika osiągnął poziom wyższy od wysokości rurki E (tzw. syfon) został on z powrotem automatycznie spuszczony do kolby A. Nasadka napełniała się ponownie czystym rozpuszczalnikiem i proces zachodził na nowo. Po zakończeniu doświadczenia, liście mlecza straciły częściowo zieloną barwę w skutek wyekstrahowania większości barwników, zaś etanol zabarwił się na zielono.
Rys. 2. Aparat Soxhleta
BIBLIOGRAFIA:
http://www.vmc.org.pl/index.php/dowiadczalna/item/207-ekstrakcja-metod%C4%85-soxhleta
M. Modzelewski, J. Woliński, „Pracownia chemiczna. Techniki laboratoryjne.”
Rysunek pochodzi ze strony: http://www.staff.amu.edu.pl/~wlodgal/f-cwiczenie%202.pdf
Rysunek pochodzi ze stony internetowej: http://www.vmc.org.pl/index.php/dowiadczalna/item/207-ekstrakcja-metod%C4%85-soxhleta
Sprawozdanie nr 2
rozdział substancji Strona 1
Sprawozdanie nr 1 Marta Szymańska
Strącanie soli trudno rozpuszczalnej w wodzie Strona 5