AMINOKWASY BIAŁKOWE I BIAŁKA
1. Występowanie i właściwości fizyczne:
Aminokwasy są podstawowymi jednostkami struktury białek. W organizmach żywych występują w stanie wolnym jak i w łańcuchach peptydowych i białkowych. Wszystkie aminokwasy są ciałami stałymi krystalicznymi, cięższymi od wody, w większości dobrze rozpuszczalne w wodzie, niektóre posiadają smak (np. glicyna - słodki), podczas ogrzewania ulegają rozkładowi.
2. Otrzymywanie:
hydroliza białek (enzymatyczna, kwasowa, zasadowa)
podczas hydrolizy kwasowej ulegają destrukcji treonina i tryptofan
hydroliza zasadowa powoduje rozkład cysteiny i arganiny
reakcja α - fluorowcokwasów z amoniakiemmetoda cyjanohydrynowa (metoda Streckera)
reakcja ketokwasów z amoniakiem
transaminacja aminokwasów
synteza Gabriela oparta na imidzie kwasu ftalowego
Dotychczas wyodrębniono z białek w wyniku hydrolizy ponad sto aminokwasów. W kodzie genetycznym istnieją odpowiednie trójki nukleotydów jedynie dla dwudziestu z nich. Oznacza to, że duża część aminokwasów powstaje na skutek przemian zachodzących już po utworzeniu łańcucha polipeptydowego. Wszystkie aminokwasy białkowe są
α-L-aminokwasami (za wyjątkiem glicyny, która nie ma izomerów optycznych). Za podstawę do ustalania konfiguracji aminokwasów przyjęto L - (-) serynę.
3. Podział aminokwasów:
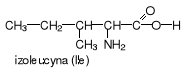
aminokwasy z bocznym łańcuchem alifatycznym
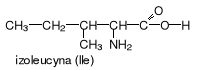
aminokwasy z bocznym łańcuchem zawierającym grupy hydroksylowe
aminokwasy z bocznym łańcuchem zawierającym atom siarki
aminokwasy zawierające grupy kwasowe lub ich amidy
aminokwasy z łańcuchem bocznym zawierającym grupy zasadowe
aminokwasy zawierające pierścienie aromatyczne
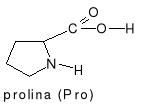
aminokwasy zawierające heterocykliczne pierścienie niearomatyczne
4. Nomenklatura:
alanina (Ala)
kwas α - aminopropionowy
kwas 2 - aminopropanowy
treonina (Thr)
kwas α -amino-β-hydroksymasłowy
kwas 2-amino-3-hydroksybutanowy
5. Właściwości chemiczne aminokwasów:
w roztworach wodnych mogą istnieć w trzech formach:
Każdy z aminokwasów ma własne, charakterystyczne pH, przy którym występuje w postaci jonu obojnaczego. W tych warunkach wykazuje on minimalną rozpuszczalność, przewodnictwo i ruchliwość w polu elektrycznym. Wartość ta nazywana jest punktem izoelektrycznym aminokwasu.
ulegają wszystkim reakcjom charakterystycznym dla grup karboksylowej i aminowej
reakcja z kwasami:
reakcja z zasadami:
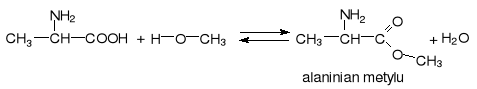
reakcja estryfikacji:
dekarboksylacja:
deaminacja:
utlenianie:
kondensacja cykliczna:
polikondensacja:
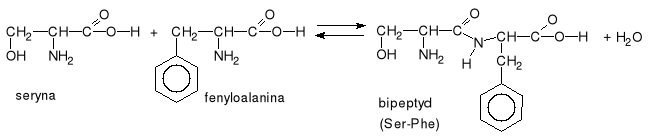
Z punktu widzenia struktury powstałego związku jest on amidem II-rzędowym. Bipeptyd powstający w wyniku reakcji nadal posiada na końcach łańcucha grupy zdolne do kontynuacji procesu kondensacji. Cząsteczka wody powstająca w wyniku reakcji polikondensacji pochodzi od grupy -OH z grupy karboksylowej jednego aminokwasu oraz atomu wodoru z grupy aminowej drugiego aminokwasu. Należy zwrócić uwagę na to, że podczas tworzenia peptydów ważna jest kolejność przyłączania aminokwasów (np. bipeptyd Ser-Phe nie pokrywa się z bipeptydem Phe-Ser). Powstające połączenie pomiędzy resztami aminokwasowymi nazywane jest wiązaniem peptydowym. Wzajemne oddziaływanie pomiędzy wiązaniem podwójnym oraz wolnymi parami elektronowymi azotu i tlenu dają możliwość tautomerycznego przegrupowania zwanego tautomerią keto-iminową
Przemieszczanie się wiązania podwójnego sprawia, że sześć atomów bezpośrednio związanych z wiązaniem peptydowym leży w jednej płaszczyźnie a atom wodoru grupy iminowej -NH ustawia się w położeniu „trans” do tlenu grupy karbonylowej (jest to korzystniejsze energetycznie).
Przyłączanie kolejnych aminokwasów prowadzi do powstania tri-, tetra-, oligo- i polipeptydów. Związki te odgrywają ogromną rolę w organizmach żywych. Przykładami są: tripeptyd glutation (Glu-Cys-Gly), który występuje niemal w każdej komórce, będąc przenośnikiem wodoru podczas spalań tkankowych, oksytocyna - peptyd złożony z dziewięciu aminokwasów stymulująca skurcze mięśni gładkich, melityna - składnik jadu pszczół mający zdolność niszczenia błon komórkowych, insulina - hormon regulujący poziom cukrów w organizmach zwierzęcych, złożony z dwóch łańcuchów 21 i 30 aminokwasowych połączonych dwoma mostkami disiarczkowymi.
6. Oznaczanie aminokwasów:
Istnieje wiele metod oznaczania aminokwasów. Jedną z najbardziej popularnych jest reakcja ninhydrynowa służąca zarówno do oznaczania jakościowego jak i ilościowego. Cechą charakterystyczną tej reakcji jest powstawanie niebieskiego barwnika w kontakcie ninhydryny z grupą α-aminową aminokwasu. Inną bardzo popularną metoda jest redukcja grupy karboksylowej aminokwasu za pomocą borowodorku sodu. W wyniku tej reakcji grupa karboksylowa redukuje się do grupy hydroksylowej a końcowym produktem jest odpowiedni α-aminoalkohol.
7. Struktury białek:
struktura I rzędowa (sekwencja ,kolejność ułożenia aminokwasów w łańcuchu polipeptydowym). W białkach naturalnych jest to uwarunkowane genetycznie
struktura II rzędowa (rodzaj konfiguracji przestrzennej łańcuchów polipeptydowych, wynik kompromisu pomiędzy zawadą przestrzenną a możliwością tworzenia się wewnątrzcząsteczkowych wiązań wodorowych). Wiązanie wodorowe powstaje pomiędzy atomem tlenu grupy karbonylowej -C=O a atomem wodoru grupy -N-H dwóch różnych wiązań peptydowych. Pauling zaproponował dwie struktury - α helisę (prawoskrętną spiralę) oraz β harmonijkę (odmianę zygzakowatą). Białka o strukturze α maja zdolność do rozciągania a o strukturze β nie.
struktura III rzędowa (przestrzenne ułożenie wszystkich łańcuchów polipeptydowych składających się na cząsteczkę białka). Struktura ta charakteryzuje pofałdowanie łańcuchów polipeptydowych w przestrzeni (skręcenie łańcucha). Dużą rolę w tworzeniu tej struktury odgrywają wiązania disiarczkowe -S-S- tworzące się między dwiema resztami cysteiny w tym samym łańcuchu lub łączące dwa różne łańcuchy. Obecność tych wiązań zwiększa odporność białek na działanie czynników denaturujących. Za tę strukturę odpowiedzialne są również oddziaływania hydrofobowe między grupami funkcyjnymi a cząsteczkami rozpuszczalnika. Reszty aminokwasowe o charakterze hydrofobowym , jak leucyna, czy walina mają tendencję do skupiania się wewnątrz cząsteczki białka. Łączą je wtedy siły Van der Waalsa . Aminokwasy z grupami o charakterze hydrofilowym ustawiają je na zewnątrz łańcucha polipeptydowego, co dodatkowo stabilizowane jest tworzącymi się wiązaniami wodorowymi z cząsteczkami H2O.
Struktura IV rzędowa (opisuje ilość, wzajemne ułożenie i połączenie pojedynczych jednostek monomerycznych o całkowicie ukształtowanej strukturze I, II i III rzędowej
8. Fizykochemiczne właściwości białek
Wszystkie białka są ciałami stałymi o zróżnicowanej rozpuszczalności w wodzie, niektóre rozpuszczają się w rozcieńczonych roztworach kwasów i zasad a inne w rozpuszczalnikach organicznych. Podczas rozpuszczania w wodzie wiążą jej cząsteczki , ulegając hydratacji. Ich rozpuszczanie jest powolne i poprzedzone pęcznieniem. Roztwory białek są roztworami koloidalnymi (wykazują efekt Tyndalla). W odpowiednich warunkach roztwór koloidalny białka (zol) tężeje (cząsteczki łączą się w większe agregaty i wypadają z roztworu) tworząc zestalony układ (żel).
Działając mocnymi elektrolitami (jednak o niezbyt wysokim stężeniu) na rozwory białek powodujemy wypadanie białka z roztworu zwane wysalaniem. Proces ten nie narusza struktury białek (niszczy jedynie otoczkę solwatacyjną) i możliwe jest jego odwrócenie np. przez dodanie nadmiaru rozpuszczalnika. Niszczenie otoczki solwatacyjnej przez mocny elektrolit polega na tym, że jony proste są o wiele silniej solwatowane niż cząsteczki białek. Zastosowanie zbyt stężonego elektrolitu może uniemożliwić odwrócenie procesu koagulacji. Nieodwracalna koagulacja białek nazywana jest denaturacją. Polega ona na wyprostowywaniu się łańcuchów polipeptydowych, które następnie tak się przeplatają, że nie mogą się już rozdzielić. Denaturacja niszczy wszystkie zdolności biologiczne białek.
9. Czynniki powodujące denaturację białek:
wysoka temperatura
stężone kwasy
stężone zasady (ługi)
stężone alkohole niskocząsteczkowe
niskocząsteczkowe aldehydy
sole metale ciężkich
niektóre rozpuszczalniki organiczne
promieniowanie przenikliwe
wibracje
ultradźwięki
10. Punkt izoelektryczny białka - to takie pH roztworu białka, przy którym stężenie cząsteczek dodatnich białka jest równe stężeniu cząsteczek ujemnych i białko zachowuje się tak jakby było pozbawione ładunku elektrycznego. W tym punkcie roztwory białek wykazują minimalną rozpuszczalność, minimalną ruchliwość w polu elektrycznym i najszybszą koagulację.
Istnienie ładunku elektrycznego na cząsteczkach białek pozwala na ich ruch w polu elektrycznym i rozdzielenie metodą elektroforezy.
11. Wykrywanie białek:
Znanych jest wiele pozwalających wykryć substancje białkowe. Jednymi z najpopularniejszych i najprostszych są:
-spalanie:
podczas spalania substancji białkowej w niezbyt wysokiej temperaturze wydziela się bardzo charakterystyczny, nieprzyjemny zapach „palonych piór”
-reakcja ksantoproteinowa:
działając na białko stężonym kwasem azotowym(V) obserwuje się pojawienie żółtego zabarwienia przechodzącego w pomarańczowe w obecności amoniaku. Reakcja ta polega na nitrowaniu pierścienia benzenowego głownie w reszcie aminokwasu tyrozyny.
-reakcja biuretowa:
działając na zimno świeżo przygotowanym wodorotlenkiem miedzi(II) na rozwór białka obserwuje się powolne rozpuszczanie niebieskiego galaretowatego osadu Cu(OH)2 z wytworzeniem różowo-fioletowego roztworu związku kompleksowego. Kompleksowanie następuje pomiędzy jonami Cu2+ a wiązaniem peptydowym. Nazwa reakcji wywodzi się stąd, że podobny efekt obserwuje się działając wodorotlenkiem miedzi(II) na biuret.
12. Podział białek:
proteiny (białka proste), które po hydrolizie dają wyłącznie aminokwasy.
proteidy (białka złożone), które oprócz aminokwasów zawierają inne niebiałkowe składniki (grupy prostetyczne).
albuminy globuliny protaminy histony prolaminy gluteliny skleroproteiny
fosfoproteidy nukleoproteidy chromoproteidy metaloproteidy glikoproteidy lipoproteidy
© Copyright by Dymitr Malec
5
PROTEINY
PROTEIDY
Wyszukiwarka
Podobne podstrony:
Aminy, MATURA !!!, CHEMIA, Chemia R, Różne zadania i testy
Zadania różne maturalne, chemia maturalna
alkohole - zadania, Matura, Chemia, zadania z organicznej
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
Związki nieorganiczne - zadania, Matura, Chemia, Zadania
Rownowaga Chemiczna Zadania, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
Zadania alkohole i estry, Szkoła średnia matura, Chemia
zadania weglowodory, Matura, Chemia, zadania z organicznej
Chemia 6 Aminokwasy Peptydy i Białka
alkohole - zadania, Matura, Chemia, zadania z organicznej
Chemia 6 Aminokwasy Peptydy i Białka
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
2004-12-01 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
więcej podobnych podstron