UNIWERSYTET WARMIŃSKO- MAZURSKI
W OLSZTYNIE
WYDZIAŁ NAUK TECHNICZNYCH
BUDOWNICTWO
Sprawozdanie z ćwiczeń laboratoryjnych z przedmiotu „Materiały budowlane”
TEMAT: Korozja metali i ochrona przed korozją.
Jan Kowalski
II rok Budownictwo
Gr. 1
2007/2008
Olsztyn, grudzień 2007
Korozja - są to wszystkie procesy, w wyniku których metal lub stop użyty jako materiał konstrukcyjny pod wpływem oddziaływania otoczenia przechodzi ze stanu wolnego (metalicznego) w stan związany.
W wyniku procesów endotermicznych podczas otrzymywania metali z ich związków, uzyskują one wyższą energię wewnętrzną. W zetknięciu ze środowiskiem zachodzą reakcje odwrotne, prowadzące do obniżenia energii wewnętrznej. Metal ze stanu wolnego przechodzi w stan związany.
Ze względu na odporność korozyjną metale dzielą się na nieszlachetne
(przeważają w przyrodzie) i metale szlachetne (np. złoto, platyna).
Na podstawie odporności korozyjnej- aktywności chemicznej, metale zostały uszeregowane w tzw. szereg aktywności (elektrochemiczny, napięciowy).
Podstawą do zaszeregowania metali w wyżej wymieniony szereg jest wartość tzw. potencjału normalnego poszczególnych metali wyrażony w V (voltach).
Potencjał normalny metalu ![]()
jest to potencjał tego metalu zanurzonego w roztworze własnych jonów o stężeniu 1-molowym.
Szereg aktywności metali można przedstawić w postaci osi liczbowej:
Możliwość zachodzenia reakcji metali wynikających z jego położenia w szeregu aktywności:
im bardziej ujemny potencjał ma metal tym szybciej reaguje (ulega korozji)
metale mniej szlachetne (bardziej ujemne) wypierają ze związków metale bardziej szlachetne zajmując ich miejsce, np.
![]()
metale znajdujące się w szeregu przed wodorem (ujemne potencjały) wydzielają się w kwasach z wydzielaniem wodoru
Rodzaje korozji:
1. Korozja chemiczna - zachodzi w suchych gazach i cieczach, które nie są elektrolitami. Korozja chemiczna zachodzi na ogół równomiernie na całej powierzchni.
![]()
![]()
![]()
![]()
![]()
reakcja ta zachodzi w podwyższonej temperaturze w kąpielach alkalicznych, nie da się go łatwo spasywować.
Niektóre metale, tak jak aluminium i chrom pokrywają się bardzo łatwo własnym tlenkiem pod wpływem tlenu, a ściśle przylegająca do tych metali warstwa ich tlenków zapobiega dalszej korozji. Metal ulega pasywacji. Pasywacja jest jednym ze sposobów zapobiegania korozji.
Pasywacja Al może zachodzić pod wpływem tlenu z powietrza lub można aluminium pasywować elektrolitycznie (np. blachy)
2. Korozja elektrochemiczna - zachodzi w wyniku zetknięcia metali i ich stopów z elektrolitami (roztworami kwasów, zasad, soli). W wyniku tej korozji na powierzchni metalu powstają mikroogniwa lokalne, które mogą doprowadzić do powstania głębokich wżerów w metalu. Korozja elektrochemiczna jest dużo groźniejsza od chemicznej.
Rodzaje mikroogniw lokalnych:
1) metal 1 elektrolit metal 2
2) metal elektrolit niemetal
3) metal elektrolit tlenek metalu
Zapobieganie korozji:
Pasywacja
Stosowanie metali i stopów odpornych na korozję
dobór kształtu konstrukcji uniemożliwiającej skraplanie pary
poprzez odcięcie powierzchni metali od czynnika korodującego (farby, lakiery, emalie, smary, materiały bitumiczne)
poprzez zmianę właściwości chemicznej powierzchni metalu- fosforowanie, chromianowanie
poprzez zamianę właściwości korozyjnych otoczenia- stosowanie tzw. inhibitorów- katalizatorów ujemnych
powlekanie metali (stali) metalami mniej szlachetnymi (warstwa anodowa) lub bardziej szlachetnymi (warstwa katodowa)
WYKONANIE ĆWICZENIA
1. Badanie korozji aluminium spasywowanego i zaktywowanego.
Aluminium jest metalem o stosunkowo niskim potencjale normalnym.
∏0Al = -1,66V
∏0Fe = -0,44V
∏0Cu = +0,34V
1.1. Aktywowanie aluminium (czyszczenie powierzchni blaszki aluminiowej z warstewki tlenku)
Powierzchnię blaszki aluminiowej należy oczyścić mechanicznie do połysku przy pomocy papieru ściernego, a następnie na minutę zanurzyć do 20% roztworu HCl - chemiczna metoda aktywacji. Równocześnie na 1 minutę w wyżej wymienionym kwasie należy zanurzyć krążek platynowy.
Reakcje, według których zachodzi aktywacja chemiczna:
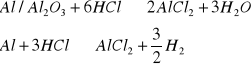
![]()
reakcja nie zachodzi
1.2. Pasywowanie aluminium - jest to pokrywanie powierzchni metalu warstewką jego tlenku (proces odwrotny do aktywacji). Należy oczyścić papierem ściernym powierzchnię blaszki aluminiowej, a następnie zanurzyć ją na 20 minut w 20% roztworze HNO3.
Pasywacja zachodzi zgodnie z równaniami:
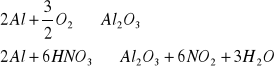
W powyższych reakcjach tlen i kwas azotowy są pasywatorami, pozornie powodują, że glin staje się bardziej szlachetny, niż jest w rzeczywistości., czego dowodem jest zachowanie blaszki zaktywowanej i spasywowanej zanurzonej później w roztworze CuSO4.
1.3. Zaktywowaną i spasywowaną blaszkę oraz krążek platynowy należy zanurzyć równocześnie na 3 minuty do roztworu CuSO4.
![]()
płytka glinowa zaktywowana
![]()
- płytka spasywowana -reakcja zachodzi w znikomy sposób
![]()
reakcja nie zachodzi
Wnioski:
Glin jako metal o niższym potencjale normalnym równym -1,66V wypiera z roztworu soli miedziowej miedz o potencjale +0,34V. Płytka aluminiowa pokrywa się warstewką miedzi (rudawo- bordowy osad). Metal spasywowany zachowuje się jak metal bardziej szlachetny niż jest w rzeczywistości. Reakcja powyższa nie zachodzi lub bardzo minimalnie. Z doświadczenia wynika, że pasywacja metalu jest jednym ze sposobów zapobiegania korozji.
2. Badanie wpływu inhibitora (katalizator ujemny) na rozpuszczalność stali w roztworze H2SO4 - korozja.
Katalizatory są to substancje, które przyspieszają lub opóźniają reakcje. Katalizatory przyspieszające to katalizatory dodatnie, a katalizatory opóźniające to inhibitory lub katalizatory ujemne.
Należy oczyścić do połysku papierem ściernym 2 płytki stalowe. Jedną z płytek zanurzyć w roztworze ![]()
czystym i ![]()
z dodatkiem inhibitora (zanurzyć na 15 minut).
Równania zaobserwowanych reakcji:
![]()
![]()
reakcji nie zachodzi (lub zajdzie lecz w znikomy sposób)
Wnioski:
Przy zanurzeniu płytki stalowej do czystego H2SO4 zauważamy znaczne wydzielanie H2 (wodoru). Po zanurzeniu płytki w H2SO4 z inhibitorem reakcja zachodzi w sposób znikomy (jest praktycznie niewidoczna).
Oznacza to, że w otoczeniu z inhibitorami korozja zachodzi znacznie wolniej, stosowanie ich zapobiega korozji.
.
2
1
Wyszukiwarka
Podobne podstrony:
asfalt, BUDOWNICTWO, INŻ, semestr 3, materiały, sprawozdania III sem + jakies sciagi do ostatniego k
ASFALTY, BUDOWNICTWO, INŻ, semestr 3, materiały, sprawozdania III sem + jakies sciagi do ostatniego
na 4 ko o, BUDOWNICTWO, INŻ, semestr 3, materiały, sprawozdania III sem + jakies sciagi do ostatnieg
otulina, BUDOWNICTWO, INŻ, semestr 3, materiały, sprawozdania III sem + jakies sciagi do ostatniego
materialy3, BUDOWNICTWO, INŻ, semestr 2, Materiały I semestr + beton, Materiały
Projmb.poj otul, BUDOWNICTWO, INŻ, semestr 3, materiały, Materiały
materialy 8.1, BUDOWNICTWO, INŻ, semestr 3, materiały, Materiały
10 - BM stali stopowych - Arek, I Semestr - Materialoznawstwo - sprawozdania
dupa, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, materiały budowlane, sprawoz
sprawozdaniae 5, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, matbud, sprawozda
Sprawozdanie z materiałów budowlanych, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowl
mech, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, matbud, sprawozdania
sprawko zaprawy, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, materiały budowla
sprawozdanie nr 4, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, materiały budow
Sprawozdanie (cechy fizyczne), Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, mat
więcej podobnych podstron