POLITECHNIKA WARSZAWSKA

Zastosowanie jonitów do fizyko - chemicznego usuwania zanieczyszczeń z wody
Wykonali:
Anna Kalbarczyk
Karolina Jankowska
Jan Sosnowski
Piotr Kalinowski
WARSZAWA 2006
Wstęp teoretyczny
Istota wymiany jonowej
Jonity (wymieniacze jonowe, sorbenty jonowymienne) to wielkocząsteczkowe ciała stałe o usieciowanej strukturze, które są nierozpuszczalne w wodzie i innych rozpuszczalnikach oraz są odporne na działanie ługów, kwasów i większości związków organicznych.
Podczas wymiany jonowej obecne w wodzie jony i cząsteczki mające określony ładunek wiązane są przez jonit oddający oddający równocześnie do roztworu jony „nieszkodliwe”, najczęściej OH-, H+, Na+ i Cl-. W procesie tym oprócz „czystej” wymiany jonowej, zachodzą zjawiska sorpcji. W związku z tym trudno jest znaleźć wymieniacz jonowy zapewniający tylko czystą wymianę jonową.
Jeżeli istnieje konieczność usuwania z wody kationów, to stosuje się proces dekationizacji na kationitach, jeżeli anionów - to deanionizacji na anionitach. W razie potrzeby zmniejszenia stężenia kationów i anionów woda oczyszczana jest przy użyciu kationitów i anionitów. Proces wymiany jonów obecnych w oczyszczanej wodzie na jony ruchliwe przyłączone do centrów aktywnych jonitów jest odwracalny i stechiometryczny. Odwracalność reakcji jonowymiennej stwarza jednakową możliwość prowadzenia wymiany jonowej i procesu odwrotnego - regeneracji jonitu.
Wymianę jonową można przedstawić następującymi równaniami reakcji:
Kt - M1 + M+2 ↔ Kt - M2 + M+1,
An - A1 + A-2 ↔ An - A2 + A-1,
gdzie:
Kt - szkielet polimeryczny (lub inny) kationitu,
An - szkielet polimeryczny (lub inny) anionitu,
M+1, M+2 - wymieniane kationy,
A-1, A-2 - wymieniane aniony,
M1, M2 - centra aktywne kationitu zawierające jony wymienialne,
A1, A2 - centra aktywne anionitu zawierające jony wymienialne.
Szybkość reakcji jonowymiennych (dyfuzja w fazie jonit/warstwa międzyfazowa) zależy od następujących czynników:
rodzaju jonitu (rodzaj grup funkcyjnych),
stopnia usieciowania jonitu - ze wzrostem usieciowania maleje szybkość dyfuzji,
prędkości przepływu roztworu „zewnętrznego” (np. wody poddawanej uzdatnianiu) przez złoże - ze wzrostem prędkości przepływu roztworu rośnie szybkość dyfuzji,
stężenie roztworu „zewnętrznego” (np. wody poddawanej uzdatnianiu) -ze wzrostem stężenia rośnie szybkość dyfuzji,
temperatura - ze wzrostem temperatury rośnie szybkość dyfuzji.
Klasyfikacja jonitów
Ogólnie jonity można sklasyfikować ze względu na:
pochodzenie i sposób ich otrzymywania,
rodzaj grup jonowymiennych (charakter grup funkcyjnych).
Klasyfikację jonitów ze względu na ich pochodzenie i sposób otrzymania można
przedstawić następująco:
Klasyfikację jonitów ze względu na rodzaj grup jonowymiennych można przedstawić
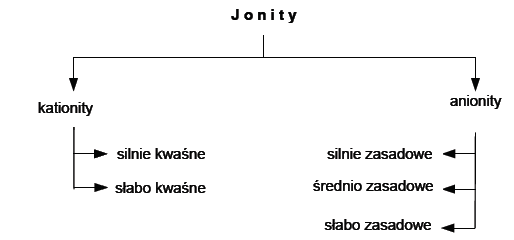
następująco:
Zdolność wymienna jonitu jest głównym parametrem charakteryzującym chemiczne właściwości jonitu oraz jego przydatność w oczyszczaniu wody.
Zdolność wymienna jonitu określa ilość miligramorównoważników (mgR, val lub mval) wymienianych przeciwjonów na jednostkę masy (g) lub objętości wymieniacza jonowego (dm3). Wartość zdolności wymiennej zwiększa się wraz ze wzrostem liczby grup funkcyjnych, a zmniejsza się wraz ze stopniem usieciowania szkieletu jonitu.
Wyróżnia się zdolność wymienną:
całkowitą - jest w zasadzie stała dla danego jonitu. Określa łączną liczbę miligramorównoważników przeciwjonów, które w najkorzystniejszych warunkach mogą być wymienione przez jednostkę masy lub objętości jonitu.
roboczą (użytkową) - ma znaczenie praktyczne, gdyż stanowi tę część całkowitej zdolności wymiennej, która może być wykorzystana w czasie eksploatacji jonitów i wyraża liczbę miligramorównoważników przeciwjonów, które są wymieniane przez jednostkową ilość jonitu, aż do chwili przebicia złoża jonowymiennego. Stanowi ona zwykle 60-80% całkowitej zdolności wymiennej i nie jest wartością stałą. Zależy od warunków prowadzenia procesu wymiany jonowej, składu uzdatnianej wody, dawki i stężenia czynników regenerujących.
Całkowita zdolność wymienna jest w zasadzie stała dla danego jonitu i określa łączną liczbę miligramorównoważników przeciwjonów, które w najkorzystniejszych warunkach mogą być wymienione przez jednostkę masy lub objętości wymieniacza jonowego.
Cykl wymiany jonowej
Pełny cykl pracy wymienników jonowych składa się z:
przygotowanie złoża do pracy
czasu pracy użytecznej jonitu (wymiana jonowa) do założonego stężenia wymienianego jonu (punktu przebicia),
regeneracji złoża, która wymaga:
a) spulchnienia złoża,
b) regeneracji właściwej,
c) płukania złoża.
Jonity sprzedawane są w postaci suchej. Przed wprowadzeniem ich do kolumny jonowymiennej należy zgodnie (z właściwą dla nich procedurą) poddać je procesowi pęcznienia. Określoną masę jonitu należy zalać wodą destylowaną lub roztworem wodnym kwasu /zasady/ soli na czas wskazany przez producenta
Długość czasu użytecznej pracy jonitu zależy przede wszystkim od roboczej zdolności wymiennej jonitu, ilości wymienianych jonów oraz przygotowania złoża do wymiany jonowej. Pomiędzy stopniem zregenerowania złoża a czasem jego użytecznej pracy istnieje wprost proporcjonalna zależność. Podczas wymiany jonowej oczyszczany roztwór z określoną prędkością przepływa przez złoże (najczęściej w kierunku z góry na dół). Prędkość ta zależy od rodzaju jonitu, wysokości złoża, średnicy kolumny i zwykle mieści się w granicach 20-60 m/h. Proces wymiany jonowej trwa do momentu „przebicia złoża”, tzn. osiągnięcia założonego stężenie wymienianego jonu w oczyszczonym roztworze (rys.1).
Regeneracja właściwa polega na przepuszczeniu przez zużyte złoże roztworu czynnika regenerującego, np. roztworu chlorku sodu w przypadku gdy stosowano kationit w formie sodowej. Z grup funkcyjnych jonitu usuwane są jony, które wprowadzone zostały w czasie wymiany jonowej. Zastępowane są one przez odpowiednie jony pochodzące od czynnika regenerującego (regeneranta), np. Na+ z NaCl lub H+ z HCl. Do regeneracji jonitów (kationitów i anionitów) stosuje się odpowiednio roztwory kwasów, zasad i soli, np. HCl, H2SO4, CaCl2, NaOH, Na2CO3, NH4OH. W celu usunięcia ze złoża pozostałego regeneranta złoże należy przepłukać wodą zdemineralizowaną. Koniec tego etapu kontrolować można analitycznie (np. oznaczając stężenie jonów chlorkowych w wycieku z kolumny, jeżeli do regeneracji zastosowano chlorek sodu lub mierząc pH wycieku, jeżeli do regeneracji zastosowano kwas solny).
Twardość
Twardość niewęglanowa jest wynikiem obecności w wodzie chlorków, siarczanów, krzemianów, azotanów, fosforanów wapnia i magnezu. Twardość węglanowa wynika z obecności w wodzie wodorowęglanów wapnia i magnezu. Twardość ogólna jest sumą wartości węglanowej i niewęglanowej.
W zależności od wymaganego stopnia zmniejszenia twardości wody oraz rodzaju usuwanej twardości stosuje się wymianę jonową:
a) w cyklu wodorowym na kationitach słabo kwaśnych - usuwanie twardości węglanowej,
b) w cyklu sodowym lub wodorowym na kationitach silnie kwaśnych - usuwanie twardości węglanowej i niewęglanowej,
c) w cyklu wodorowym i cyklu sodowym - usuwanie twardości węglanowej i niewęglanowej,
d) w cyklu wodorowym (kationit słabo kwaśny - dekarbonizacja + kationit silnie kwaśny - usuwanie twardości niewęglanowej),
e) dekarbonizacja i dekationizacja na kationicie silnie kwaśnym pracującym w cyklu sodowym i anionicie silnie zasadowym pracującym w cyklu chlorkowym.
Zmiękczanie wody polega na przepuszczaniu wody przez kationit sodowy. W ten sposób usuwa się z wody twardość wapniową i magnezową. Podczas zmiękczania wody na jonitach zasadowość jej nie ulega zmianie, gdyż wodorowęglany wapnia i magnezu przechodzą w wodorowęglan sodu w ilościach równoważnych.
Zasadowość
Pozbywanie się zasadowości - równoznaczne z pozbywaniem się węglanów - nosi nazwę dekarbonizacji. Dekarbonizację można przeprowadzić na kationicie słabo kwaśnym w formie wodorowej oraz na kationicie silnie kwaśnym pracującym w cyklu wodorowym. W drugim przypadku, oprócz dwutlenku węgla, powstają kwasy mineralne. Zwiększają one korozyjne właściwości wody i z tego powodu nie zleca się ich stosowania jako jedynych jonitów w układzie technologicznym. Zastosowanie tego typu jonitów pozwala jednak na usunięcie twardości węglanowej i niewęglanowej.
Metodyka badań
Dla każdej grupy zostały przygotowane po 2 kolumny jonitów.
Regeneracja jonitu
Regenerację obu używanych w doświadczeniu kolumn kationitu należy przeprowadzić przy użyciu kwasu solnego 1+4 HCl. W rozdzielaczu umieścić 50 cm3 kwasu i przepuścić go przez złoże z prędkością 4 cm3/minutę, uważając by nie zapowietrzyć złoża. Następnie przepuścić przez złoże 50 cm3 wody destylowanej z tą samą prędkością do uzyskania obojętnego odczynu przesączu.
Oznaczanie całkowitej zdolności jonowymiennej
Aby określić całkowitą zdolność jonowymienną badanego kationitu należy przepuścić przez kolumnę 50 cm3 roztworu NaCl z prędkością 4 cm3/minutę, przesącz zbierając do kolby miarowej o pojemności 250 cm3. Przepuścić przez kolumnę 50 cm3 wody destylowanej zbierając przesącz do tej samej kolby. Następnie kolbę dopełnić do kreski wodą destylowaną i oznaczyć ilość HCl w kolbie poprzez miareczkowanie roztworem 0,1 N NaOH wobec oranżu metylowego.
Całkowitą zdolność jonowymienną obliczyć ze wzoru:
![]()
[mval/cm3]
V - objętość złoża [cm3]
N - normalność użytego NaOH
x - ilość roztworu NaOH zużyta na miareczkowanie próbki [cm3]
Oznaczanie roboczej zdolności jonowymiennej
Przed przystąpieniem do wykonania tego podpunktu należy zregenerować jonit wg. Powyższej metodyki.
Przez kolumnę zregenerowanego jonitu przepuścić roztwór MgCl2 z prędkością 4 cm3/minutę. Na powierzchni ziaren kationitu nastąpi wymiana jonów wodoru na jony magnezu. Odciek zbierać do zlewki, w której uprzednio umieszczono po 1 cm3 wodorofosforanu sodu i roztworu amoniaku. Roztwór przepuszczano do czasu pojawienia się zmętnienia w odcieku, co było oznaką przebicia złoża.
Roboczą zdolność jonowymienną obliczono według wzoru:
![]()
[mval/cm3]
V - objętość złoża [cm3]
x - ilość roztworu MgCl2 wprowadzona do kolumny zużyta do przebicia złoża [cm3]
Oznaczenie zasadowości i zawartości jonów wapnia i magnezu w wodzie surowej
Zasadowość badanej wody oznaczamy metodą miareczkowania objętości 100 cm3 wody 0,1 N kwasem solnym wobec oranżu metylowego do zmiany zabarwienia z żółtej na żółtopomarańczową. Zasadowość obliczamy ze wzoru:
Z = ![]()
[mval/dm3]
N - normalność użytego HCl
x - ilość roztworu HCl zużyta na miareczkowanie próbki [cm3]
W celu oznaczenia zawartości jonów wapnia do 50 cm3 wody dodać ½ objętości kwasu solnego zużytego na oznaczanie zasadowości, 5 ml NaOH w stężeniu 44 g/l, dodać szczyptę mureksydu, wymieszać i miareczkować 0,01 M EDTA do zmiany zabarwienia z różowej na fioletową. Następnie, w celu oznaczenia zawartości jonów magnezu do tej samej kolby dodać 4 ml 4N HCl do odbarwienia, dodać 7 ml NH4OH i miareczkować 0,01 M EDTA wobec czerni eriochromowej do zmiany zabarwienia z czerwonej na niebieską.
Określenie czasu eksploatacji złoża
Przez dwie kolumny kationitu przepuścić porcjami po 50 cm3 badanej wody, po każdym przepuszczeniu badać zawartość HCl w odcieku poprzez miareczkowanie roztworem 0,1 N NaOH wobec oranżu metylowego. Przez pierwszą kolumnę wodę przepuszczać z prędkością ok. 4 cm3/minutę, a przez drugą drugiej z maksymalną prędkością przepływu. Przez każdą kolumnę należy przepuścić cztery razy po 50 cm3 badanej wody.
Czas eksploatacji złoża obliczyć ze wzoru:
![]()
PC - całkowita zdolność jonowymienna złoża [mval/cm3]
V - objętość złoża [cm3]
RSR - średnia zawartość HCl w odcieku z jednego przepuszczenia [mval]
Opracowane wyników i wniosków
Należy określić czas eksploatacji złoża oraz zdolność wymienną jonitu.
Otrzymane wyniki należy przedstawić w formie tabelarycznej.
Wyszukiwarka
Podobne podstrony:
8288
8288
8288
8288
8288
8288
więcej podobnych podstron